基因芯片筛选脂蛋白脂酶基因杂合敲除小鼠的差异表达基因 和通路
陈宁欣,韩亭亭,郑 爽,刘 伟,胡耀敏
上海交通大学医学院附属仁济医院内分泌科,上海 200127
随着社会经济的发展及人们生活水平的提高,罹患糖尿病的人群数量呈快速攀升的趋势。2013 年全国流行病学调查结果显示,我国18 岁及以上人群的糖尿病及糖尿病前期的患病率分别为10.9%和35.7%[1]。糖尿病的发生可增加各类慢性并发症的风险,不仅会危害人们的生命健康,也给国家带来了较重的医疗负担。因此,阐明糖尿病的发病机制对于该疾病的预防和治疗具有重大意义。目前,脂毒性在2 型糖尿病(type 2 diabetes mellitus,T2DM)的发生与发展中扮演重要角色。Banting 科学成就奖获得者McGarry 教授[2]提出,脂代谢障碍是T2DM的原发病理生理改变,T2DM 糖代谢紊乱的根源即为脂代谢异常,甚至还将T2DM 称为“糖脂病”。流行病学研究调查结果显示,高甘油三酯血症(hypertriglyceridemia,HTG)是T2DM 发病的独立危险因素[3]。脂蛋白脂酶(lipoprotein lipase,LPL)是催化乳糜微粒(chylomicron,CM)和极低密度脂蛋白(very low-density lipoprotein,VLDL)中三酰甘油(triacylglycerol,TAG)水解的关键酶,其结构和功能的异常可引发HTG[4]。本课题组的前期研究[5-6]发现,Lpl 基因敲除的杂合(Lpl+/-)小鼠可通过HTG 直接诱发糖代谢异常;随后,进一步研究[7]发现Lpl+/-小鼠出现了胰岛脂滴沉积,经胰岛β 细胞葡萄糖刺激后,其胰岛素分泌能力出现明显下降。继而推测,脂毒性可通过引起胰岛β 细胞功能障碍来诱发糖代谢异常,但其具体的分子机制尚需进一步探索。
基因芯片具有高通量及高灵敏度的优点,能够高效率地筛选正常组织和病理组织中差异表达的基因,有助于深入认识疾病发生的分子机制,以达到对疾病的早期诊断及干预。本研究通过基因芯片筛选Lpl+/-小鼠和野生型(wild type,WT)C57BL/6 小鼠的胰岛组织中的差异表达基因(differentially expressed genes,DEGs),并利用生物信息学分析对这些基因进行聚类和功能富集分析,以期为寻找脂毒性介导T2DM 的发病过程中的新的分子机制提供参考和依据。
1 对象和方法
1.1 实验动物及主要试剂
40 周龄SPF 级雄性Lpl+/-小鼠及WT C57BL/6 小鼠由北京大学医学部实验动物科学部提供[生产许可证号为SCXK(京)2016-2018],体质量为(25±5) g。所有动物饲养于上海交通大学医学院附属仁济医院动物房清洁级屏障系统中,使用许可证号为SYXK(沪)2011-2021。小鼠饲以标准饲料,分笼喂养,自由进食和饮水。饲养条件如下:照明周期为12 h/12 h,温度为21 ℃,湿度为50%~55%。所有动物相关操作均遵循国家及上海交通大学医学院附属仁济医院有关动物伦理规定及条例。
胶原酶Ⅴ(Sigma,美国),1640 培养基(Gibco,美国),胎牛血清(Gibco,美国),TRIzol 试剂(Invitrogen,美国),反转录试剂盒(TaKaRa,日本),SYBR Premix Ex Taq 试剂盒(TaKaRa,日本)。
1.2 研究方法
1.2.1 胰岛的分离及纯化 麻醉后取小鼠仰卧位固定,显微镜下找到小鼠胆总管近肝门处,经胆总管插管逆行注入0 ℃胶原酶Ⅴ消化液。待胰腺缓慢膨胀后,摘除整个胰腺,后经胶原酶Ⅴ消化、密度梯度离心法分离胰岛。于显微镜下手工挑选完整胰岛,加入1640 培养基(含10%胎牛血清),在37 ℃、5% CO2培养箱中孵育24 h 后更换培养基,用于后续实验。
1.2.2 微阵列芯片杂交与数据分析 微阵列芯片杂交实验委托上海慧算生物技术有限公司完成。使用STAR 软件统计基因的原始序列计数,使用R 语言中DESeq2 筛选Lpl+/-小鼠及WT 小鼠胰岛组织中DEGs。基因表达的差异用P 值和差异倍数(fold change,FC)的对数(log2FC)表 示。将P<0.05 且|log2FC|>2 的 基 因 视 为DEGs。使用R 语言中的clusterProfiler 包对DEGs 进行GO(Gene Ontology) 功 能 分 析 和KEGG(Kyoto Encyclopedia of Genes and Genome)通路分析,分析结果以P<0.05 为入选标准。
1.2.3 RNA 抽提及实时荧光定量PCR 检测 将离体培养的胰岛组织收集于离心管中,低速离心获得沉淀。向其中加入磷酸盐缓冲液漂洗后,立即加入总RNA 抽提试剂TRIzol,并依照产品说明书操作提取总RNA。而后,采用超微量分光光度计对RNA 浓度进行测定,分装后冻存于-80 ℃备用。采用实时荧光定量PCR(quantitative realtime PCR,qPCR)对DEGs 中与胰岛β 细胞功能最密切相关的基因进行验证。根据反转录试剂盒说明书,将相关试剂与0.5 μg 总RNA 混合均匀(总体积为10 μL,加入RNA 体积根据浓度计算)进行反应,条件如下:37 ℃ 15 min,85 ℃ 5 s,4 ℃ 5 min。而后使用SYBR Premix Ex Taq 试剂盒,将1 μL cDNA 与相关试剂混合配置10 μL反应体系进行qPCR 反应,条件如下:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 20 s,共20 个循环。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,Gapdh)为内参,基因的相对表达量用2-ΔΔCT进行分析。所有数据均进行3 次分析(即设置3 个复孔)。Gremlin 1(Grem1)、骨形态形成蛋白2(bone morphogenetic protein 2,Bmp-2)、Bmp-4 及Gapdh 引物均由上海冠泰生物科技有限公司合成,引物序列见表1。
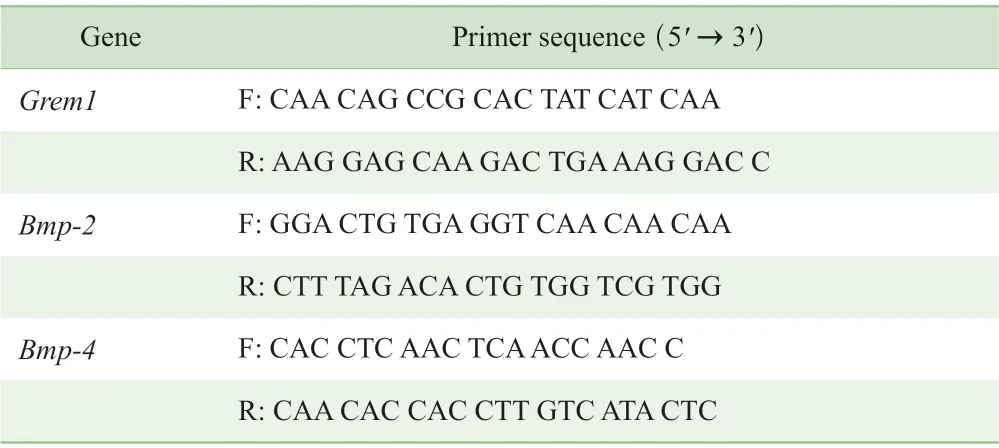
表1 qPCR 引物序列Tab 1 Primer sequences for qPCR

Continued Tab
1.3 统计学方法
采用GraphPad Prism 7.0 软件对研究数据进行统计分析。qPCR 数据用±s 表示,采用t 检验进行比较。P<0.05 表示差异具有统计学意义。
2 结果
2.1 筛选DEGs
本研究采用R 语言中DESeq2 对Lpl+/-小鼠及WT 小鼠胰岛组织中的DEGs 进行筛选,并采用火山图和聚类热图进行分析。结果显示共筛选出187 个DEGs,上调基因6 个、下调基因181 个(图1、2);其中,表达差异最为显著的前10 个基因见表2。
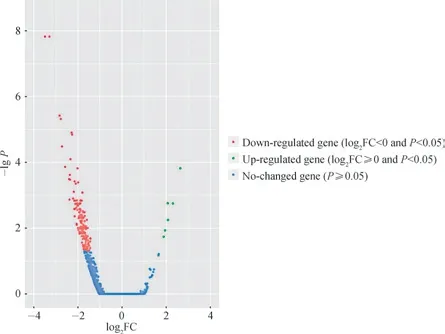
图1 Lpl+/-小鼠与WT 小鼠DEGs 的火山图分析Fig 1 Volcano plot of DEGs between Lpl+/- mice and WT mice
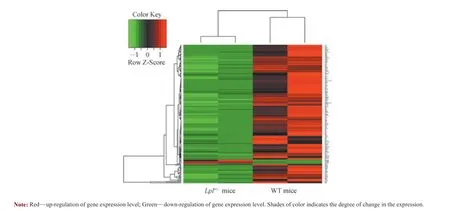
图2 Lpl+/-小鼠与WT 小鼠DEGs 的聚类热图Fig 2 Heat map of DEGs between Lpl+/- mice and WT mice

表2 DEGs 中排名前10 的基因列表Tab 2 Top 10 genes of DEGs
2.2 GO 功能分析
本研究采用R 语言中的clusterProfiler 包进行GO 功能分析,以P<0.05 进行筛选,结果(图3)显示DEGs主要富集在与T 细胞、B 细胞等免疫细胞激活和侵袭以及细胞黏附相关的生物过程,同时与细胞质膜蛋白等细胞组成和细胞因子受体活性调节等生物功能密切相关。
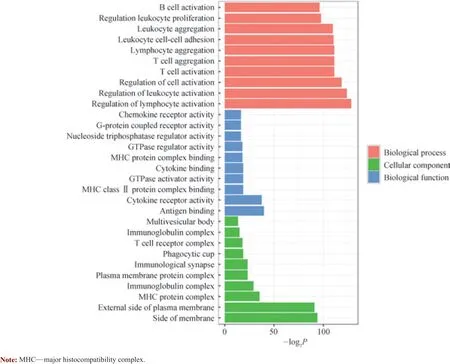
图3 DEGs 的GO 功能分析Fig 3 GO function analysis of DEGs
2.3 KEGG 通路分析
随后,本研究使用KEGG 对DEGs 进行通路富集分析,结果(图4)显示这些基因主要富集在免疫细胞增殖分化、炎症信号通路、血管形成和细胞黏附相关通路上,且与Lpl+/-小鼠的胰岛β 细胞功能障碍相关。
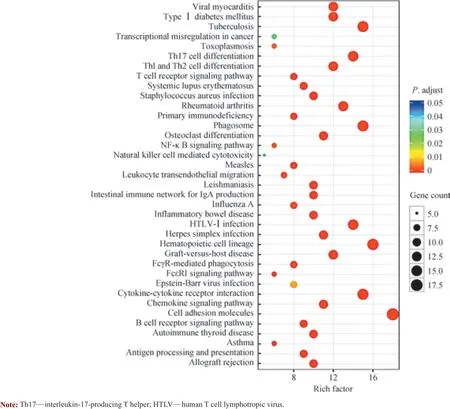
图4 DEGs 的KEGG 通路分析Fig 4 KEGG pathway analysis of DEGs
2.4 关键基因的表达验证
在上述罗列的前10 个DEGs 中,Grem1 编码的蛋白gremlin 1 为BMP 拮抗剂家族的成员[8],该蛋白可通过与BMP-2、BMP-4 蛋白的直接结合阻断BMP 作用的信号通路。研究[9]发现,BMP 可参与胚胎期胰腺生长、增殖及分化的调节,与胰岛β 细胞功能有密切关系。基于此,本研究选择Grem1 进行验证;结果(图5)显示,与WT小鼠相比,Lpl+/-小鼠胰岛组织中Grem1 的表达量下降了75%,而Bmp-2 及Bmp-4 的表达量则增加了1 倍甚至 更多。
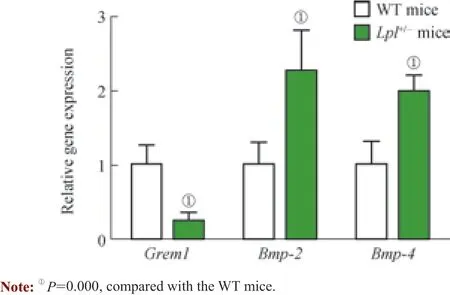
图5 qPCR 检测WT 小鼠和Lpl+/-小鼠胰岛组织中关键基因的表达水平Fig 5 Expression levels of key genes in the islet tissues of WT mice and Lpl+/- mice
3 讨论
胰岛β 细胞功能异常是导致T2DM 的核心病理生理基础之一,同时脂代谢紊乱在其发病过程中亦发挥着重要作用。脂毒性是指血中的游离脂肪酸(free fatty acid,FFA)水平长期较高,而超过了脂肪组织的储存能力及各组织对FFA 的氧化能力,使得过多的FFA 以TAG 的形式沉积在非脂肪组织,从而造成对该组织的损伤[2]。FFA 的长期作用可诱导β 细胞凋亡、引起β 细胞坏死,以减少β 细胞数目。研究[6]发现,呈现HTG 的Lpl+/-小鼠的脂代谢障碍在发生时间的顺序上优先于糖代谢紊乱,可以很好地模拟HTG 引发T2DM 的病理生理过程。本课题组的前期研究[7]表明,Lpl+/-小鼠出现胰岛脂滴沉积、胰岛β 细胞团体积减小同时细胞凋亡增加,Lpl+/-小鼠胰岛细胞经葡萄糖刺激后胰岛素的分泌能力明显下降,而这些结果亦在体外高脂模型(棕榈酸刺激的胰岛β 细胞)中得到了进一步证实。为了探讨可能的分子机制,本研究将Lpl+/-小鼠及WT 小鼠的胰岛进行分离并纯化,利用基因芯片筛选小鼠胰岛中的DEGs,并采用生物信息学方法对这些基因进行聚类分析和功能富集,选择关键基因进行表达验证。
在表达差异最为显著的前10 个基因中,Ighe、Ighg1、Ighg2b、Igkv9-120 是免疫反应中抗原结合、免疫球蛋白产生及免疫球蛋白受体结合相关的分子;Ifi202b 参与黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)炎症体激活的负向调控,且有研究[10]表明该基因还参与了小鼠脂肪干细胞的脂肪生成;有研究者发现,Ubd 在老化和慢性疾病中具有免疫代谢调节作用,还可介导慢性肾脏疾病中核因子-κB(nuclear factor-κB,NF-κB)的激活从而促进肾小管间质炎症的发生与发展[11-12];Mmp12 与动脉硬化相关,还可通过调节细胞因子水平来调节小鼠的炎症反应[13];Cxcl9 在皮炎的小鼠模型中表达显著升高,且与炎症的严重程度相关,同时也参与了某些自身免疫疾病的发生[14];Gimap3 可与核酸及GTP 相结合,与T 细胞发生和存活相关。针对以上基因,目前暂无相关证据表明其与胰岛β 细胞功能或T2DM 存在相关性。但值得注意的是,Grem1 编码合成的gremlin 1 属于BMP 拮抗剂家族的重要成员,可阻断下游BMP 信号通路。BMP 是转化生长因子-β(transforming growth factor-β,TGF-β)超家族的一员,包括大量保守结构区域的分泌信号分子,可在控制胚胎发育及分化过程中发挥关键作用,还参与胚胎期胰腺生长、增殖及分化的调节[9]。有研究[15]表明,促炎细胞因子白细胞介素-1β(interleukin-1β,IL-1β)及干扰素-γ(interferon-γ,IFN-γ)可能通过激活BMP-2 诱导胰岛β 细胞的凋亡及功能障碍。而BMP-2 和BMP-4 的表达则能够对胰岛β 细胞的增殖及分泌功能产生抑制作用[16]。Sakhneny 等[17]研究发现,胰岛β 细胞可表达BMP-4 的受体,且BMP-4 与β 细胞功能相关。上述研究均提示,BMP 信号通路可能在糖尿病胰岛功能异常中扮演着重要角色。因此,本研究利用qPCR 对基因芯片的结果进行验证发现,Lpl+/-小鼠胰岛组织中Grem1 的表达量较WT 小鼠显著下降,而Bmp-2 及Bmp-4 的表达量则明显增加;继而推测,gremlin 1 及其下游BMPs 信号通路可能参与了由脂毒性介导的胰岛β 细胞功能障碍的发生及发展。此外,还有研究[18-19]表明Grem1 可能与T2DM 患者的蛋白尿及糖尿病肾病的发生相关。
通过对DEGs 进行GO 功能分析和KEGG 通路分析,发现DEGs 参与了免疫细胞增殖分化、炎症信号通路、血管形成和细胞黏附相关通路。已经有研究[20]证实了脂毒性诱导的炎症反应在胰岛功能障碍中的作用,即在高脂喂养的小鼠中,胰岛组织中巨噬细胞的浸润显著增加;还有研究[21]发现胰岛β 细胞内的脂肪细胞可分泌细胞因子及趋化因子,通过激活炎症信号通路导致β 细胞功能障碍。本课题组最新的研究[7]结果也证实,在Lpl+/-小鼠血清中和棕榈酸刺激的胰岛β 细胞上清液中,肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、促炎细胞因子IL-1β、IL-6 及巨噬细胞移动抑制因子(macrophage migration inhibition factor,MIF)的水平明显上升,Lpl+/-小鼠胰岛组织上清液中MIF 的表达也显著增加,同时Lpl+/-小鼠胰岛组织和棕榈酸刺激的胰岛β 细胞中NF-κB 抑制因子(inhibitor of nuclear factor-κB,IκB) /NF-κB 炎 症 信 号通路被激活,且与β 细胞功能障碍密切相关。而另有研究[22]发现,FFA 可招募外周循环中的炎症型单核细胞至胰岛组织中并转化为M1 型巨噬细胞,实现对胰岛组织中炎症细胞因子表达的上调,进而导致胰岛β 细胞功能 障碍。
本研究GO 功能分析还发现,DEGs 主要富集在T 细胞、B 细胞等免疫细胞激活的生物过程,同时亦有越来越多的研究开始关注自身免疫在糖尿病发病过程中的作用。自身免疫是一种多因素参与的对自身构成成分产生免疫反应的过程,主要特点是自身耐受的缺失以及B 细胞和T细胞慢性的过度反应。研究[23]显示,T2DM 患者胰岛中的促炎细胞因子被激活,可引发免疫反应导致胰岛功能异常,这种由炎症导致的组织损伤会进一步增强自身免疫反应,从而形成恶性循环;且在T2DM 患者的胰岛中可观察到免疫细胞的交替和免疫细胞的浸润。此外,M1 型巨噬细胞可分泌大量的促炎因子包括IL-12、TNF-α、IL-1、IL-6 等以及趋化因子以参与炎症反应,进而导致胰岛β 细胞功能障碍的发生。而B 细胞与T 细胞的直接作用对胰岛β 细胞功能的影响尚缺乏相关证据。因此,更加深入地探索自身免疫在T2DM 发生与发展中的作用和相关机制,或将有助于在临床上对糖尿病的分型和治疗提供参考。
综上所述,本研究通过基因芯片筛选WT 小鼠及Lpl+/-小鼠的DEGs,并针对这些基因开展相关功能及通路分析,发现DEGs 主要富集于自身免疫和炎症信号通路,同时脂毒性导致的Grem1 表达下调可能与胰岛β 细胞功能障碍的发生密切相关。该结果或将为进一步理解和认识脂毒性导致T2DM 的发病机制提供参考,同时也将为后续的T2DM 病因研究提供新的方向。
参·考·文·献
[1] Wang LM, Gao P, Zhang M, et al. Prevalence and ethnic pattern of diabetes and prediabetes in China in 2013[J]. JAMA, 2017, 317(24): 2515-2523.
[2] McGarry JD. Banting lecture 2001: dysregulation of fatty acid metabolism in the etiology of type 2 diabetes[J]. Diabetes, 2002, 51(1): 7-18.
[3] Tirosh A, Shai I, Bitzur R, et al. Changes in triglyceride levels over time and risk of type 2 diabetes in young men[J]. Diabetes Care, 2008, 31(10): 2032-2037.
[4] Olivecrona G. Role of lipoprotein lipase in lipid metabolism[J]. Curr Opin Lipidol, 2016, 27(3): 233-241.
[5] 金晶, 胡耀敏, 李圣贤, 等. 脂蛋白脂酶基因敲除小鼠糖脂代谢及胰岛素敏感性研究[J]. 中华内分泌代谢杂志, 2011, 27(5): 427-429.
[6] 李阳雪, 郑爽, 韩亭亭, 等. 脂蛋白脂酶基因敲除小鼠糖脂代谢研究及其胰岛素抵抗的机制探索[J]. 中华内分泌代谢杂志, 2015, 31(2): 143-147.
[7] Zheng S, Ren XX, Han TT, et al. Fenofibrate attenuates fatty acid-induced islet β-cell dysfunction and apoptosis via inhibiting the NF-κB/MIF dependent inflammatory pathway[J]. Metab Clin Exp, 2017, 77: 23-38.
[8] Müller I, Schönberger T, Schneider M, et al. Gremlin-1 is an inhibitor of macrophage migration inhibitory factor and attenuates atherosclerotic plaque growth in ApoE-/-mice[J]. J Biol Chem, 2013, 288(44): 31635-31645.
[9] Grgurevic L, Christensen GL, Schulz TJ, et al. Bone morphogenetic proteins in inflammation, glucose homeostasis and adipose tissue energy metabolism[J]. Cytokine Growth Factor Rev, 2016, 27: 105-118.
[10] Cao YH, Wang LS, Wang CY, et al. Sex differences in correlation with gene expression levels between Ifi200 family genes and four sets of immune diseaserelevant genes[J]. J Immunol Res, 2018, 2018: 1290814.
[11] Kawamoto A, Nagata S, Anzai S, et al. Ubiquitin D is upregulated by synergy of notch signalling and TNF-α in the inflamed intestinal epithelia of IBD patients[J]. J Crohns Colitis, 2019, 13(4): 495-509.
[12] Zhang JY, Wang MX, Tian L, et al. UBD modifies APOL1-induced kidney disease risk[J]. Proc Natl Acad Sci U S A, 2018, 115(13): 3446-3451.
[13] Wolf M, Maltseva I, Clay SM, et al. Effects of MMP12 on cell motility and inflammation during corneal epithelial repair[J]. Exp Eye Res, 2017, 160: 11-20.
[14] Ruiduo C, Ying D, Qowei W. CXCL9 promotes the progression of diffuse large B-cell lymphoma through up-regulating β-catenin[J]. Biomedecine Pharmacother, 2018, 107: 689-695.
[15] Ibarra Urizar A, Friberg J, Christensen DP, et al. Inflammatory cytokines stimulate bone morphogenetic protein-2 expression and release from pancreatic β cells[J]. J Interferon Cytokine Res, 2016, 36(1): 20-29.
[16] Bruun C, Christensen GL, Jacobsen MLB, et al. Inhibition of β cell growth and function by bone morphogenetic proteins[J]. Diabetologia, 2014, 57(12): 2546-2554.
[17] Sakhneny L, Rachi E, Epshtein A, et al. Pancreatic pericytes support β-cell function in a Tcf7l2-dependent manner[J]. Diabetes, 2018, 67(3): 437-447.
[18] Khokha MK, Hsu D, Brunet LJ, et al. Gremlin is the BMP antagonist required for maintenance of Shh and Fgf signals during limb patterning[J]. Nat Genet, 2003, 34(3): 303-307.
[19] Thameem F, Puppala S, He X, et al. Evaluation of gremlin 1 (GREM1) as a candidate susceptibility gene for albuminuria-related traits in Mexican Americans with type 2 diabetes mellitus[J]. Metab Clin Exp, 2009, 58(10): 1496-1502.
[20] Ehses JA, Perren A, Eppler E, et al. Increased number of islet-associated macrophages in type 2 diabetes[J]. Diabetes, 2007, 56(9): 2356-2370.
[21] Eizirik DL, Mandrup-Poulsen T. A choice of death: the signal-transduction of immune-mediated β-cell apoptosis[J]. Diabetologia, 2001, 44(12): 2115-2133.
[22] Eguchi K, Manabe I, Oishi-Tanaka Y, et al. Saturated fatty acid and TLR signaling link β cell dysfunction and islet inflammation[J]. Cell Metab, 2012, 15(4): 518-533.
[23] Eguchi K, Nagai R. Islet inflammation in type 2 diabetes and physiology[J]. J Clin Invest, 2017, 127(1): 14-23.

