检测PCV2抗体水平的两种ELISA方法对比分析
王洪利,隋兆峰,于淼,姜平,王志远
(1. 山东畜牧兽医职业学院,山东 潍坊 261061;2. 南京农业大学动物医学院,江苏 南京 210095)
猪圆环病毒2型(porcine circovirus 2,PCV2)属于圆环病毒科、圆环病毒属,是导致断仔奶猪多系统衰竭综合征(PMWS)的主要病原。PMWS主要特征是消瘦、呼吸困难、皮肤及可视黏膜苍白或黄疸、腹股沟淋巴结肿大等,该病自1991年在加拿大出现以来,很快波及所有主要养猪国家,严重影响着世界养猪业的发展[1]。我国在2000年通过血清学调査发现,北京、上海、天津、河北、江苏等地的猪群中存在PCV2感染抗体[2]。
防控PCV2感染和流行,特定的血清学检测必不可少。ELISA方法具有灵敏、快速、操作简单等优点,对实验条件和实验人员要求不高,是适合于大规模检测的方法。目前用于PCV2抗体检测的方法主要是阻断ELISA法和间接ELISA法。间接ELISA法有两种,一种是以细胞培养的PCV2全病毒作抗原的间接ELISA,另一种是以PCV2重组Cap蛋白作为包被抗原的间接ELISA。因后一种使用的包被抗原表达产量高,能有效区分PCV1与PCV2抗体,故得到了更为广泛的应用;阻断ELISA法是以PCV2的细胞培养物为抗原,应用重组Cap蛋白单克隆竞争试剂,可特异性检测PCV2抗体,适合大规模的检测应用[3-4]。Cap蛋白是PCV2的主要结构蛋白,且具有型特异性。
本研究采用的以PCV2重组Cap蛋白作为包被抗原的间接ELISA试剂盒和阻断ELISA试剂盒,为南京农业大学农业部动物疫病诊断与免疫重点开放实验室试制,对PCV2人工感染猪和自然感染猪抗体水平进行检测和分析,比较两种ELISA试剂盒检测效果,为PCV2感染的流行病学诊断、疫苗免疫效果评价提供参考依据。
1 材料与方法
1.1 毒株与佐剂
PCV2 SH株(106.0TCID50/mL),为上海某猪场分离株,由南京农业大学农业部动物疫病诊断与免疫重点开放实验室保存与提供。
1.2 检测试剂盒
PCV2阻断ELISA抗体检测试剂盒,由南京农业大学农业部动物疫病诊断与免疫重点开放实验室试制(批号为1101);PCV2间接ELISA抗体检测试剂盒(商品名:猪圆环病毒2-dCap-ELISA抗体检测试剂盒),购自瑞普(保定)生物药业有限公司。
1.3 试验动物
1.3.1 PCV2人工感染试验用猪
30~35 d健康猪15头,PRRSV和PCV2病毒阴性及其抗体阴性,购自江苏南农高科技股份有限公司。
1.3.2 PCV2自然感染猪
来自浙江某规模猪场保育猪群。8周龄时部分保育仔猪陆续发病,主要症状为肌肉无力、呼吸困难、贫血、黄疸、下痢、生长发育不良。病理剖检见淋巴结显著肿大,切面硬、呈白色;肺脏肿胀,坚硬或似橡皮;肝萎缩;脾肿大及大面积梗死;肾肿大,被膜下有坏死灶;结肠水肿,肠黏膜充血或淤血,胃溃疡。发病率为4%,病死率为43%。根据临床表现,判断该猪场发生了PMWS。PCR检测患病猪血液样品,证实了PCV2感染。该场未免疫PCV2疫苗。选择亚临床感染猪和发病猪各20头。
1.4 PCV2人工感染试验
将15头试验猪随机分为3组,每组5头,分别为对照组、PCV2攻毒组(PCV2)、PCV2攻毒后佐剂刺激组(PCV2+KHL)。PCV2组和PCV2+KHL组每头猪接种PK15细胞培养的PCV2 SH株(106.0TCID50/mL),滴鼻和肌肉注射各2 mL,分别隔离饲养;PCV2+KHL组于攻毒后3 d,肌肉多点注射KHL各2 mL;空白对照组接种未感染病毒的PK15细胞培养物上清液,滴鼻和肌肉注射各2 mL。
1.5 待检血清的采集
分别于接种后的0、2、4、6、8、10周对人工感染猪前腔静脉采血10 mL;发病猪场PMWS亚临床感染猪和发病猪,于发病时(8周龄)前腔静脉采血10 mL。在血液凝固后,离心分离血清,每份血清样品分装于4个灭菌1.5 mL离心管中,每管装入血清0.5 mL以上,-40 ℃保存。
1.6 检测方法
分别采用阻断ELISA和间接ELISA对采集的血清样品进行PCV2抗体检测。
1.6.1 阻断ELISA抗体检测
按试剂盒说明书进行操作。取试剂盒置室温,待盒内试剂恢复到室温,取10倍浓缩洗涤液,用蒸馏水稀释为1倍。用血清稀释液在稀释板内将待检血清1∶1稀释,振荡混匀。取抗原包被板,每孔加入稀释好的待检血清100 μL,置37 ℃孵育2 h。甩掉抗原包被板孔中的溶液,每孔加入200~300 μL洗涤液,静置1 min,倒掉洗涤液,重复洗板5次,吸水纸拍干抗原包被板。每孔加入100 μL酶标鼠单抗工作液,置37℃孵育30 min,洗涤液洗板5次,方法同上。加TMB底物液,100 μL/孔,室温或37℃避光显色10~15 min,至阴性对照显蓝色,阳性对照基本不显色时,每孔加终止液50 μL。在酶标仪上读取样品OD450的光密度值。当阴性对照OD450值>0.8、阳性对照OD450值<0.4时,试验条件成立。计算等电点(PI)值:PI值=(阴性对照OD450均值-待检样品OD450值)/阴性对照OD450均值。
结果判定:PI值≥38%判为阳性,PI值≤30%判为阴性,30% 1.6.2 间接ELISA抗体试剂盒检测 按试剂盒说明书进行操作。待试剂盒内的试剂恢复到室温,取20倍浓缩洗涤液(血清稀释液),用蒸馏水稀释为1倍。用血清稀释液在稀释板内将待检血清1∶400稀释(100 μL样品稀释液中加0.25 μL待检血清),振荡混匀。取抗原包被板,每孔加入100 μL稀释好的待检血清,37 ℃孵育30 min。洗板后每孔加入山羊抗猪IgG酶标二抗工作液100 μL,置37 ℃孵育30 min,洗涤液洗板。等体积混合显色液A液、显色液B液,混匀,100 μL/孔,室温避光显色10 min;每孔加终止液50 μL,在酶标仪上读取样品OD450的光密度值。计算S/P值: S/P值=(待检样本OD450均值-阴性对照OD450均值)/(强阳性对照OD450均值-阴性对照OD450均值)。 结果判定:S/P值≥0.25判为阳性,S/P值≤0.16判为阴性,0.16 由图1和图2可见,PCV2攻毒组和PCV2攻毒后佐剂KHL刺激组试验猪,用两种试剂盒检测结果基本一致,PCV2抗体均于接种后2~3周出现,6~8周达到最高,直至第16周仍维持较高水平;PCV2攻毒后佐剂刺激组试验猪产生的抗体水平明显高于PCV2攻毒组。 图2 间接ELISA检测PCV2人工感染猪抗体 图1 阻断ELISA检测PCV2人工感染猪抗体 由图3和图4可见,用阻断ELISA试剂盒和间接ELISA试剂盒检测结果一致,发病猪抗体阳性率为99%,亚临床感染猪抗体阳性率为95%,PMWS猪群发病猪PCV2抗体高于亚临床感染猪。 图3 阻断ELISA检测PMWS猪群中亚临床感染猪与发病猪PCV2抗体 图4 间接ELISA检测PMWS猪群中亚临床感染猪与发病猪PCV2抗体 目前,用于检测PCV2抗体的方法主要是间接免疫荧光法(IFA)和ELISA法。ELISA法主要包括阻断ELISA和间接ELISA。Walker等[4]以PCV2的细胞培养物为包被抗原,PCV2特异性单克隆抗体作为竞争试剂,首次建立了用于检测PCV2抗体的阻断ELISA方法,使用该方法与IFA对猪群的484份血清以及PCV2人工感染猪血清连续抗体检测结果证明,阻断ELISA的敏感性和特异性都比较高,与IFA仅存在微小差异,但ELISA操作较IFA简单,更适合于在大规模场开展监测。控制PCV2感染的最常用和最有效的策略是接种疫苗,通过疫苗接种引发的抗体主要针对PCV2 Cap蛋白,它是病毒的唯一且高度免疫原性的结构蛋白[5]。间接ELISA由于血清样品的成分复杂(例如类风湿因子),易和其他动物血清成分的特异性抗体作用而导致假阳性率较高。与间接ELISA相比,应用重组Cap蛋白单克隆抗体作为竞争试剂的阻断ELISA具有明显的优势,能有效反映猪群感染状况或疫苗效力[5]。由此分析,本研究使用的阻断ELISA抗体检测法可能具有更广泛的应用前景。 两种试剂盒对PCV2攻毒后佐剂KHL刺激组试验猪抗体消长规律的检测结果均显示,PCV2攻毒后,佐剂KHL刺激组试验猪产生的抗体水平明显高于PCV2攻毒组。KHL是一种具有高度免疫原性的大分子蛋白,已证实KHL能增强PCV2在猪体内的复制、加重感染猪PMWS的临床体征[6-7]。由此分析,PCV2攻毒后使用KHL刺激试验猪,可提高PCV2在猪体内的复制,从而提高了抗体产生量。 PCV2单独感染一般只能引起试验猪轻度至中度病变,不易复制出PMWS的明显病症[8-9],往往需要其他致病因子的共同参与才能促使PMWS发生[8,10]。但PCV2感染量的多少是决定着PMWS发生的主要原因,PMWS发生往往需要一定水平PCV2的感染量[11-12]。本次检测的PMWS发病猪场,发病猪阳性率为99%,亚临床感染猪阳性率为95%,表明在PMWS发病猪场中,感染发病猪和亚临床症状猪均感染了PCV2。PMWS猪群发病猪PCV2抗体高于亚临床感染猪,推测感染发病猪的PCV2量高于亚临床感染猪。个别亚临床感染猪PCV2抗体较高但未发生PMWS,可能取决于其他致病因子参与和个体仔猪的免疫力状况。由此分析,通过ELISA对猪群PCV2抗体监测,不仅能有效反映猪群PCV2感染状况或疫苗效力,也能通过PCV2抗体异常增高结合发病猪的临床表现反映PMWS发生状况。 综上,本次使用的阻断ELISA抗体检测试剂盒(试制)和间接ELISA抗体试剂盒不仅能有效反映猪群PCV2感染状况或疫苗效力,也能通过PCV2抗体异常增高并结合发病猪的临床表现及时发现PMWS的发生。阻断ELISA抗体检测法较间接ELISA法可能具有更广泛的应用前景。2 结果
2.1 PCV2人工感染猪血清抗体水平
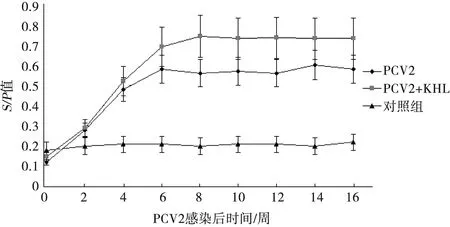
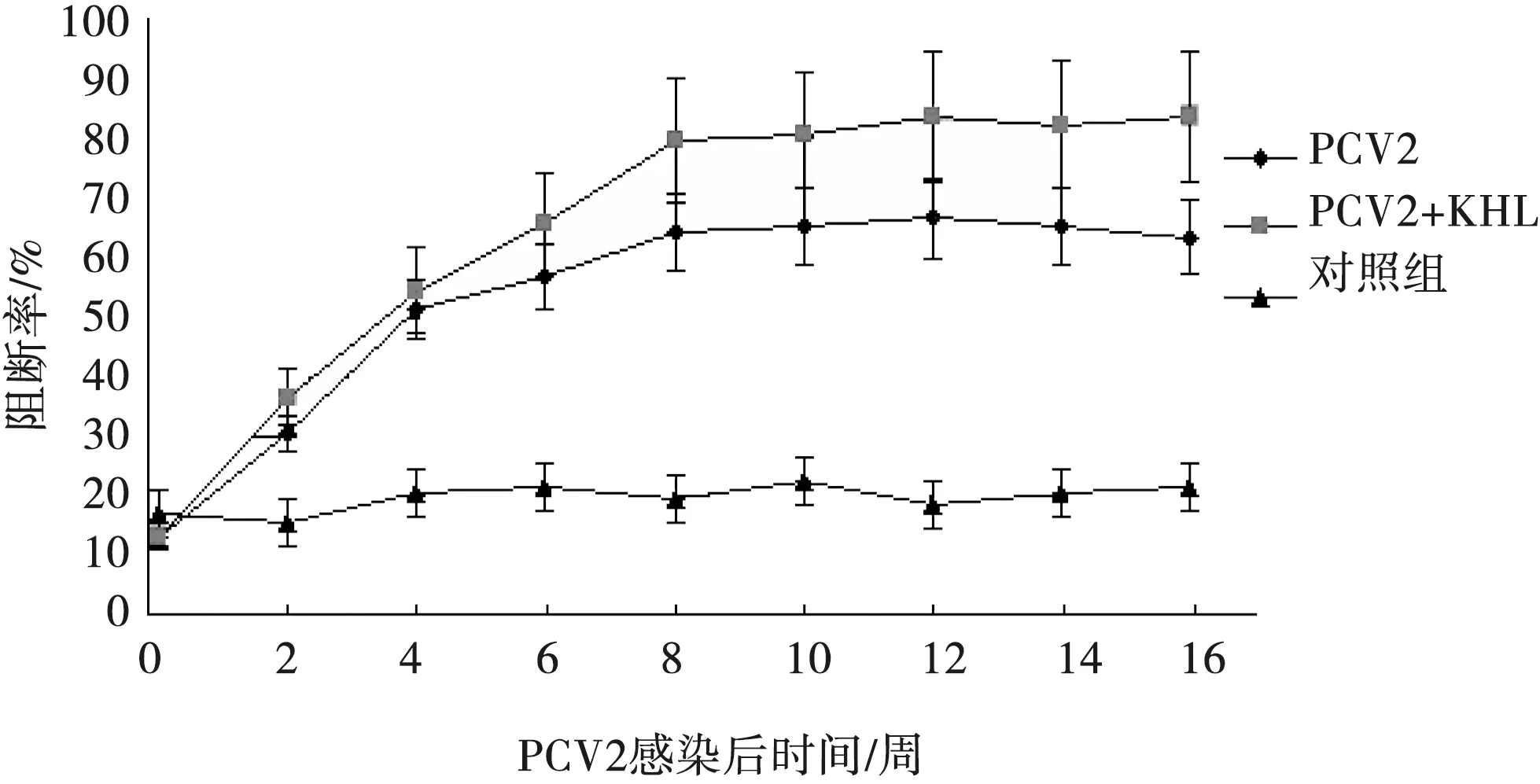
2.2 PMWS猪群中亚临床感染猪和发病猪血清抗体水平
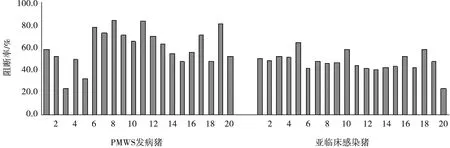

3 讨论

