长春花CratpA基因沉默对两种生物碱合成的影响
李 娅, 周 海 龙, 李 琳, 陈 秋 骏, 吴 琼, 刘 志 文
( 1.大连工业大学 生物工程学院, 辽宁 大连 116034;2.中国生物发酵产业协会,北京 100833 )
0 引 言
长春花(Cathranthusroseus)是研究较为广泛的药用植物之一,它能够合成150多种萜类吲哚生物碱,其中包括有效的抗肿瘤成分文多灵和长春质碱[1]。由于文多灵和长春质碱天然产物的含量极低,化学合成或半合成的方法制备程序复杂难控制和成本太高[2]。因此如何提高它们在长春花中的含量一直备受广大科研工作者们关注[3-4]。
长春花的生长受环境影响大,其中光不仅影响叶绿素积累和叶片光合作用,还通过调节生物碱合成路径上相关基因的表达进而影响其生物碱合成与积累[5]。光合作用中,光反应通过叶绿体中ATP合酶(F1F0-ATPase)合成的ATP,为长春花的次生代谢等生理活动过程供给能量。其中CF1的α亚基是ADP结合位点并由叶绿体基因atpA编码,主要功能是参与CF1合成和水解ATP功能的调节[6-8]。
病毒诱导的基因沉默(VIGS)相比于传统的基因操作技术,具有快速、高效、操作简单以及应用范围广泛等优点,已成功在拟南芥、烟草、长春花和喜树等植物中实现了目的基因的沉默表达[9-11]。目前的应用多基于烟草脆裂病毒(TRV)载体[12]。
本研究利用pTRV-VIGS技术对长春花中叶绿体ATP合酶CF1的α亚基基因(CratpA)进行沉默,分析对文多灵和长春质碱生物合成和几个关键酶基因的转录表达水平的影响,以期为在生产上提高长春花中文多灵和长春质碱的含量提供一定的理论依据。
1 材料与方法
1.1 材 料
长春花种子为本实验室收藏和保存,在育苗盘里进行种子萌发和生长4周后,挑选生长一致小苗移栽至6×10孔的生长盘中。在6周后选择生长一致和良好的小苗进行VIGS侵染。所有长春花材料均在(25±2) ℃、14 h/10 h光/暗以及光照强度2 500 lx条件下进行温室培养。
pGM-T Vector、TRNzol Reagent、RNase-free DNase、TIANScript M-MLV反转录酶、Taq DNA Polymerase及DNA回收试剂盒,天根生化科技有限公司;限制性内切酶、高保真酶Prime-STAR HS DNA Polymerase和T4 DNA连接酶等生物试剂,宝生物工程(大连)有限公司;LightCycler480 SYBR GreenⅠMaster试剂,罗氏诊断产品(上海)有限公司;文多灵和长春质碱标准品,阿拉丁生物试剂公司;农杆菌GV3101,VIGS病毒载体pTRV1、pTRV2,pTRV2-CrPDS(八氢番茄红素脱氢酶基因)和大肠杆菌XL-10 Gold(E.coli)均为本实验室保藏。
1.2 目的片段的引物设计和克隆
在NCBI获得长春花叶绿体全序列(KC561139.1)中ATPase CF1的α亚基基因(CratpA)和蛋白序列(AGI51129.1),该编码序列(CDS)全长1 518 bp,编码505个氨基酸。使用Primer premier 5设计VIGS片段扩增引物(sCratpA-F和sCratpA-R)以及q-RT-PCR引物(CratpA-F和CratpA-R)(表1),由北京六合华大基因科技股份有限公司合成。

表1 所用引物序列
选取野生型的长春花叶片与2粒经过DEPC水处理的氧化锆珠子,放入2 mL离心管后经高通量组织研磨仪进行组织破碎,并经TRNzol法提取总RNA,再经DNaseⅠ处理后反转录合成cDNA 备用。用高保真酶Prime-STAR HS DNA Polymerase和特异性VIGS引物扩增目的片段,经胶回收、纯化和加A后连接至pGM-T载体上,连接产物转化大肠杆菌感受态细胞,经蓝白斑筛选及菌落PCR鉴定,选择阳性克隆扩大培养,提取质粒,酶切鉴定并送样测序,获得正确的pGM-T-sCratpA载体。
1.3 VIGS载体的构建
将pGM-T-sCratpA和pTRV2质粒分别用EcoRⅠ/XbaⅠ和EcoRⅠ/SpeⅠ(XbaⅠ和SpeⅠ酶切的黏性末端相同)在37 ℃下进行双酶切3 h。将目的酶切片段分别进行回收,4 ℃冰箱连接过夜,热激法转化大肠杆菌XL-10 Gold,并在37 ℃培养过夜,进行菌落PCR和酶切验证,获得正确的pTRV2-sCratpA,提取质粒。
1.4 pTRV2-sCratpA质粒的农杆菌转化与鉴定
将活化好的农杆菌GV3101在冰上预冷后收集菌体,在菌体中加入1 mL预冷的20 mmol/L CaCl2及50 μL DMSO轻轻混匀,重悬菌体。冰上分装后,分别加入2 μL质粒pTRV1、pTRV2(EV)、pTRV2-CrPDS(表型对照)和pTRV2-sCratpA并混匀,在液氮中冷冻5 min后,置于37 ℃ 培养箱内5 min。加入LB培养基1 mL,180 r/min、30 ℃培养2 h。离心、收集菌体混匀后涂到含抗生素(Kan、Gen和Rif)的LB平板上,28 ℃倒置培养过夜,经菌落PCR鉴定阳性克隆,挑取转化成功的单菌落加入500 mL含有抗生素的LB液体培养基中进行扩大培养,分装并保藏于-80 ℃冰箱备用。
1.5 农杆菌介导的瞬时转化
将成功转化质粒的根瘤农杆菌GV3101在4种菌液分别进行活化。当OD600=0.8左右时,取200 μL菌体放大到50 mL LB液体培养基进行扩大培养,并加入10 mmol/L MES和20 mmol/L 乙酰丁香酮,在28 ℃和180 r/min条件下培养过夜。当OD600=0.8时,4 000 r/min离心5 min 收集菌体,与渗透液(MES 20 mmol/L,MgCl210 mmol/L,乙酰丁香酮 200 μmol/L,pH 5.6)混合共培养3 h。
将含有pTRV1的菌液分别与含有pTRV2、pTRV2-CrPDS、pTRV2-sCratpA的菌液等体积混合均匀,用注射器刺破长春花幼苗顶端分生组织,注入菌液。经过混合侵染4周后,pTRV2-CrPDS表型对照组会在侵染处长出3~4对白色叶片,以此为依据收取pTRV2(EV)和pTRV2-sCratpA植株同样位置的叶片,仅收集侵染部位上方新长出叶片中由上至下的第2对和3对叶片进行下一步分析,为了避免长春花不同生长阶段而导致的基因表达量以及代谢产物的差异,选择每对叶片中的左叶片进行基因相对表达量的分析,而右叶片进行次级代谢物长春质碱和文多灵的分析。
1.6 长春花合成途径关键酶基因q-RT-PCR分析
为了分析CratpA的VIGS是否影响长春花中文多灵和长春质碱合成途径上关键酶基因的表达,将收集的左叶片利用TRNzol法提取总RNA,反转录得到cDNA,并以此为模板进行q-RT-PCR 分析。选取关键酶基因有TDC、STR、D4H、Cr7DLS、LMAT、DL7H、G10H以及内参基因为CrACT3,根据已知长春花的基因序列设计特异引物,引物信息见表1。
实时定量PCR仪为罗氏Roche480Ⅱ,使用TransStart Top Green qPCR SuperMix荧光染料,目的基因和内参基因得到Ct值,利用公式2-△△Ct计算,并通过Image J软件进行定量分析。
1.7 文多灵和长春质碱含量的检测
选取CratpA基因沉默成功的右侧叶片,置于2 mL离心管内,并计算质量,加入2粒氧化锆珠子并经高通量组织研磨仪进行组织破碎,通过甲醇浸泡与超声处理,离心收集上清,重复萃取3次,合并上清液并离心干燥至干粉,加入300 μL甲醇溶解,经0.22 μm滤膜过滤并收集,经HPLC检测文多灵及长春质碱的含量。
HPLC使用C18反向色谱柱,流动相为甲醇和50 μmol/L磷酸盐,磷酸盐经0.22 μm滤膜过滤并超声,按甲醇体积分数梯度洗脱:20%~80%,0~20 min;80%,20~30 min;80%~20%,30~40 min;20%,40~45 min。检测波长 310 nm(文多灵)与280 nm(长春质碱),体积流量1 mL/min,进样量10 μL,柱温30 ℃。
分别配制2、4、10和20 μg/mL的文多灵和长春质碱标准品,绘制标准曲线,根据标准曲线以及样品的峰面积计算文多灵和长春质碱含量。
2 结果与分析
2.1 sCratpA特异片段的克隆
利用特异性引物扩增得到430 bp左右特异性条带,与预期片段长度相符,将其克隆到pGM-T克隆载体上并测序,测序结果表明该片段大小为431 bp,与NCBI数据库中序列(KC561139.1)中ATPase CF1的α亚基基因序列进行BLAST比对,结果如图1所示。两者序列完全一致,表明成功克隆得到目的片段sCratpA。再将sCratpA载体亚克隆到pTRV2载体中,成功获得沉默表达载体pTRV2-sCratpA。

图1 序列比对结果
2.2 植株的形态变化
如图2所示,经pTRV2-sCratpA侵染处理后的长春花植株与同期生长的野生型和空白对照处理植株相比,在株高、单株重和叶片数目等重要的表型性状上无明显变化(图2(a)~(d)),未受影响。但处理后的叶片在生长过程叶色变浅失绿(图2(e)~(f))。
2.3 基因沉默对CratpA表达的影响
利用q-RT-PCR分析基因沉默处理叶片中CratpA基因的转录水平,较pTRV2空载体(EV)降低,仅为对照组的27.4%(P<0.01),表明成功实现了在长春花叶片中CratpA基因的VIGS表达,可进行下一步分析。
2.4 基因沉默对关键酶基因表达量的影响
各个基因的相对表达量如图3所示,CrD4H、Cr7DLS、CrLAMT和CrDL7H相对表达量分别升高13.85倍、4.42倍、18.91和4.31倍。

图2 不同植株被侵染后的表型
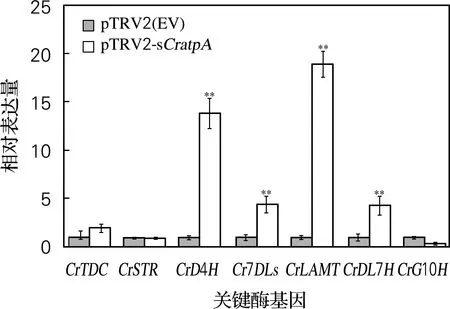
误差线表示3个生物学重复的标准误差,“**”表示差异极显著(P<0.01)
说明沉默CratpA反而增加了合成途径中部分相关酶基因的表达量。
2.5 文多灵与长春质碱的HPLC分析
文多灵与长春质碱的标准品的HPLC分析确定如图4(a)所示,文多灵的出峰时间为25.3 min左右,而长春质碱的出峰时间为27.5 min 左右。野生型植株(图4(b))、EV(pTRV2、图4(c))及pTRV2-sCratpA(图4(d))处理的文多灵和长春质碱的出峰时间均与标品相近。
同空载体对照相比,基因沉默处理后的长春花植株的长春质碱与文多灵含量都有显著提高,其中文多灵增高了1.05倍(图4(e)),而长春质碱则提高了5.83倍(图4(f))。结果表明CratpA的基因沉默对长春质碱与文多灵的合成和积累有较大的影响,且呈负相关,即CratpA表达受阻时,长春质碱与文多灵积累量升高,且对长春质碱的积累更有效。
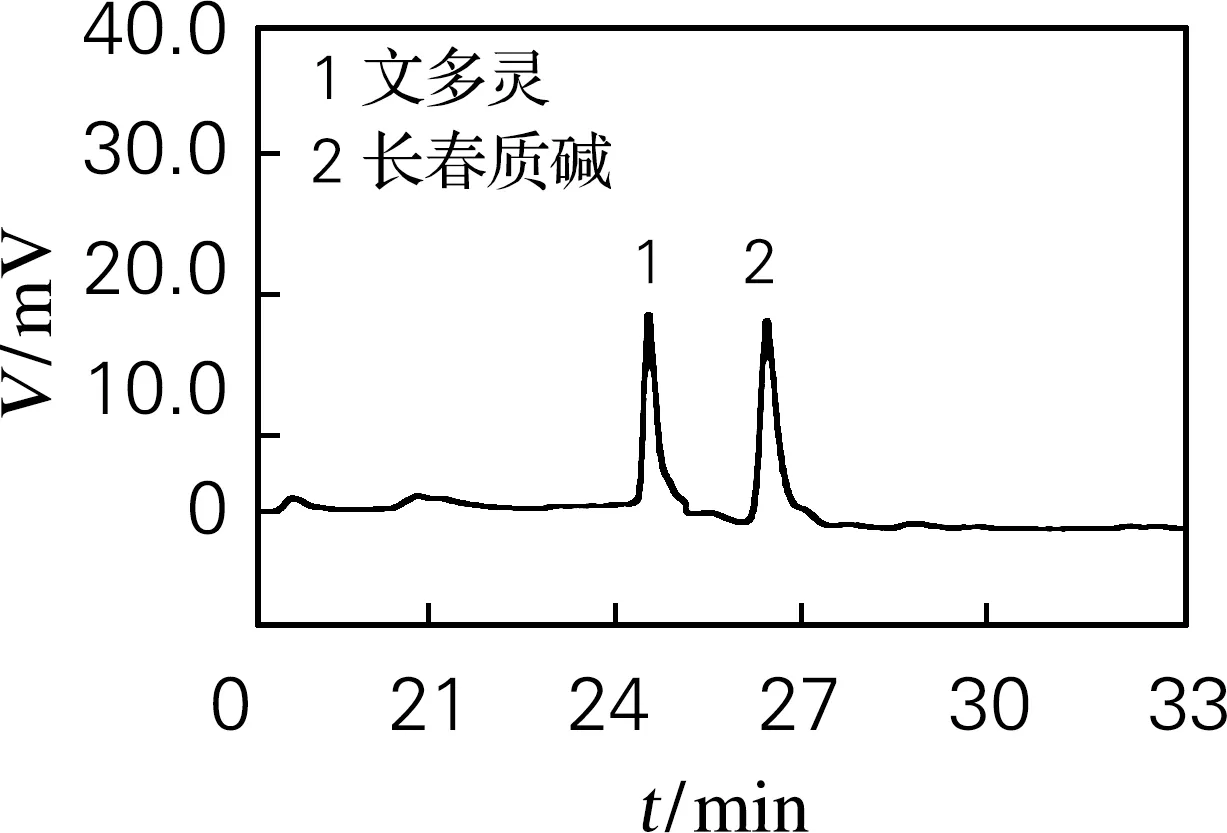
(a) 标准品
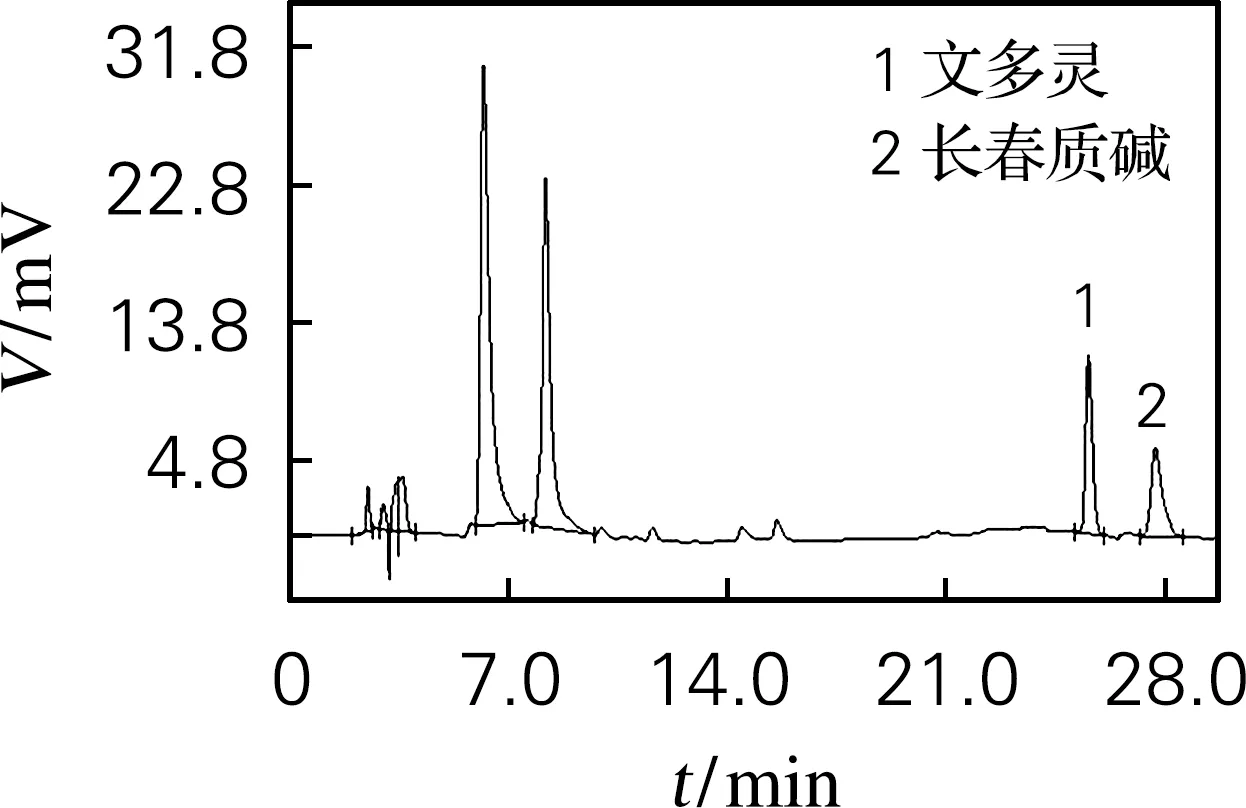
(b) 野生型
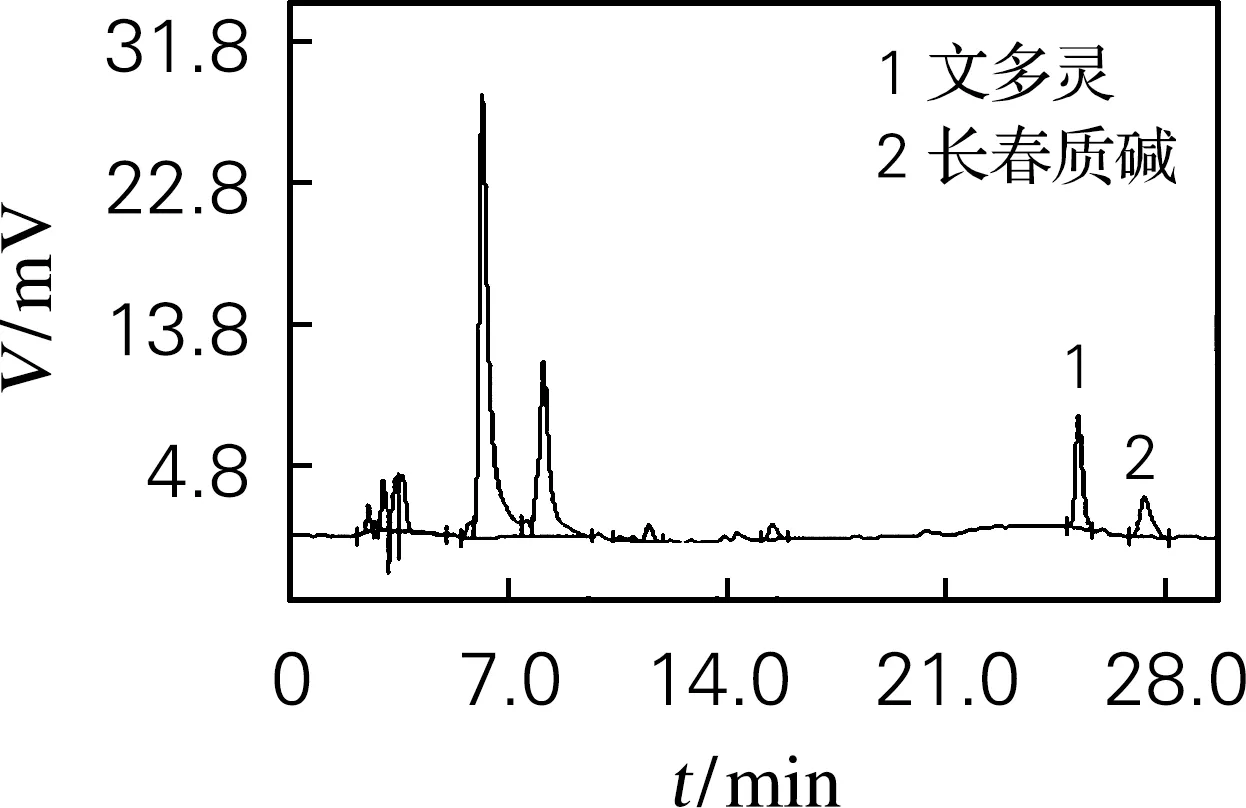
(c) pTRV2

(d) pTRV2-sCraptA
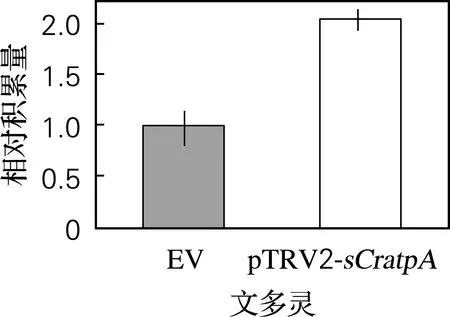
(e) 文多灵相对积累量
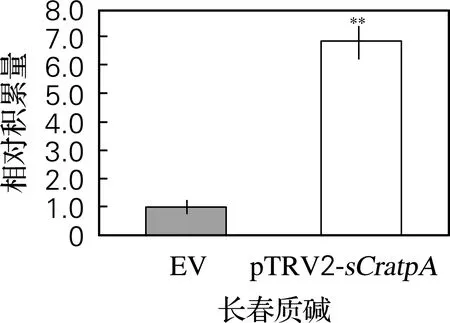
(f) 长春质碱相对积累量
3 结 论
本研究表明,长春花叶片中ATP合酶CF1的α亚基基因的沉默,引起叶片叶色变浅,叶绿素合成受阻,但长春质碱和文多灵合成途径中的一些关键酶基因(CrD4H、Cr7DLS、CrLAMT和CrDL7H)的相对表达反而上升,并促进了文多灵和长春质碱的合成和积累,分别升高了1.05和5.83倍。
有大量的研究表明,长春花在弱光、遮光和低光强等环境下,叶片中叶绿素含量降低且叶绿素a与b比率低,促进了长春碱VBL等合成路径相关基因(TDC、STR、DAT和D4H)的表达,最终有利于长春花体内的次生代谢产物文多灵和长春质碱的合成和积累量提升[13-15]。
ATP合酶是光合作用中一个十分重要的含有多个亚基的复合体,任何一个亚基基因的改变都会影响光合作用顺利进行。本研究中CratpA的沉默后长春质碱和文多灵合成反而上升,其原因可能是CratpA基因的表达量下降,导致CF1的α亚基合成减少,ATP合酶的功能减弱,影响到光合作用过程中光合电子传递和光合磷酸化[16]。从另一个角度上也验证了长春花生物碱的合成与光合磷酸化呈负相关的关系[17-19]。

