徐州地区猪源大肠杆菌血清型调查和耐药检测
昌莉丽,裴淑丽,李华坤,孙朋,王海军,王玉燕
(1. 徐州生物工程职业技术学院,江苏 徐州 221006;2. 河南农业职业学院,河南 中牟 451450)
作为猪肉消费大国,养猪业在我国发展迅速,规模化猪场逐渐增多,同时也对猪场饲养管理和疾病防控提出更高要求。大肠杆菌作为繁殖和定居在肠道内致病菌,很容易随粪便排出体外污染环境。一旦环境改变,猪场饲养管理不当,仔猪抵抗力下降就会引起仔猪腹泻,造成大肠杆菌病在猪场流行。目前,对该病的防治临床多采取疫苗预防和药物治疗,但在防治上还存在问题。一方面大肠杆菌血清型种类众多,难以确定抗原的血清型,造成疫苗免疫的针对性差和有效保护不足;另一方面多重耐药菌株的产生又使药物疗效大打折扣导致临床不能有效防治。为了掌握本地区猪场大肠杆菌血清型分布和耐药情况,2015年6月至2019年8月,对徐州周边17个中小规模养猪场和屠宰场进行病料采集和大肠杆菌分离鉴定,并进行药敏试验和血清型鉴定,为本地猪场大肠杆菌病防治提供理论依据。
1 材料与方法
1.1 病料和样本采集
采集病料和样本共117份。分别来自铜山、邳州、萧县等17个猪场或屠宰场。2015年至2017年,主要采集具有临床症状的病仔猪十二指肠和直肠粪便,2018年和2019年采集病猪直肠肛门处粪便,以及饲料和饮水样本。
1.2 主要试剂
营养肉汤培养基、LB肉汤培养基、麦康凯琼脂培养基(即用型)、M-H琼脂培养基(即用型)、营养琼脂培养基(即用型)均由杭州微生物试剂有限公司生产。大肠杆菌O抗原定型血清型购于天津生物芯片技术有限责任公司。药敏纸片由BIO-KONT 温州市康泰生物科技有限公司生产,药敏质控菌株大肠杆菌ATCC25922株,来自于河南牧业经济学院友情馈赠,本实验室保存。细菌基因组DNA提取试剂盒、2倍HStaq master mix、DL2000 Marker、DL5000 Marker、引物设计合成均由江苏溥博生物科技有限公司合成。
1.3 实验动物
昆明种小鼠240只,体重18~23 g,徐州医科大学动物实验中心提供。
1.4 临床菌株分离和初步鉴定
无菌分离病仔猪十二指肠肠道内容物或直肠肛门粪便接种于LB肉汤培养基增菌培养,置37 ℃恒温培养箱培养16~18 h,划线接种于麦康凯琼脂培养基(即用型),37 ℃培养18 h,挑取粉红色疑似菌落接种于营养肉汤培养基培养18 h,再次划线接种于尹红美兰培养基(即用型)37 ℃培养18 h,挑取黑色疑似菌落,分别接种于营养肉汤培养基和营养琼脂培养基(即用型)37 ℃培养18 h 后,置于4 ℃冰箱保存待用。菌液经鉴定后作为临床分离株制备甘油菌,-20 ℃保存备用。挑取营养琼脂平板单菌落涂布于载玻片,经革兰氏染色后,光学显微镜下镜检进行形态学观察。
1.5 病原菌特异性PCR鉴定
取1 mL LB肉汤过夜震荡培养的新鲜菌液,参照细菌基因组提取试剂盒的说明书方法,提取细菌基因组DNA,作为分离菌株PCR鉴定的DNA模板。参照文献[1]设计引物,Ecoli-F:CGATTCTGAAAT-GGCAAAAG,Ecoli-R:CGTGATCAGCGGTGACTAT-GAC,由江苏溥博公司科技有限公司合成。PCR反应条件为94 ℃热变性5 min,94 ℃解链30 s,52~60 ℃退火30 s,72 ℃延伸60 s,共进行35个循环。PCR扩增产物用1.2%琼脂糖凝胶电泳进行检测,预期扩增片段长度为750 bp。
1.6 病原菌O抗原血清型鉴定
将鉴定后的菌株接种于营养琼脂斜面培养基37 ℃过夜培养,用0.5%石碳酸生理盐水2 mL冲洗细菌菌落,收集密封在5 mL玻璃瓶内并用生理盐水稀释至1×1010CFU/mL,121 ℃高压灭菌2 h,作为待检抗原备用。移液枪吸取O抗原单因子血清1滴到玻片上,再取1滴待检抗原加入血清,立即混匀,静置5 min后观察结果,如果出现凝集则为阳性。以待测抗原和生理盐水混合液作为空白对照,排除细菌自凝现象。
1.7 毒力试验
毒力试验参照文献[2]。选取体重均匀,20 g左右健康小鼠,随机分为80组,每组3只,从中分出1个对照组和2个试验组。取待检菌株,接种于营养肉汤培养基,过夜培养18 h后,取菌液稀释至1010CFU/mL作为待检菌液,试验组小鼠腹腔接种待检菌液0.3 mL/只,对照组腹腔接种同剂量灭菌肉汤,隔离饲养,观察小鼠发病和致死情况,统计发病率和死亡率。以每组3只小鼠全部死亡判定为强毒力毒株,2只小鼠死亡判定为中等毒力毒株,1只小鼠死亡判定为低毒力毒株。无小鼠死亡判定为无毒力毒株。同时剖检死亡小鼠,观察病变并取病料接种麦康凯琼脂培养基分离培养,染色镜检,鉴定大肠杆菌。
1.8 药敏试验
采用K-B纸片法[3],对临床分离的有致病性大肠杆菌进行耐药性测定。结果判断按照CLSI推荐的标准,以标准菌株大肠杆菌ATCC25922株为参照物,根据抑菌圈直径(D)判断结果。D>16 mm为敏感,D<10 mm为耐药, 16 mm>D>10 mm为中介。
2 结果与分析
2.1 临床菌株分离和初步鉴定
经过初步分离培养和初步鉴定,117份样本分离到大肠杆菌102株(表1),所分离的大肠杆菌在麦康凯琼脂培养基上长出紫红色圆形菌落;在伊红美蓝培养基上长出黑色金属光泽菌落;在营养琼脂培养基上长出灰白色半透明光滑的圆形菌落;营养肉汤培养基培养试管底部有白色沉淀,管口有菌环,菌液混浊。病原菌染色后镜检(图1),可发现两端钝圆,散在分布红色短杆菌,说明分离菌株为革兰阴性无芽孢杆菌。
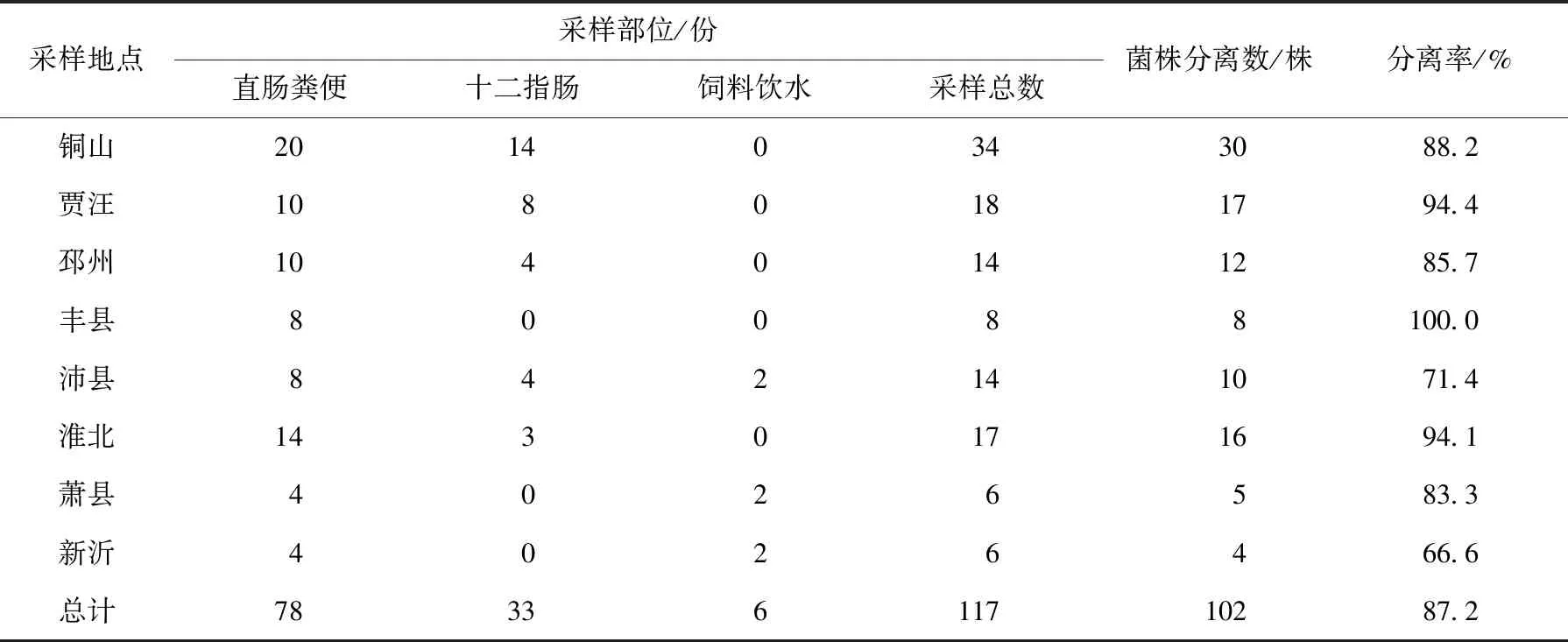
表1 样品来源及大肠杆菌分离率
2.2 病原菌特异性PCR鉴定
将所分离镜检后的临床菌株进行特异性PCR鉴定,均能扩增到750 bp的目的条带(图2)。

1.大肠杆菌ATCC25922株; 2~9.临床分离菌株;M.DNA分子量标准 (DL2000)图2 临床分离菌株PCR鉴定
2.3 病原菌O抗原血清型鉴定
在分离的102株临床大肠杆菌中,除21株未能鉴定出血清型、2株自凝外,余下79株均能发生凝集,可鉴定为O抗原,占检测菌株的77.4%,分属18 个血清型。其中O15、045、O78、O138 4种血清型分别占已定型血清的17.7%,11.4%,13.9%,12.6%,合计占已定型菌株的55.6%。由此说明,O15、O45、O78、O138为徐州周边地区的优势血清型(见表2)。
2.4 毒力试验
小鼠经攻毒后12 h相继表现精神食欲不振,呼吸加快,拉稀、死亡,剖检可见肝脾肿大、出血,涂片染色镜检可见两端钝圆、单个或散在的的革兰阴性杆菌,划线接种麦康凯培养基可见粉红色圆形菌落。80组小鼠,对照组和2个试验组全部存活,余下77组均为致病菌株。其中25株菌接种后小鼠全部死亡,占31.6%,主要分布在O15(5株)、O25(1株)、O78(3株)、O44(2株)、O138(5株)、O126(1株)、O45(6株)、O141(2株)血清型,说明这些菌株具有很强的致病力。中等毒株 38株,占48.1%;弱菌株14株,占17.7%,说明这些临床分离菌株具有不同程度的致病性,一旦条件具备就会引发疾病。
2.5 耐药试验结果及多重耐药率分析
采用K-B纸片法,量取不同药物药敏片抑菌圈直径并进行统计分析。结果显示(表3),2015至2019年间临床分离保存有致病性的77株大肠杆菌,对20种药物均有不同程度的耐药性,其中耐药率在50%以上的药物多达17种,占到了临床常用药物的85%;其中阿莫西林、氨苄西林钠、强力霉素、氟苯尼考、恩诺沙星、乳酸环丙沙星临床耐药尤其严重,高达80%以上;耐药率比较低在50%以下的药物仅有头孢曲松、头孢噻呋、氨曲南3种药物。此外,所分离的77株致病性菌株均表现出了多重耐药性,至少耐药12种以上,其中12耐和13耐菌株所占比例最大,分别为25.9%和22.1%,耐药谱型多达8种,常见耐药谱为氨苄西林钠-阿莫西林-强力霉素-氟苯尼考-阿奇霉素-盐酸林可霉素-庆大霉素-新霉素-痢菌净-复方新诺明-恩诺沙星-乳酸环丙沙星。

表3 2015年至2019年临床分离菌株对20种药物的耐药率分析
3 讨论
通过对徐州周边猪场大肠杆菌进行分离鉴定、血清型调查和耐药检测,发现徐州地区猪源大肠杆菌分离率高,血清型复杂,耐药率高且具有多重耐药性。在采集的117份样本中,分离到102株大肠杆菌,检出率高达87.2%,提示该病原在本地各猪场广泛存在。对大肠杆菌的分离鉴定,本研究放弃传统的生化鉴定,在选择性培养基初筛、细菌形态观察的基础上,直接进行大肠杆菌特异性PCR鉴定,快速准确。PCR法可进行大批量样本检测,适用于临床疾病的流行病学调查;经血清型和致病性检测,检出O抗原血清型大肠杆菌79株,分属18 个血清型,检出率77.4%,致病毒株达到97.4%,提示血清型众多的O抗原菌株仍为临床常见流行菌株,并且不同血清型菌株之间存在不同程度的毒力差异。已定型菌株中O15、O45、O78、O138为优势血清型占55.6%,其中O45、O15、O138 3种血清型致病力较强,占强毒株的64.0%,充分说明O抗原血清种类和致病性有一定联系,这和文献报道的结论一致[5-6]。 结合近年报道的相关血清型监测结果,发现除O138血清型检出率略高外,各地区检测优势血清型均有不同[5-7]。提示在徐州地区可针对性地选择与O15、O45、O78和O138 4种血清型相吻合疫苗预防接种,以提高猪免疫效果;耐药检测结果发现,临床菌株不仅耐药严重还表现出多重耐药性,这和很多文献对猪源大肠杆菌耐药性的报道一致[6-8]。说明菌株耐药性增加是成为各大集约化猪场共同面临的重要问题。本研究临床菌株耐药达12种以上,对阿莫西林、氨苄西林钠、强力霉素、氟苯尼考、恩诺沙星、乳酸环丙沙星等临床常用药耐药率高达80%以上,说明这些药物在徐州地区临床应用泛滥,已不适合进一步作为猪大肠杆菌病防治用药,猪场应引起重视并考虑选用相对敏感的头孢曲松、头孢噻呋、氨曲南、多黏菌素、卡那霉素等药物。目前,猪场常用治疗药物,受成本、适口性、药残等因素限制,临床可供选择的药物已经有限,但日趋严重的耐药性又进一步导致临床几乎无药可用。因此,克服耐药性,开发新兽药,寻找新的抗生素替代品,改进用药方式,都将是未来解决这一难题的重要途径。
多年来,仔猪大肠杆菌病一直是困扰养猪业的一个难题,虽然临床采取多种防治措施减少大肠杆菌病的发病率和死亡率,但至今未能完全杜绝。该病之所以难治,与菌株众多血清型和日趋严重的耐药性密切相关[10-11],因此,菌株血清型和耐药性的定期检测对指导本地猪场大肠杆菌病的防治至关重要。

