规模化种猪场猪瘟血清抗体水平变化规律的分析
马祥,戴镜红,何雄江,康桦华
(1. 广东省农业科学院动物卫生研究所,农业农村部兽药与诊断学科群广东科学观测实验站,广东省畜禽疫病防治研究重点实验室,广东 广州 510640;2. 北京爱德士元亨生物科技有限公司,北京 100301;3. 广州市番禺区动物防疫监督所,广东 广州 511400)
猪瘟(Classical swine fever,CSF)是由猪瘟病毒(Classical swine fever virus,CSFV)引起猪的一种高度接触性传染病,被OIE列为通报疫病。因其发病率和死亡率高,流行广泛,引起世界养猪业的极大关注[1]。近年,随着猪瘟病毒在猪场及环境中长期存在,其耐受性变化及重组事件的发生使流行特点逐步由原来的大流行转变为散发性和周期性流行,另一方面病毒临床表现型也出现了如温和型、非典型及无名高热综合征等特点[2-3]。猪瘟的防控工作任务繁重,发病机制、疫苗开发、有效疫苗评价手段仍是猪病专家们研究的重要方向。种猪和后备猪是猪瘟净化中须高度重视的管理对象,规模化种猪场的净化是逐步控制猪瘟并实现猪瘟净化计划的重要途径[4-5];猪群的猪瘟抗体水平维持在一定水平且整齐,是达到净化的关键环节,是对猪群健康与否的关键评估指标[6]。
本研究以两个生产业绩较好的规模化种猪场为对象,通过连续数年的猪瘟抗体监测,并通过评估猪群体免疫合格率、离散度进一步分析总结免疫后抗体变化规律,同时结合猪场生产状况,总结并验证在猪瘟疫苗免疫效果良好状态下,猪瘟抗体阻断率、离散度及抗体值区间等有效指标,形成评价猪瘟疫苗免疫效果的判定标准。据此,通过免疫方案优化及生物安全管理等措施明显降低猪瘟群体发生率。通过案例分析为规模化种猪场提供猪瘟控制方案,同时为猪瘟防控提供一定临床参考。
1 材料与方法
1.1 血样的采集及处理
前腔静脉采血。分别采集不同猪场不同时间猪的血液,每份血样采集3~5 mL,装于离心管中,编号,静置30 min。待血清析出后,干冰冷藏送至实验室,离心分离血清,备用。
1.2 猪场背景
选取2个生产业绩良好的种猪场:A场有2 400头存栏母猪,B场有4 000头存栏母猪,为控制净化场;猪场A、B场的免疫与采样背景见表1。
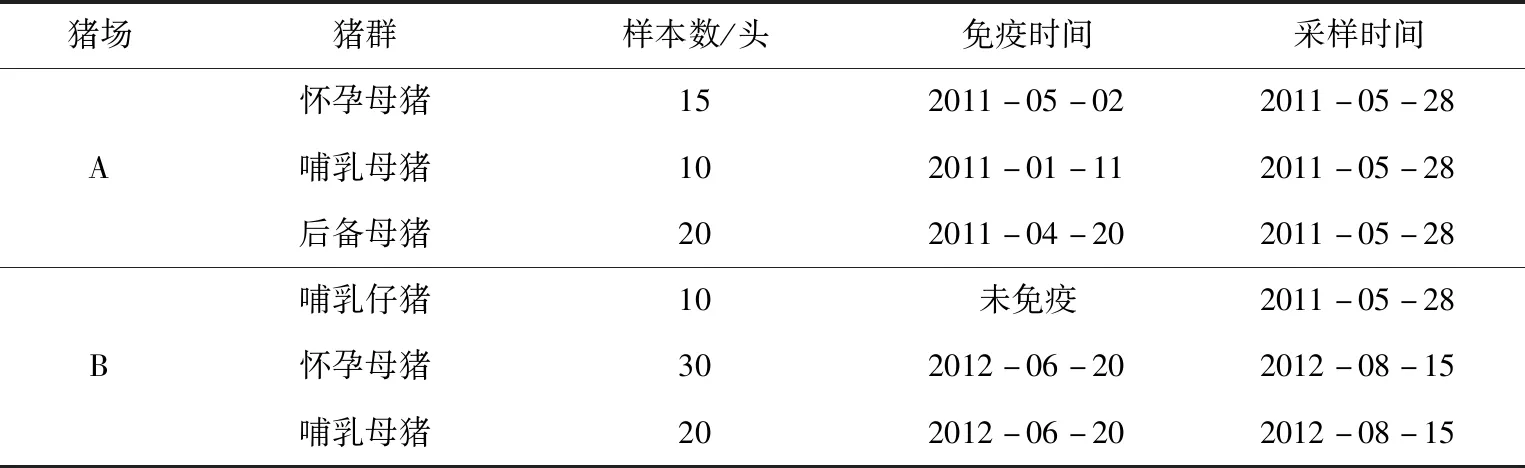
表1 猪场免疫背景评估采样表
1.3 检测试剂盒
HerdChek猪瘟抗体ELISA检测试剂盒的生产厂家为美国爱德士生物科技有限公司(IDEXX Laboratories, Inc.),试剂盒批号:B021, -4 ℃保存。
1.4 试验方法
猪瘟抗体ELISA检测方法参照HerdChek猪瘟抗体ELISA检测试剂盒的说明书操作。
有效性判定标准:设标准阳性孔和标准阴性孔,阴性对照孔平均OD450高于0.50,阳性对照孔阻断率高于50%。
1.5 抗体水平监测分析方法
1.5.1 A猪场抗体水平检测
采用ELISA方法对不同生产阶段猪、选取不同时间段开展猪瘟抗体检测,结合生产指标业绩情况,分析CSFV抗体阻断率、离散度等指标变化情况。具体采集样品的背景如表2。

表2 2014年B猪场监测采样情况表

表2 A猪场CSFV抗体检测样本背景情况表
1.5.2 B猪场抗体水平检测
选取B猪场中一条开展猪瘟控制试验的生产线。该条生产线猪瘟疫苗采取普免策略(3次/年,免疫间隔时间4个月),含种猪500头。控制方案如下:首先用购置的HerdChek猪瘟抗体ELISA检测试剂盒对生产线上所有猪进行猪瘟抗体测定。根据测定结果分类处理,对于阻断率低于40%的猪进行隔离,并常规剂量补充免疫1次,6周后同样的方法测定抗体,对于抗体阳性猪归群处理,阴性猪只采取完全隔离或者淘汰。距上次测定3个月后,同样的方法对整条线种猪群再处理1次。执行控制方案持续2年时间(2013年至2014年)。
2 结果与分析
2.1 A猪场2011年至2012年猪瘟抗体水平监测结果
对A猪场2011年CSF抗体水平进行分析,分析结果如表3所示。A猪场种猪群在免疫3~4周后CSF抗体平均阻断率介于63.61%~71.24%。而哺乳母猪在长达4个月的免疫间隔期下抗体呈阴性,母源抗体的干扰使哺乳仔猪阳性率达50%。

表3 A猪场CSF抗体阳性率、离散度和平均值 %
2012年,种猪群在免疫后6~8周后CSF抗体平均阻断率可达71%,离散度CV值约为27%,结果见表4。
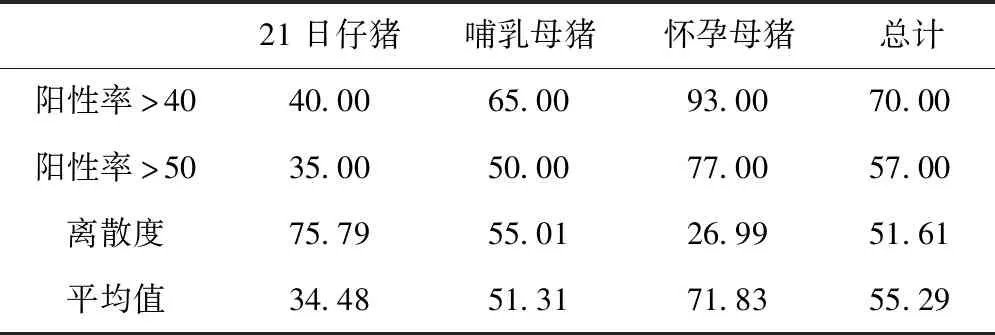
表4 A猪场2012年CSF抗体阳性率、离散度和平均值 %
A猪场2011年至2012年生产业绩数据见表5。该场的配种分娩率均在90%以上,成活率也在91%以上,猪场的种猪群生产业绩良好。结合猪瘟抗体变化规律,该猪群在免疫后平均阻断率普遍高于50%,同时离散度CV值低于40%,证实该场的猪瘟免疫效果良好。
2.2 B猪场2013年至2014年猪瘟抗体监测结果
2.2.1 B猪场2013年猪瘟抗体检测结果
如表6所示,B猪场生产线通过实施CSF控制计划后,不同种猪群的抗体阳性率平均值均高于85%,平均离散度达8.19%,其中B猪场种猪群的CSF抗体阳性率平均值为89.79%,离散度为7.49%。因此,该场种猪群猪瘟疫苗免疫效果在CSF控制策略下表现良好。
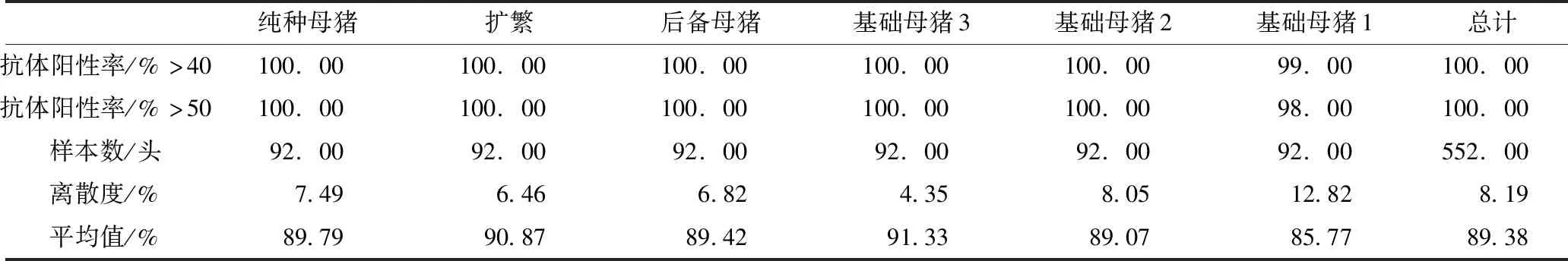
表6 B猪场2013年猪瘟抗体阳性率、离散度和平均值
2.2.2 B猪场CSF控制前后生产性能比较
比较2012年和2013年猪群的生产性能,结果如表7所示。猪瘟控制计划使猪场窝均产活仔数增加了0.8头,增长了8.2%。断奶前仔猪平均死亡率下降2%,母猪每年提供上市的猪增加近3%。综合评估,生产性能提高较大。

表7 B猪场2012和2013年生产性能一览表
2.2.3 B猪场2014年猪瘟抗体检测结果分析
如表8所示,2014年该场群体CSF抗体阳性率平均值为60.86%,离散度平均值为35.67%。其中在普免4周后和8周后母猪群均获得较高的抗体水平(抗体平均值分别为78.4%和73.93%),对应抗体离散度分别为17.32%和21.62%;在普免后4~6周和8~10周生长猪和肥育猪均获得较高的抗体水平(抗体平均值分别为68%和69.88%),对应抗体离散度分别为15.23%和18.47%;哺乳仔猪通过母源抗体获得较好的保护率;各类猪群均呈现较高的抗体水平。猪场在实施猪瘟控制计划1年后,其群体的猪瘟抗体值仍高于70%,同时商品猪在二免后6周高于65%,且种猪群和商品猪群的CSF抗体离散度CV值均低于20%。
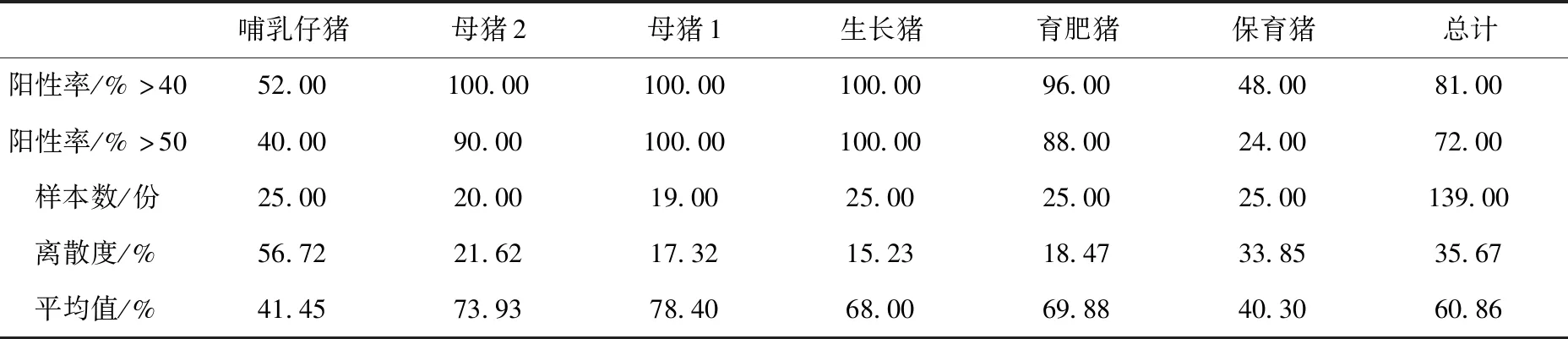
表8 B猪场2014年猪瘟抗体阳性率、离散度、平均值结果
3 讨论
本研究以2个规模化种猪场为对象,4年连续监测猪瘟抗体值及生产业绩数据。通过分析数据发现,在猪群抗体检测结果判定中群体免疫合格率和抗体离散度是重要的衡量指标,猪群免疫效果良好的标准为猪瘟抗体的平均阻断率高于50%,同时离散度CV值低于25%;此外,2个猪场猪瘟病原检测结果均为阴性;通过开展猪繁殖与呼吸道综合征以及猪伪狂犬病的免疫监测,种猪群在4年期间均没有猪繁殖与呼吸道综合征的流行或发病,猪伪狂犬病抗原维持阴性,这从另一个角度说明,猪群猪瘟抗体可以作为猪群健康的参考指标之一,猪群的健康提高了猪对疫病的抵抗力,降低了猪场感染其他疾病的风险。
猪瘟控制净化场B培育健康种群的成功经验提示,种猪和后备猪群的净化是关键因素。分析其数据,可知该场通过控制方案后,猪瘟抗体阳性率虽然在一定范围内波动,但有明显提高,其数值以及抗体离散度都趋于稳定(平均抗体阳性率高于85%,离散度低至4.35%),可见猪瘟控制计划的有效性;进一步推测该场猪瘟综合防控的关键是建立在后备和种猪猪群的净化完成健康种群的培育。其中对规模化猪场中猪瘟进行控制的有效方法是从源头上对种猪群实施净化。具体的净化措施包括如下几方面:首先要坚持对种猪群和后备猪群约半年期的无差别病原筛查,结合猪瘟阻断率的高低判断抗体免疫效果,据此采取不同的措施,包括对低于40%的猪进行隔离。通过加强免疫并配以观察和驯化,再经抗体检测,评估进入种猪群的可能性,最终使猪瘟抗体值处于一定的标准区间,达到猪群稳定的目的。猪场通过3到5个净化流程实现猪瘟病毒带毒率从30%降至低于1%。
相对于血清学抗体效价(尤其是ELISA),猪瘟抗体中和效价更能反映出疫苗对猪的保护能力,但中和抗体检测方法相对繁琐难以推广,所以通过评估二者的相关性以期用猪瘟ELISA方法代替中和抗体检测方法并用于预估疫苗保护力是有效的途径[7]。已有研究对猪瘟抗体ELISA检测试剂盒(IDEXX)进行检测抗体效价和常规中和抗体效价相关性进行评估,相关系数可达0.863,说明在一定程度上可以反映出猪群的猪瘟抗体水平,并用于评估猪群对猪瘟的抵抗力[8]。分析主要原因是E蛋白可诱导机体产生中和抗体,同时可激发猪体对猪瘟病毒产生抵抗性免疫应答,而该试剂盒包被抗原为E蛋白。评估猪群对猪瘟的抵抗力,在中和抗体滴度不低于1∶32时认为抗体合格,对应采用HerdChek猪瘟抗体ELISA检测试剂盒检测猪瘟抗体的抗体阻断率50%。因此,该试剂盒可用于猪群的猪瘟抗体水平检测及猪群对猪瘟的抵抗力评估[9-10]。综上所述,在规模化猪场猪瘟的控制过程中,由于猪瘟抗体值反映了猪体对猪瘟病毒的易感性,所以猪瘟疫苗免疫成败的关键是针对性地监测猪群免疫抗体,并确定科学的免疫适宜期。同时,针对猪瘟野毒感染风险与猪群猪瘟疫苗免疫合格率及抗体离散度的对应关系的问题至今未见深入的研究报道,在未来一段时间,它仍是一个值得探讨的问题。多数专家坚持认为,群体免疫保护率达到85%是防控猪瘟的关键[11]。同时,商品猪猪瘟抗体离散度在25%,而种猪群需低于20%。对于大部分规模化养猪场,由于拥有先进的管理水平和专业的技术人员,以及相对完备的实验室诊断技术平台,有能力对猪场群体的猪瘟抗体水平开展长期或阶段性的监测,据此及时调整其免疫程序,控制猪瘟的群体免疫合格率在90%以上,离散度在20%以内。

