唑来膦酸对乳腺癌术后内分泌治疗患者骨折风险的影响
林红晓 王东岩 金雨
(连云港市第一人民医院骨质疏松科,江苏 连云港 222000)
骨质疏松主要特征是骨量降低、骨组织结构被破坏、骨脆性增高,具有原发性及继发性两大类型〔1,2〕。绝经期女性由于雌激素明显下降,随着年龄增长,其骨量丢失更加严重,尤其是乳腺癌术后患者普遍存在骨量丢失、骨质疏松〔3,4〕。乳腺癌患者化疗治疗、内分泌治疗等都会导致其雌激素水平显著下降,导致骨质流失,增加骨质疏松风险,尤其是芳香化酶抑制剂的使用〔5〕。据报道,体重指数(BMI)、绝经年限、年龄三方面因素是乳腺癌术后患者1年内发生骨质疏松的危险因素〔6〕。唑来膦酸属于第3 代双磷酸盐类药物,具有较强的抗骨吸收能力〔7〕。本研究观察唑来膦酸对乳腺癌术后内分泌治疗患者骨密度(BMD)及骨折风险的影响。
1 资料与方法
1.1一般资料 选取2016年1~12月在连云港市第一人民医院行乳腺癌手术患者50例作为研究对象,采用随机数字表法均等分组,对照组年龄53~70岁,均值(60.85±5.36)岁;体重49~68 kg,均值(54.96±4.95)kg;病理分期:Ⅰ期15 例,Ⅱ期10例;绝经年龄均值(49.85±4.28)岁。观察组年龄53~68 岁,均值(61.96±4.28)岁;体重47~71 kg,均值(55.94±5.02)kg;病理分期:Ⅰ期14 例,Ⅱ期11例;绝经年龄均值(49.52±4.16)岁。两组患者在绝经年龄、病理分期、体重及年龄等基线资料对比无统计学意义(P>0.05)。诊断标准:乳腺癌患者均经手术、病理及影像学证实;骨质疏松参照世界卫生组织(WHO)公布的诊断标准:BMD 低于正常健康者2.5 个标准差。换而言之,T 值≤-2.5。纳入标准:自愿参与本研究,签署知情同意书,通过医院伦理学会审核;术后接受内分泌治疗;绝经后女性;确诊为骨质疏松;病理分期为Ⅰ~Ⅱ期,具有完整的临床资料及随访资料。排除标准:近期使用过影响骨代谢的药物;对本研究涉及的相关药物过敏;复发性乳腺癌;卵巢、子宫等生殖系统疾病;脑卒中、心肌梗死等病史;高血压、糖尿病、骨关节疾病等慢性疾病;恶性肿瘤病情严重发生骨转移;血液系统、内分泌系统等疾病;临床资料缺失,失访等。
1.2方法 对照组及观察组均25例,两组患者均口服来曲唑或阿那曲唑治疗。对照组给予碳酸钙600 mg(钙尔奇)+活性维生素D(罗盖全)。观察组在对照组基础上给予静滴唑来膦酸4 mg(艾朗),每年1次。在征得患者及家属的知情同意后,予以唑来膦酸注射液。一次静脉滴注唑来膦酸4 mg,100 ml水溶液以输液管恒定速度滴注,滴注时间≥15 min,给药后静脉注射0.9%氯化钠注射液250 ml进行水化。
1.3观察指标 随访2年,在内分泌治疗前(基线)、内分泌治疗第1、2年进行BMD检测。(1)观察两组BMD〔8,9〕。对患者腰椎、股骨颈部位BMD采用双能X线吸收BMD测量仪进行测定。(2)收集两组对象的一般资料,同时使用骨折风险因子工具(FRAX)计算骨折风险系数值〔10,11〕。(3)对比治疗前后生活质量。本次研究采用健康状况问卷调查(SF-36)对两组患者治疗前后生活质量进行评估,该量表含有8个维度,分别为总体健康(GH)、精力(VT)、社会职能(SF)、情感职能(RE)、心理健康(MH)、生理功能(PF)、生理职能(RP)、躯体疼痛(BP)。前面2个维度含有体力及精神两方面,最后3个维度主要是体力,其余3个维度主要针对精神方面。各维度计分采用累加法,计算原始分数后,再以标准公式计算转换分数,各维度得分为 0 分(最差)~100 分(最好) 。
1.4统计学方法 采用SPSS22.0软件进行t检验、χ2检验。
2 结 果
2.1观察两组BMD 治疗前,对照组与观察组腰椎及股骨颈两个部位BMD组间对比无明显差异(P>0.05),治疗1年后、治疗2年后对照组两个部位BMD均较治疗前显著下降,治疗2年后显著低于治疗1年后。观察组两个部位BMD均较治疗前显著提高,治疗2年后显著高于治疗1年后,观察组治疗1年后、治疗2年后两个部位BMD均较对照组显著升高(P<0.05),见表1。

表1 两组治疗前后BMD比较
2.2观察两组FRAX骨折风险系数 治疗前,两组骨折风险系数组间对比无明显差异(P>0.05)。治疗1年后、治疗2年后对照组骨折风险系数较治疗前显著提高,治疗2年后显著高于治疗1年后。观察组骨折风险系数较治疗前显著下降,治疗2年后显著低于治疗1年后,观察组治疗1年后、2年后骨折风险系数均较对照组显著降低(P<0.05),见表2。
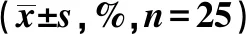
表2 两组治疗前后FRAX骨折风险系数的比较
2.3两组患者生活质量 治疗前,两组生活质量8个维度组间对比无明显差异(P>0.05);观察组治疗2年后生活质量各维度评分均较对照组高,对比具有统计学意义(P<0.05),见表3。

表3 两组治疗前后患者生活质量评分分,n=25)
2.4安全性 治疗期间,两组患者肝肾功能无异常,无不良反应,具有较高的安全性。

续表3 两组治疗前后患者生活质量评分分,n=25)
3 讨 论
近年来乳腺癌的发病率逐年上升,已经成为威胁女性生命健康的恶性肿瘤的首位疾病。为进一步降低乳腺癌患者术后复发率,内分泌治疗已经被广大临床医生采纳,内分泌治疗可以抑制女性体内雄激素向雌激素转化,而绝经后女性雄激素转化为雌激素是女性体内雌激素的主要来源之一,因此可进一步加剧女性患者体内雌激素缺乏状态,导致骨丢失,最终诱发骨质疏松〔12,13〕。如何更好地预防内分泌药物治疗所导致的骨量丢失已经成为近年研究的一个热点。
有研究显示,唑来膦酸与内分泌药物联合应用可以显著治疗内分泌药物引起的骨量丢失〔14,15〕。WHO在2008年推荐采用FRAX来评估骨折风险,该工具主要用于评估具有脆性骨折高危因素患者的骨折风险,目前已被推广于欧美国家,其可在早期对骨折风险予以预测,如骨折风险系数达到一定数值,则需给予患者及时干预和治疗。美国骨质疏松基金会(NOF) 推荐,FRAX将“髋部骨折风险系数≥3%”作为推荐治疗标准。另有研究显示〔16〕,在患者的10年骨折风险系数超过7%时,对所有年龄段的患者进行干预治疗是非常值得的。然而国内尚无大样本研究这个干预阈值。临床何时开始唑来膦酸治疗尚无统一的标准,临床医师无指南可循。本研究通过双能X线骨密度测量仪(DEXA)测量腰椎、股骨颈的BMD观察唑来膦酸对乳腺癌术后应用内分泌治疗患者的BMD的影响,同时应用FRAX评估治疗前后骨折风险系数。本研究结果提示及早应用唑来膦酸可明显提高乳腺癌术后应用内分泌治疗患者的BMD,同时降低骨折风险系数,起到预防骨质疏松骨折的作用。
从现代医学模式来看,疾病治疗不仅是为了单纯延长生存期,而是应以满意终点为出发点,为此反应健康程度和疗效制定不仅需要生物学指标,也应包括生活质量评估。本研究中,观察组治疗2年后生活质量各维度评分均显著高于对照组,原因在于,经过2年的唑来膦酸治疗,患者对乳腺癌术后内分泌治疗、唑来膦酸作用机制等都具有一定了解,同时给予健康教育、心理指导、家庭互动等,使得患者体能、精神影响、社会活动、心理健康、体能影响、精力、身体疼痛和一般健康等方面都得到显著改善。
综上所述,唑来膦酸应用于乳腺癌术后内分泌治疗患者中,能够提高BMD,预防骨丢失,降低骨折风险,提高患者生活质量,具有较高的安全性。

