miR-149靶向调控CARM1基因对直肠癌细胞放疗敏感性
郭令飞 罗德红 葛华 王灿
(遵义市第一人民医院 1胃肠外科,贵州 遵义 563000;2肿瘤科)
放射治疗在肿瘤治疗中的地位越来越重要,而提高肿瘤放射治疗的敏感性为肿瘤放射学的重大难题,近几年用靶向精准治疗或基因治疗增强放疗的敏感性成为该领域的新方向。直肠癌为常见的消化道恶性肿瘤,其发病率、死亡率均有明显上升〔1,2〕。微小RNAs(miRNAs)是由长度19~24个核苷酸序列组成的短链非编码微小RNA〔3〕,通过抑制靶基因的mRNA转录或阻遏蛋白的翻译发挥肿瘤调控作用〔4〕。此外,还可调节癌细胞对化学疗法和放射疗法的敏感性〔5,6〕。共激活相关精氨酸甲基化转移酶(CARM)1属于蛋白精氨酸甲基转移酶家族(PRMTs)成员〔7,8〕,在多种癌症中均表现出促进癌症恶化的作用。但miR-149与CARM1在直肠癌中与放射治疗的关系尚未清楚,本文对比展开了相关研究。
1 材料与方法
1.1材料 人结直肠上皮细胞HCEpiC、直肠癌细胞HT29均购自ATCC;RPMI1640培养基购自Gibco;胎牛血清(FBS)购自上海联硕生物科技有限公司;噻唑蓝(MTT)购自北京索莱宝生物科技有限公司;LipofectamineTM2000购自上海阳光生物科技有限公司;逆转录试剂盒、实时荧光定量聚合酶链反应(qRT-PCR)检测试剂盒均购自北京百奥莱博有限公司;聚偏氟乙烯(PVDF)膜购自德国罗氏诊断有限公司;电化学发光液购自北京普利莱基因技术有限公司;放射免疫沉淀法(RIPA)蛋白裂解液购自杭州昊鑫生物科技有限公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;膜联蛋白(Annexin)V-异硫氰酸荧光素(FITC)/碘化丙啶(PI)凋亡检测试剂盒购自成都艾为特生物科技有限公司。
1.2细胞培养 将结直肠上皮细胞HCEpiC、直肠癌细胞HT29用含10% FBS的RPMI1640培养基在37℃ 5% CO2的恒温培养箱中进行常规培养、传代。
1.3细胞转染与分组 将正常培养的结直肠上皮细胞HCEpiC、直肠癌细胞HT29分别标记为HCEpiC组、HT29组。将miR-con、miR-149模拟物(mimics)、miR-149 mimics+pcDNA、miR-149 mimics+pcDNA-CARM1按照脂质体LipofectamineTM2000试剂说明书的要求操作转染至HT29,转染8 h后,更换为新鲜培养基继续培养48 h,再用qRT-PCR法检测转染效率,确认转染成功后将其分别标记为miR-con组、miR-149组、miR-149+pcDNA组、miR-149+pcDNA-CARM1。NC组为正常培养的HT29细胞,此组细胞未进行转染或其他处理。用Siemens Primus直线加速器6MV高能X线室温照射,剂量率为3 Gy/min,以4 Gy垂直照射10 cm×10 cm范围,距靶源 30 cm,辐照后置于37 ℃ 5% CO2培养箱中培养48 h,标记为IR+miR-con组、IR+miR-149组、IR+miR-149+pcDNA组、IR+miR-149+pcDNA-CARM1组,用于后续试验。
1.4qRT-PCR 收集细胞,用RNA抽提试剂盒、逆转录试剂盒进行RNA的提取和cDNA的合成。最后再用qRT-PCR试剂盒进行miR-149、CARM1表达的检测。以U6、GAPDH为内参,用2-△△Ct计算miR-149、CARM1的相对表达。miR-149上游引物5′-GTTTCTGGCTCCGTGT-3′,下游引物5′-CAGTGCGTGTGGTGGACT-3′;U6上游引物5′-GCTTCGGCAGCACATATACTAAAAT-3′,下游引物5′-CGCTTCACGAATTTGCGTGTCAT3-′;CARM1上游引物5′-CAAATTCCCACATGCTGCATT3-′,下游引物5′-TGGCAATAAGCAGACATGACC-3′;GAPDH上游引物5′-AGCCACATCGCTCAGACAC-3′,下游引物5′-GCCCAATACGACCAAATCC-3′。
1.5Western印迹 收集细胞,用RIPA裂解液在冰上裂解细胞30 min,再用冷冻离心机12 000 r/min离心10 min,取上清液。将上清用5×十二烷基硫酸钠(SDS)上样缓冲液煮沸10 min进行变性,取上清进行上样。电泳结束后用转膜仪将蛋白转移至PVDF膜,再用5 %的脱脂奶粉进行封膜2 h,洗膜。将膜置于一抗稀释液中,4℃孵育过夜,洗膜,将膜转移至二抗稀释液中,室温下孵育2 h。最后加发光液并进行曝光,测定CARM1、Bax、Bcl-2蛋白表达。
1.6双荧光素酶报告基因检测实验 收集细胞,按双荧光素酶报告基因检测试剂盒技术手册要求操作。psicheck2通路载体以萤火虫荧光素酶活性为内参,将psiCHECK2-CARM1-3′非编码区(UTR)野生型(WT)和psicheck2-CARM1-3′UTR突发型(MUT)分别于miR-con、miR-149 mimics共转染,培养48 h,检测细胞的荧光强度。海参荧光素酶的荧光活性与萤火虫荧光素酶荧光活性的比值表示CARM1基因的激活程度。
1.7MTT实验 收集细胞,调整密度至5×106个/ml,取200 μl,然后加入20 μl MTT(5 g/L)溶液,培养4 h,弃上清,再加入150 μl的DMSO,轻轻晃动使结晶溶解,在490 nm波长下检测细胞的吸光度(OD490nm)。
1.8Annexin V-FITC/PI双染实验 收集细胞,用500 μl结合缓冲液将细胞悬浮,分别加入5 μl的 Annexin V-FITC和10 μl的PI,室温下避光反应20 min,结束后立刻上流式细胞仪分析凋亡情况。细胞凋亡率(%)=早期凋亡率+晚期凋亡率。
1.9克隆形成实验 将细胞使用Siemens Primus直线加速器6MV高能X线室温照射,剂量率为3 Gy/min,以0、2、4、6 Gy垂直照射10 cm×10 cm范围,距靶源 30 cm,在放射照射后进行常规培养,每2~3 d换液1次,培养10~14 d。当能用肉眼观察到小白点时进行甲醇固定(15 min)和吉姆萨染色(25 min),最后进行克隆计数。采用单击多靶模型和线性二次函数拟合细胞放射剂量存活曲线分别求出放射生物学参数平均致死剂量(D0)、拟阈剂量(Dq)、外推值(N)和α、β、α/β、癌细胞在辐射照射后的存活分数(SF)2值。
1.10统计学分析 采用GraphPad Prism6.0软件进行单因素方差分析、t检验。
2 结 果
2.1结直肠癌细胞中miR-149和CARM1的表达 与HCEpiC组相比,HT29组miR-149表达量显著降低,CARM1 mRNA和蛋白表达量显著升高(均P<0.001)。见图1、表1。

图1 HCFpiC、HT29细胞中CARM1的表达

表1 结直肠癌细胞中miR-149和CARM1的表达
2.2miR-149靶向CARM1 在miRcode数据库预测得到miR-149与CARM1 3′UTR存在结合位点(图2);与miR-con组相比,miR-149组WT-CARM1细胞中荧光活性显著降低。见表2;与miR-con组(1.00±0.08)相比,miR-149组细胞中CARM1表达(0.17±0.02)显著降低;与anti-miR-con组(1.03±0.07)相比,anti-miR-149组细胞中CARM1表达(1.63±0.11)显著升高(P<0.05)。见图3。

图2 miR-149靶向CARM1的3′UTR

表2 双荧光素酶报告实验

图3 Western印迹检测CARM1表达
2.3过表达CARM1逆转了过表达miR-149对结直肠癌HT29细胞活性的影响 与miR-con组相比,miR-149组CARM1显著降低(P<0.05),培养后48、72 h细胞的活性显著降低(P<0.05);与miR-149+pcDNA组相比,miR-149+pcDNA-CARM1组CARM1表达显著升高(P<0.05),培养后48、72 h时细胞活性显著升高(P<0.05)。见图4,表3。

表3 过表达CARM1逆转了过表达miR-149对结直肠癌HT29细胞增殖的影响

1~4:miR-con组、miR-149组、miR-149+pcDNA组、miR-149+pcDNA-CRAM1组图4 结直肠癌HT29细胞中CARM1的表达
2.4过表达CARM1逆转了过表达miR-149对结直肠癌HT29细胞凋亡的影响 与miR-con组〔(6.27±0.71)%〕相比,miR-149组HT29细胞凋亡率〔(18.29±1.23)%〕显著升高(P<0.05);与miR-149+pcDNA组〔(17.36±1.45)%〕相比,miR-149+pcDNA-CARM1组细胞凋亡率〔(10.52±1.03)%〕显著降低(P<0.05)。
2.5过表达CARM1逆转了过表达miR-149对结直肠癌HT29细胞辐照敏感性的影响 与miR-con组相比,miR-149组细胞SF2显著降低;与miR-149+pcDNA组相比,miR-149+pcDNA-CARM1组细胞SF2显著升高(P<0.05)。miR-149过表达和CARM1过表达放射后单击多靶模型拟合的参数值见表4。
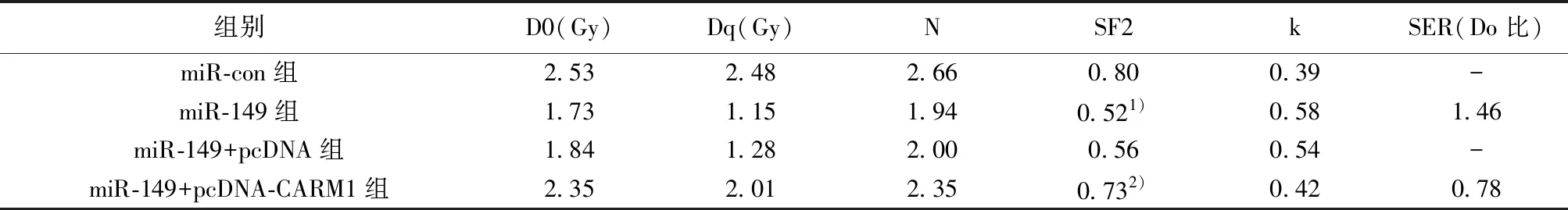
表4 各组辐照后单击多靶模型拟合的参数值
2.6过表达CARM1逆转了过表达miR-149对辐照结直肠癌HT29细胞凋亡蛋白的影响 结果如图5和表5所示,与miR-con组相比,miR-149组细胞中B细胞淋巴瘤(Bcl)-2蛋白表达显著降低,Bcl-2相关X蛋白(Bax)表达显著升高(均P<0.05);与miR-149+pcDNA组相比,miR-149+pcDNA-CARM1组Bax表达显著降低,Bcl-2表达显著升高(均P<0.05);与IR+miR-con组相比,IR+miR-149组Bax表达显著升高,Bcl-2蛋白表达显著降低(均P<0.05);与IR+miR-149+pcDNA组相比,IR+miR-149+pcDNA-CARM1组Bax表达显著降低,Bcl-2表达显著升高(均P<0.05)。
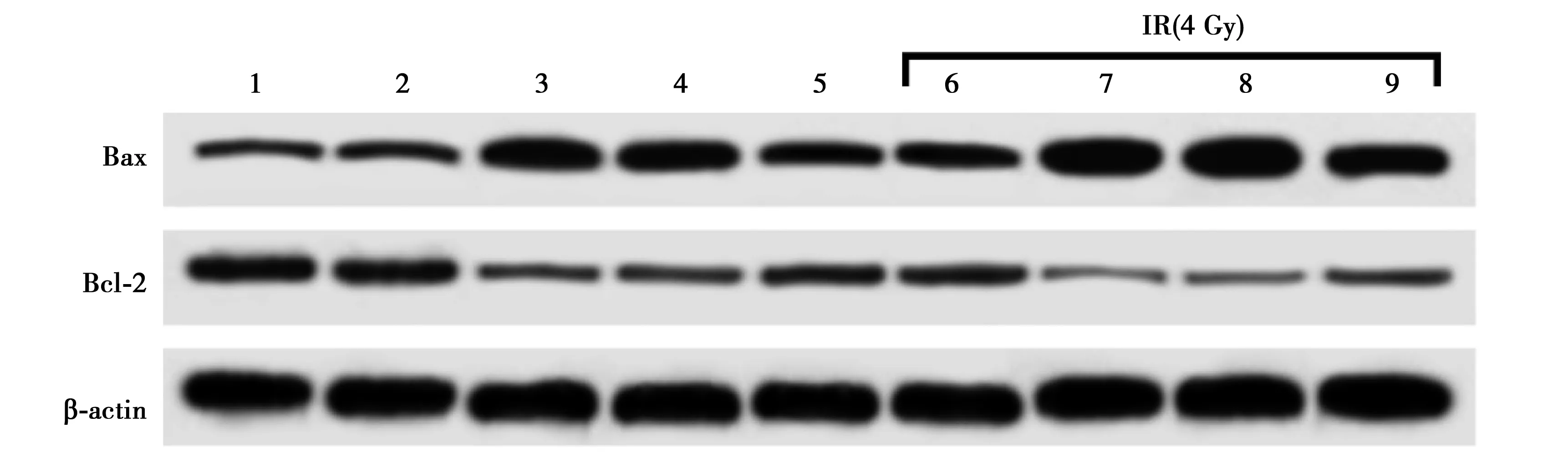
1~9:NC组、miR-con组、miR-149组、miR-149+pcDNA组、miR-149+pcDNA-CRAM1组、IR+miR-con组、IR+miR-149组、IR+miR-149+pcDNA组、IR+miR-149+pcDNA-CRAM1组图5 过表达CARM1逆转了过表达miR-149对结直肠癌HT29细胞凋亡蛋白Bax、Bcl-2表达的影响

表5 过表达CARM1逆转了过表达miR-149对结直肠癌HT29细胞凋亡蛋白Bax、Bcl-2的表达量
3 讨 论
miRNA在人类各种癌症中扮演着原癌基因或致癌基因的角色,其在不同癌症中的功能也存在较大的差异〔9,10〕。研究报道,miR-149在结直肠癌中发挥抑制癌症恶化的作用〔11〕,但其具体的作用机制尚未清晰。Zhang等〔12〕在结直肠癌的研究中报道,miR-149在结直肠癌细胞中表达下调,且上调miR-149的表达可抑制细胞的迁移和侵袭,其直接靶标肝配蛋白B受体(EphB)3沉默处理后可在体内外抑制肿瘤的生长,甚至可逆转上调miR-149对结直肠癌细胞迁移侵袭的抑制作用,推测miR-149可作为结直肠癌治疗的治疗靶标。本研究双荧光素酶报告基因检测实验验证miR-149可直接靶向CARM1,为miR-149在结直肠癌中的机制研究奠定基础。miRNA在肿瘤中的调控网络十分复杂,单个miRNA可同时靶向多个目标基因,单个靶基因又可受多个miRNA的共同调控,如miR-149还可通过下调人附睾蛋白(HE)4增强大肠癌对放射照射的敏感性〔13〕。因此miRNA的作用机制仍有待继续研究,其在临床上应用还需进一步实验。miR-149在结直肠癌中的下游也许还有未发现的靶基因,本研究为miR-149在结直肠癌中的调控机制提供理论参考。
CARM1具有PRMTs家族催化精氨酸的功能〔14〕,进而参与基因的转录后修饰,在调控细胞生存和周期方面的作用尤为突出〔15,16〕。除此之外,CARM1还可作为多种核受体转录的激活子,也可激活其他的转录因子〔17,18〕。CARM1在多种癌症中高表达,发挥促进癌症恶性进程的作用〔19~21〕。Li等〔22〕在结肠癌的研究中发现,miR-195下调、CARM1上调,且 miR-195过表达或CARM1敲低均可抑制结肠癌细胞的集落形成,诱导细胞凋亡,促进了Bax和磷酸化组蛋白2A变异体(γ-H2AX)的表达,并抑制了结肠癌细胞中Bcl-2的表达,并验证了CARM1为miR-195的功能靶标,更重要的是CARM1的恢复表达逆转了由miR-195诱导的结肠癌细胞的增强放射敏感性作用,miR-195可增加结肠癌细胞对体内辐射的敏感性,提示miR-195通过抑制CARM1增强结肠癌细胞的放射敏感性,有望成为结肠癌放射治疗的靶标。
综上,miR-149可抑制结直肠癌细胞的活性并促进细胞凋亡,增强放射治疗的敏感性,其机制可能与靶向CARM1有关,为基因治疗增殖放射的敏感性提供理论支持。

