RRS1对乳腺癌细胞MDA-MB-231侵袭转移的影响及其作用机制
王芳玲 王军 李雪 华亚男 侯琳
(青岛大学基础医学院生物化学与分子生物学系,山东 青岛 266071)
乳腺癌是最常见的恶性肿瘤之一,在世界癌症发病率中排第2位,是女性死亡的主要原因之一[1]。乳腺癌的早期诊断和标准化治疗大大提高了患者的生存率和预后,早期乳腺癌患者总体5年生存率达到90%,但是转移性乳腺癌患者总体生存率仅为26%[2-3]。转移性乳腺癌也被称为晚期乳腺癌,是致命的乳腺癌[4-6]。寻找与乳腺癌增殖、侵袭转移相关的功能基因,是对该疾病实现精准治疗及预警的重要基础。核糖体合成调控因子1(RRS1)参与Pre-rRNA的加工及核糖体生物合成。研究显示,RRS1基因在许多人类肿瘤中过表达,如宫颈癌、甲状腺乳头状癌、肝癌、结直肠癌和乳腺癌等[7-11]。RRS1还可通过RPL11/MDM2介导p53激活来促进乳腺癌的增殖[12]。然而,RRS1是否在乳腺癌MDA-MB-231细胞侵袭和转移中发挥作用仍然未知。上皮-间质转化是乳腺癌细胞侵袭转移的一个重要方面[13]。上皮细胞钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)是典型的上皮间质细胞标志物,磷酸化蛋白激酶B(P-AKT)、糖原合成激酶3(GSK3β)、锌指转录因子(Snail)蛋白是调控上皮间质转化重要的相关蛋白。本研究通过将RRS1基因过表达和RRS1基因敲降的方法进行细胞侵袭转移功能分析,通过检测MDA-MB-231细胞中E-cadherin、Vimentin、P-AKT、GSK3β和Snail蛋白的相对表达情况,探讨RRS1基因对乳腺癌MDA-MB-231细胞的袭转移的影响及其分子机制。
1 材料与方法
1.1 主要材料
人乳腺癌细胞系MDA-MB-231、BT549及正常乳腺上皮细胞HMEC(中国科学院昆明细胞库)。DMEM/HIGH GLUCOSE培养基、胰蛋白酶消化液(美国HyClone公司),BI胎牛血清(中国山东博康公司),青链霉素混合液(中国北京索莱宝公司),RRS1过表达质粒、对照质粒(中国上海汉恒科技有限公司),转染试剂lipo2000、Trizol Reagent(美国Invitrogen公司),RRS1干扰慢病毒(中国上海吉凯公司),Matrigel基质胶(美国BD公司),Transwell小室(美国Millipore公司),RIPA裂解液(北京索莱宝科技有限公司),鼠抗人RRS1、GAPDH单克隆抗体以及兔抗人Snail、E-cadherine、Vimentin、AKT、GSK3β多克隆抗体(英国Abcam公司)。
1.2 细胞培养及处理
使用含有体积分数0.10胎牛血清和0.01青链霉素溶液的高糖DMEM培养基常规培养BT549、MDA-MB-231、HMEC细胞,置于37℃、含有体积分数0.05 CO2细胞培养箱内,待细胞融合达80%~90%时进行传代。在6孔板中常规培养MDA-MB-231细胞,当汇合率到70%左右时,细胞分别转染慢病毒shRNA-Ctrl、shRNA-RRS1、空载质粒以及RRS1过表达质粒,细胞分为空白处理组(A组)、转染shRNA-Ctrl组(B组)、转染shRNA-RRS1组(C组)、转染Vector组(D组)及转染Vector-RRS1组(E组)。
1.3 Western blot实验检测HMEC、BT549、MDA-MB-231细胞中RRS1蛋白的相对表达量
收集细胞,分别提取HMEC、BT549、MDA-MB-231细胞总蛋白,蛋白抽提方法按试剂盒提供的流程,BCA法测蛋白浓度。进行SDS-PAGE 电泳,转膜,封闭液室温封闭2 h,加GAPDH一抗以及RRS1蛋白一抗(1∶1 000),常温孵育2 h,用1×TBST洗膜3次,每次10 min;加入二抗溶液,室温孵育1 h,用1×TBST洗膜3次,每次10 min;最后将ECL发光液按说明书加到PVDF膜上,室温放置1 min,放入成像系统显影并拍照。以GAPDH条带结果为内参照,将各样品RRS1蛋白量分别除以其内参含量,得到的数值即为内参校正后的各样品中RRS1蛋白相对含量。
1.4 Transwell实验、划痕实验分析RRS1基因对乳腺癌MDA-MB-231细胞侵袭、迁移能力的影响
1.4.1划痕实验 用Marker笔在6孔板背后均匀画横线,横线间隔0.5~1.0 cm,横穿过孔。乳腺癌MDA-MB-231细胞转染慢病毒或质粒48 h后,待5组细胞生长至铺满6孔板时,用200 μL枪头垂直于6孔板背后横线在培养皿的整个直径上刮擦细胞以产生划痕区域,并用无血清培养基彻底冲洗以除去所有细胞碎片。然后在6孔板中加入无血清培养基,并在12、24、48 h使用显微镜拍照,观察划痕愈合情况,实验重复3次。
1.4.2Transwell实验 转染慢病毒或质粒48 h后,5组细胞在6孔板中汇合至约80%时,每组将105个MDA-MB-231细胞种于24孔板并且置于Transwell小室中,上室加入100 μL无血清培养基,下室加入600 μL含体积分数为0.30胎牛血清的高糖培养基。放置培养箱培养10~24 h,每隔1 h观察细胞迁移情况。直至观察到下室有细胞出现时终止培养,取出Transwell小室用PBS洗2次,甲醛固定,用吸水纸吸去上室培养基,滴2~3滴结晶紫在小室下表面进行染色,5 min后,冲洗结晶紫,空气晾干后显微镜下进行拍照,实验重复3次。
1.5 Western blot实验检测细胞中E-cadherin、Vimentin、P-AKT、GSK3β、Snail蛋白相对表达量
转染慢病毒或质粒48 h后,将5组细胞在含有蛋白酶抑制剂的RIPA缓冲液中裂解,BCA法测蛋白浓度。蛋白在SDS-PAGE上电泳后转膜,封闭液室温封闭2 h后,加内参一抗和目标蛋白一抗(1∶1 000)在4 ℃条件下孵育过夜,然后用1×TBST洗膜3次,每次10 min;加入二抗溶液孵育1 h,再用1×TBST洗膜3次,每次10 min。最后将ECL发光液按说明书加到PVDF膜上,室温放置1 min,放入成像系统显影并拍照。以GAPDH的条带结果为内参照,将各样品目的蛋白量分别除以其内参含量,得到的数值即为内参校正后的各样品中目的蛋白相对含量。
2 结 果
2.1 HMEC、MDA-MB-231及BT549细胞中RRS1蛋白相对表达量比较
Western blot检测结果显示,HMEC、MDA-MB-231、BT549细胞中RRS1蛋白相对表达量分别为1.03±0.03、3.42±0.04、3.19±0.10,乳腺癌MDA-MB-231以及BT549细胞中的RRS1蛋白相对表达量明显高于正常乳腺上皮HMEC细胞(F=74.71,P<0.01)。见图1。

图1 Western blot实验检测3种细胞中RRS1蛋白的表达水平
2.2 各组细胞中转染效率比较
乳腺癌MDA-MB-231细胞转染慢病毒或质粒48 h后,显微镜下观察转染效率达到70%以上。Western blot检测结果显示,A、B、C、D、E组细胞中RRS1蛋白相对表达量分别为0.97±0.01、1.01±0.01、0.43±0.00、0.93±0.06、1.42±0.01,与A、B组比较,C组细胞中RRS1蛋白相对表达量明显降低,与A、B、C、D组相比较,E组细胞中RRS1蛋白的相对表达量明显增高(F=33.26,P<0.01)。见图2。
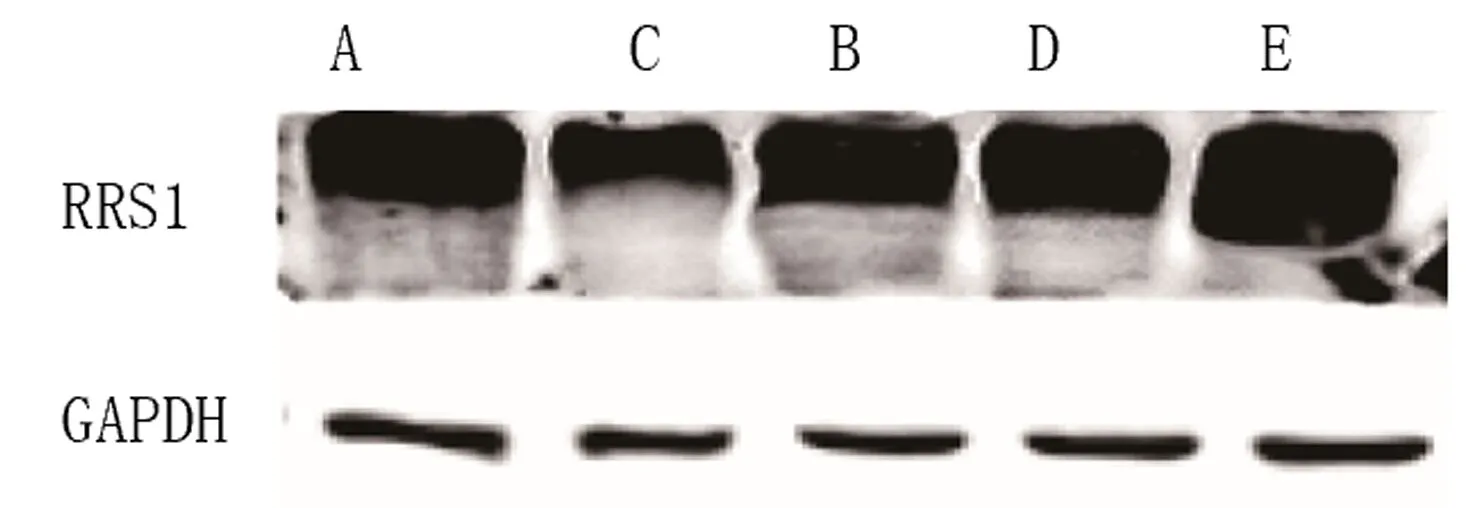
A、C、B、D、E分别为A、C、B、D、E组
2.3 RRS1对MDA-MB-231细胞迁移侵袭的影响
划痕实验结果表明,A~E组细胞迁移率分别为0.61±0.01、0.62±0.01、0.07±0.00、0.71±0.01、0.85±0.00。与A、B组相比,C组细胞的迁移能力明显降低,与A、D组相比,E组细胞迁移能力明显升高(F=187.70,P<0.01)。Transwell实验结果表明,A~E组细胞的侵袭率分别为66.00±1.15、66.67±1.09、20.10±1.13、67.83±1.15、83±1.33,与A、B组相比,C组细胞的侵袭能力明显降低,与A、D组相比较,E组细胞的侵袭能力明显升高(F=208.30,P<0.01)。
2.4 各组细胞中E-cadherin、Vimentin、P-AKT、GSK3β、Snail蛋白相对表达量比较
Western blot检测结果显示,与A、B组相比,C组细胞中Vimentin、P-AKT、GSK3β、Snail蛋白相对表达量明显降低,与A、D组相比,E组细胞中以上蛋白相对表达量明显升高(F=34.29~69.03,P<0.01);与A、B组相比,C组细胞中E-cadherin蛋白相对表达量明显升高,与A、D组相比,E组细胞中E-cadherin蛋白的相对表达量明显降低(F=36.00,P<0.01)。见表1。
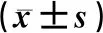
表1 各组细胞当中E-cadherin、Vimentin、P-AKT、GSK3β、Snail蛋白相对表达量比较
3 讨 论
乳腺癌的治疗以手术为主要手段,根据患者的具体情况再辅以化疗、内分泌治疗、靶向治疗等,但术后复发率和转移率仍较高[14]。肿瘤转移是导致乳腺癌患者死亡的主要原因。有25%~50%的乳腺癌患者最终会出现转移[15-17]。因此,需要了解乳腺癌癌变的根本原因,并确定更多的生物分子用于早期诊断和治疗干预。有研究通过对乳腺癌成对样本进行高通量差异表达基因筛选,新发现了一个与乳腺癌发生有关的基因——核糖体合成调控因子1(RRS1)。RRS1基因参与核糖体5SRNP的装配、60S大亚基的成熟以及细胞内的运输过程[18-20]。核糖体的合成是核仁的最重要功能,它调节细胞生长和细胞分裂[21-22]。核糖体生物合成中的错误会导致蛋白质合成中的定量或定性缺陷,并因此导致遗传程序执行不当和特定疾病的发生。本研究旨在探讨RRS1基因对乳腺癌细胞MDA-MB-231侵袭转移的影响及其作用机制,以寻找与乳腺癌增殖、侵袭转移相关的功能基因,是对乳腺癌疾病实现精准治疗及预警的重要基础。
本研究结果显示,乳腺癌MDA-MB-231以及BT549细胞中RRS1蛋白相对表达量明显高于正常乳腺上皮HMEC细胞,由于MDA-MB-231迁移侵袭能力高于BT549,所以选择MDA-MB-231细胞进行后续实验。随后,本研究采用含有RRS1基因干扰序列的慢病毒及含有RRS1基因序列的质粒转染MDA-MB-231细胞,实现RRS1基因敲降或过表达。Transwell和划痕实验表明,RRS1基因对乳腺癌MDA-MB-231细胞有明显的促进侵袭以及迁移的作用。Western blot实验检测了慢病毒以及质粒转染MDA-MB-231细胞48 h后E-cadherin、Vimentin、P-AKT、GSK3β、Snail蛋白的相对表达情况。研究结果发现,敲降RRS1基因表达后,间质细胞标志物Vimentin蛋白相对表达量下降,上皮细胞的标志物E-cadherin蛋白相对表达量升高,且P-AKT、GSK3β、Snail蛋白相对表达量也下降。过表达RRS1基因后,间质细胞标志物Vimentin蛋白相对表达量升高,上皮细胞标志物E-cadherin蛋白相对表达量下降,且P-AKT、GSK3β、Snail蛋白相对表达量也升高。证明RRS1基因很可能通过激活EMT相关信号通路促进乳腺癌MDA-MB-231细胞的侵袭和转移。此研究只是在细胞水平上验证了RRS1基因对乳腺癌MDA-MB-231细胞的作用,后续的体内实验及具体分子机制还需要进一步的研究。
综上所述,RRS1可能在乳腺癌中起到原癌基因的作用,促进乳腺癌MDA-MB-231细胞迁移侵袭,且可能是通过激活EMT相关信号来发挥作用,可能成为乳腺癌治疗研究中新的分子靶点基因。

