RRS1在MPP+诱导SH-SY5Y细胞凋亡过程中表达的变化及意义
能一鸣 张峥 李雪 王芳玲 华亚男 侯琳
(青岛大学基础医学院生物化学与分子生物学系,山东 青岛 266071)
核糖体合成调节因子1(RRS1)是一种调控蛋白,其主要功能是与核糖体产物因子2(RPF2)相互作用,招募核蛋白RPL5、RPL11以及5SrRNA并参与核糖体5SRNP的成熟、60S大亚基的组装和转运[1-3]。编码RRS1蛋白的基因缺失或突变会引起核糖体组装异常,进而影响细胞的正常生命活动[4]。1-甲基-4-苯基吡啶离子(MPP+)是一种常用的帕金森病(PD)模型构建诱导剂,通过抑制细胞线粒体活性,促进氧化应激,引起多巴胺能神经元的凋亡[5]。研究发现RRS1的异常表达与人类肿瘤和神经退行性疾病相关[6-8],在乳腺癌、胃癌、宫颈癌、肝癌和结肠癌中,RRS1被认为与细胞的异常增殖相关,下调RRS1表达会引起细胞增殖抑制和凋亡[9-14]。为了解RRS1与多巴胺能神经元细胞凋亡的关系,本实验设计不同剂量的MPP+处理 SH-SY5Y细胞,分析细胞损伤凋亡与RRS1蛋白表达的相关性,再通过慢病毒过表达RRS1基因,观察SH-SY5Y细胞经MPP+处理后细胞凋亡程度的变化,以及相关凋亡蛋白表达情况的变化,探讨RRS1与MPP+诱导的SH-SY5Y细胞凋亡的关系及作用机制。
1 材料与方法
1.1 材料
SH-SY5Y细胞(中国科学院上海细胞库),胎牛血清、DMEM/HIGH培养基(美国Hyclone公司),MPP+(美国Sigma公司),胰蛋白酶消化液(0.53 nmol/L)、RIPA蛋白质提取试剂盒、BCA蛋白浓度试剂盒、CCK-8试剂(北京索莱宝生物科技有限公司),JC-1试剂盒(上海翊圣生物科技有限公司),兔抗人RRS1单克隆抗体及Bax、Bcl-2、β-Actin抗体(美国Abcam公司),兔抗人P53多克隆抗体以及GAPDH抗体(武汉赛维尔生物科技有限公司),Anexin V-APC/PI试剂盒(美国Thermo Fi-sher Scientific公司),慢病毒载体及转染试剂(上海吉凯公司),qPCR、PCR反转录试剂盒和引物(北京全式金生物有限公司)。
1.2 研究方法
1.2.1细胞培养 将SH-SY5Y细胞置于含体积分数0.15胎牛血清的DMEM培养基中于37 ℃、含体积分数0.05 CO2的细胞培养箱中培养。取对数期生长的细胞并用胰蛋白酶消化,细胞计数以后按照1×106个细胞/孔的密度接种于6孔板,待细胞融合度达到70%时,进行后续实验。
1.2.2CCK-8检测细胞的增殖活力 将对数生长期的SH-SY5Y细胞消化接种于96孔板中,设置4个浓度梯度组(每组5个复孔,每孔3 000个细胞),细胞贴壁以后每孔加入含有不同浓度(0、100、200和400 μmol/L)MPP+的培养基100 μL,继续培养48 h,检测前1 h每孔加入CCK-8试剂10 μL,37 ℃孵育1 h,以酶标仪于波长450 nm处检测各孔吸光度(A)值,并计算细胞活力。实验重复3次,取均值。
1.2.3JC-1法检测细胞线粒体膜电位变化 将对数生长期的SH-SY5Y细胞消化接种于6孔板中,每孔加入培养基2 mL,在细胞融合度达到70%时,弃去原培养基,加入含有不同浓度(0、100、200和400 μmol/L)MPP+的培养基继续培养24 h,吸去上清液,每孔加入1 mL培养基和1 mL JC-1染色工作液,充分混匀,置于细胞培养箱中37 ℃避光孵育20 min。孵育结束以后,吸去上清液,每孔用1×Loading buffer洗涤2次,最后每孔再加入2 mL细胞培养基,荧光显微镜拍照,线粒体膜电位由细胞红绿荧光强度比值表示,实验步骤参照说明书进行。
1.2.4Annexin V-APC/PI双染法检测细胞凋亡情况 取对数生长期的SH-SY5Y细胞消化接种于6孔板,待细胞融合度约70%时,更换含有0、100、200和400 μmol/L MPP+的培养基继续培养48 h,小心收集细胞,按照Annexin V-APC/PI实验说明书检测细胞凋亡情况。以Annexin V-APC(-)/PI(+)为坏死细胞标准,以Annexin V-APC(+)/PI(+)为晚期凋亡细胞标准,以Annexin V-APC(+)/PI(-)为早期凋亡细胞的标准,以Annexin V-APC(-)/PI(-)为正常细胞的标准。
1.2.5Western blot检测细胞P53、RRS1、Bcl-2以及Bax的表达 用含有0、100、200和400 μmol/L MPP+的培养基培养对数生长期的SH-SY5Y细胞48 h,弃去培养基,用PBS轻轻冲洗1次;用RIPA裂解法提取总蛋白,BCA法测定蛋白浓度;加入1/4体积的5×loading buffer后煮沸10 min使蛋白质高温变性;按30 μg总蛋白上样量进行SDS-PAGE电泳和电转,电转结束后用含有50 g/L BSA的封闭液室温封闭2 h;分别加入一抗Anti-RRS1(1∶1 000)、Anti-P53(1∶1 000)、Anti-Bcl-2(1∶1 000)、Anti-Bax(1∶1 000)、Anti-GAPDH(1∶2 000)4 ℃孵育过夜;TBST洗涤3次,每次10 min;加入二抗(1∶2 000)室温孵育1 h,重复TBST的洗膜步骤;将ECL显影液滴加至PVDF膜上,避光1 min;放入成像系统显影拍照并分析条带灰度值;以GAPDH为内参照,将目的蛋白与内参照的灰度值进行比较,计算蛋白相对表达率。
1.2.6慢病毒的构建 从NCBI中获取RRS1基因的CDS全部序列,由上海吉凯公司合成慢病毒,选择编号为GV365的过表达质粒载体,载体元件为hU6-MCS-3FLAG-CMV-EGFP。为排除载体造成的影响,设置以乱序为核心序列的阴性对照,分别得到过表达慢病毒Lv-RRS1和阴性对照慢病毒。
1.2.7慢病毒转染SH-SY5Y细胞 根据慢病毒转染操作手册设计预实验,得出Lv-RRS1及其对照的MOI值为30,以含有Lv-RRS1和对照慢病毒的转染培养基分别培养SH-SY5Y细胞8 h,弃去转染培养基,更换含体积分数0.15胎牛血清的培养基继续培养48 h,得到转染后的Lv-RRS1组和对照组两组细胞,荧光显微镜观察细胞绿色荧光蛋白表达情况,选取80%以上转染的细胞进行后续实验。
1.2.8qPCR检测各转染组细胞mRNA表达水平将转染的细胞用Trizol法提取总RNA,检测RNA的浓度和纯度,反转录合成cDNA,条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃保存;配置qPCR反应体系,采用两步法进行扩增,条件为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火延伸30 s,进行40次循环,采集每一次循环的荧光信号,每个样品设置3个复孔,比较转染组和对照组的相对表达丰度,实验重复3次。RRS1引物:正义链5′-CCCTACCGGACAC-CAGAGTAA-3′,反义链5′-CCGAAAAGGGGTTGAAACTTCC-3′;以GADPH为内参照,GAPDH的引物序列为:正义链5′-AGAAGGCTGGGGCTCATTTG-3′,反义链5′-AGGGGCCATCCACAG-TCTTC-3′。
1.2.9Western blot检测转染后各组细胞RRS1蛋白表达情况 将转染的各组细胞弃去培养基,分别用PBS洗1次,RIPA蛋白裂解法提取各组细胞总蛋白,方法同1.2.5。
1.2.10CCK-8检测转染细胞增殖能力 取转染的Lv-RRS1组和对照组细胞消化接种于96孔板,每组细胞5个复孔,每孔约3 000个细胞,待细胞贴壁后,更换为含有400 μmol/L MPP+的培养基每孔100 μL,继续培养48 h,方法同1.2.2。
1.2.11Annexin V-APC/PI双染法检测细胞凋亡情况 取转染的Lv-RRS1组和对照组细胞消化接种于6孔板,待细胞融合度达到70%时更换为含有400 μmol/L MPP+的培养基继续培养48 h,小心收集细胞,方法同1.2.4。
1.2.12Western blot检测细胞RRS1、P53、Bax和Bcl-2蛋白的表达水平 细胞处理方法同1.2.11,RIPA裂解法提取总蛋白,其余步骤同1.2.5。
1.3 数据处理

2 结 果
2.1 细胞增殖活力检测结果
0、100、200、400 μmol/L MPP+组细胞增殖活力分别为1.00±0.00、0.89±0.01、0.79±0.02、0.62±0.01,随MPP+浓度增大细胞增殖活力明显下降,差异有统计学意义(F=95.63,P<0.05)。
2.2 SH-SY5Y细胞线粒体膜电位检测情况
荧光图片显示,随MPP+浓度增大,红色荧光强度逐渐减弱,绿色荧光强度逐渐增强,0、100、200、400 μmol/L MPP+组的红绿荧光强度比值分别为7.46±0.56、4.37±0.42、2.97±0.68和1.97±0.21,随着MPP+浓度增大,细胞红绿荧光强度比值显著下降(F=69.90,P<0.05)。见图1。
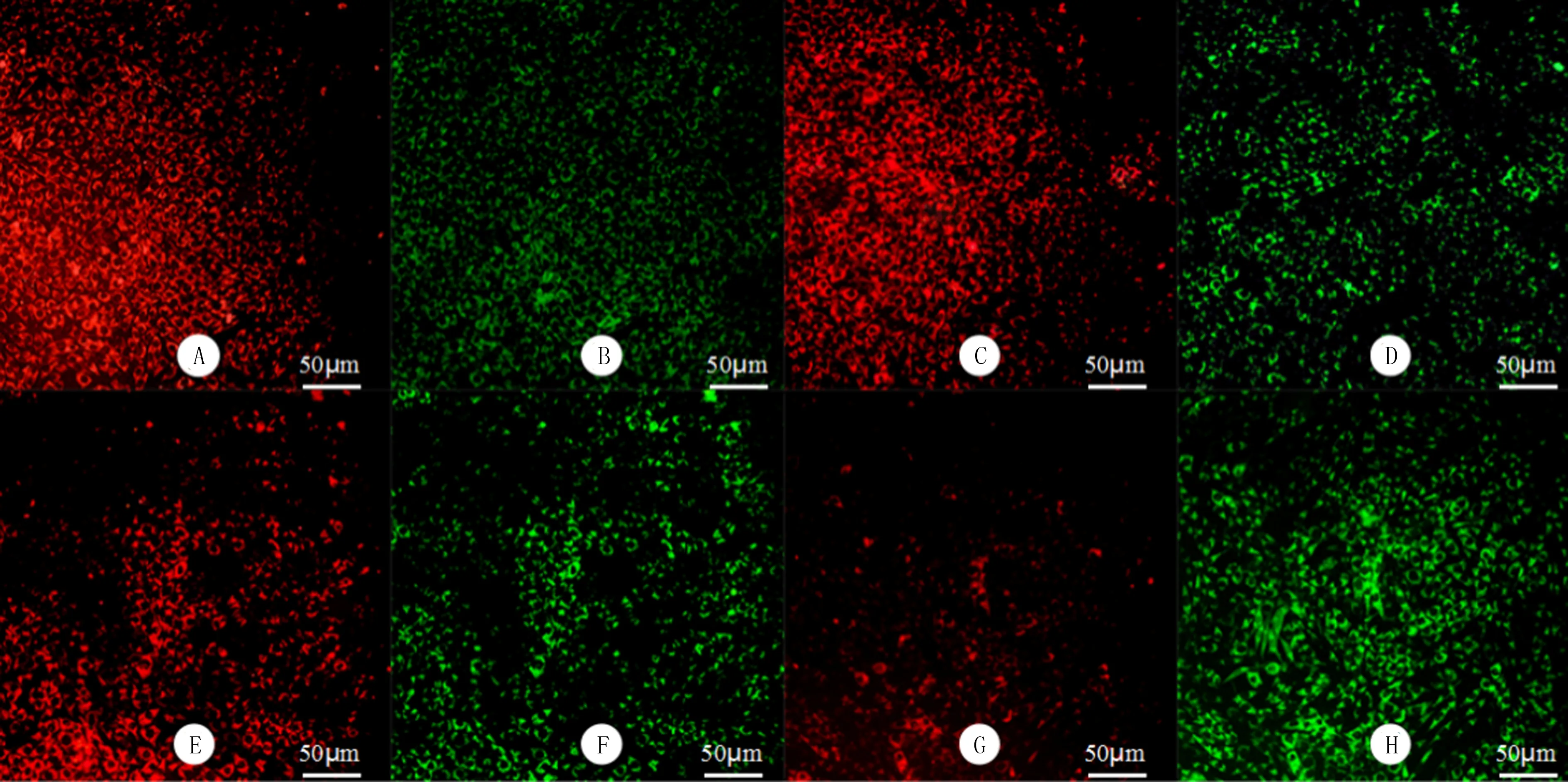
A、B:0 μmol/L MPP+组,C、D:100 μmol/L MPP+组,E、F:200 μmol/L MPP+组,G、H:400 μmol/L MPP+组。JC-1染色
2.3 MPP+对SH-SY5Y细胞凋亡的影响
Annexin V-APC/PI双染法流式细胞仪检测48 h细胞凋亡情况,0、100、200和400 μmol/L MPP+组的细胞凋亡率分别为(2.30±0.57)%、(11.44±1.20)%、(19.70±1.27)%和(35.90±1.71)%,差异具有统计学意义(F=258.49,P<0.01)。见图2。

A、B、C、D分别为0、100、200、400 μmol/L MPP+组
2.4 SH-SY5Y细胞内RRS1、P53、Bcl-2和Bax蛋白表达结果
与0 μmol/L MPP+组比较,200和400 μmol/L MPP+组SH-SY5Y细胞内P53蛋白水平明显升高,差异有统计学意义(F=40.47,P<0.05)。与0 μmol/L MPP+组比较,100、200及400 μmol/L MPP+组细胞RRS1、Bcl-2蛋白的表达水平明显下降(F=28.44、42.43,P<0.05),Bax蛋白表达水平明显升高(F=20.78,P<0.05)。见表1。
表1 各组细胞中P53、Bax、Bcl-2和RRS1蛋白的表达
2.5 RRS1基因过表达后细胞RRS1 mRNA与蛋白的表达水平
Lv-RRS1组和对照组细胞RRS1 mRNA的表达水平分别为2.99±0.17、1.00±0.00,与对照组相比,Lv-RRS1组细胞RRS1 mRNA表达水平明显升高(t=15.59,P<0.01)。Lv-RRS1组和对照组细胞RRS1蛋白表达水平分别为1.81±0.11、1.03±0.13,与对照组相比,Lv-RRS1组细胞RRS1蛋白表达水平明显升高,差异均具有显著统计学意义(t=6.05,P<0.01)。
2.6 RRS1基因过表达后细胞增殖能力检测结果
Lv-RRS1组和对照组的细胞增殖活力分别为0.59±0.01、0.67±0.02,Lv-RRS1组的细胞活力明显高于对照组(t=4.76,P<0.01)。
2.7 流式细胞仪检测RRS1基因过表达和敲降后细胞凋亡情况
Lv-RRS1组和对照组SH-SY5Y细胞凋亡比例分别为(29.63±1.68)%、(38.00±1.16)%,Lv-RRS1组的细胞凋亡比例明显低于对照组(t=5.80,P<0.01)。
2.8 两组RRS1及凋亡相关蛋白检测结果
Lv-RRS1组RRS1、Bcl-2蛋白表达水平明显高于对照组(t=12.41、3.14,P<0.01);P53蛋白和Bax蛋白表达水平明显低于对照组(t=5.20、4.77,P<0.05)。见表2。
表2 过表达RRS1基因后细胞RRS1、P53、Bax和Bcl-2蛋白的表达情况
3 讨 论
PD是一种中老年常见的神经退行性疾病,由于中脑黑质多巴胺能神经元变性死亡,黑质纹状体多巴胺能神经途径活性降低,胆碱能神经元活性亢进,引起患者震颤、肌强直、运动障碍,临床常用左旋多巴胺药物治疗或深部脑刺激来改善症状[15-16],尚无方法治愈。核糖体生物生成障碍会引起P53依赖性细胞应激反应,称之为“核仁应激”[17]。核仁是rDNA转录和核糖体亚基组装的场所,当核仁处于应激时,核仁结构完整性受到破坏,一些核蛋白被释放进入核浆,如RPL5、RPL1、RPL23、RPS3以及RPS27a可以与鼠双微粒体2(MDM2)结合导致P53的活化和细胞衰老[18-20],P53可以通过促进促凋亡基因的转录,诱导线粒体通透性增加导致细胞的凋亡;相反,P53基因缺失对PD模型具有神经保护作用[21],MDM2-P53通路是PD中的一个重要的信号途径[22-23]。
MDM2-P53信号通路一直是肿瘤研究的热点,现有研究表明RRS1蛋白可以在核仁中与核蛋白RPL11结合,当RRS1基因被沉默后,RPL11离开核仁进入核浆与E3泛素连接酶MDM2结合加强,P53蛋白失去抑制被激活[24-25],引起细胞的凋亡,提示沉默RRS1可能通过P53信号途径引起细胞的凋亡。另外RRS1与亨廷顿病联系密切,亨廷顿病是一种显性遗传的神经系统退行性疾病,临床发现HD患者的脑组织RRS1基因的表达上调,在HD小鼠模型中发现RRS1基因在脑组织中表达明显升高,RRS1通过感知内质网应激过程,在异黏蛋白的作用下传递信号,参与亨廷顿病的发生以及发展[8,26]。然而RRS1与其他神经退行性疾病的关系研究较少,特别是RRS1与PD多巴胺能神经元异常凋亡的关系尚未见报道。
本研究以MPP+作为构建PD细胞模型的诱导剂,使用不同浓度的MPP+诱导SH-SY5Y细胞凋亡,用CCK-8、JC-1和流式细胞术方法分析细胞增殖和凋亡情况,结果显示在0~400 μmol/L浓度区间的MPP+可以导致细胞线粒体膜电位的明显降低,处理48 h后细胞增殖活力下降,同时细胞凋亡率升高。Western blot检测MPP+处理细胞48 h后细胞凋亡相关蛋白和RRS1的相对表达量,结果发现,随着MPP+浓度增加,细胞P53、Bax表达升高,RRS1、Bcl-1表达降低,表明RRS1在MPP+诱导SH-SY5Y细胞凋亡中表达降低。为进一步验证RRS1与细胞凋亡的相关性,通过慢病毒载体过表达RRS1基因的方式上调细胞中RRS1的蛋白表达量,再用400 μmol/L MPP+处理稳定转染的细胞48 h构建PD细胞模型,并对细胞增殖和凋亡情况进行再次检测,结果发现,与对照组相比,上调RRS1表达后SH-SY5Y细胞增殖活力升高,且细胞凋亡减少,表明RRS1参与并影响了细胞的凋亡过程。实验进一步对补偿RRS1表达后细胞凋亡相关蛋白P53、Bax和Bcl-1的相对表达量进行分析,结果显示,上调RRS1表达后,促凋亡蛋白P53和Bax表达降低,抗凋亡蛋白Bcl-2表达升高,与对照组产生了截然相反的结果,提示RRS1可能是通过P53以及Bax/Bcl-2信号途径参与MPP+诱导的SH-SY5Y细胞凋亡过程。本研究为RRS1在PD细胞模型的作用提供了一定的理论基础,然而RRS1在PD模型细胞凋亡过程是否存在其他调控机制尚不清楚,其在体内实验的具体作用还需要进一步研究。
综上所述,MPP+诱导SH-SY5Y细胞凋亡的过程中,RRS1蛋白表达下降,RRS1可能通过影响凋亡相关因子P53、Bax和Bcl-2蛋白的表达参与MPP+诱导的SH-SY5Y细胞的凋亡。初步显示了RRS1在PD细胞模型中的作用及意义。

