自噬相关基因LC3和ATG5在胃癌中的表达及临床意义
许祥云 陈书昌 孔德九 侯欣欣 陈强 陈静
河南科技大学临床医学院,河南科技大学第一附属医院(河南洛阳471003)
胃癌严重威胁人类健康,是全球最常见的恶性肿瘤之一。根据GLOBOCAN 的最新统计数据显示,2018年全球胃癌新发病例约103.3 万例,死亡病例约78.3 万例,分别位于恶性肿瘤死亡率第5 位、死亡率第2 位,位居消化系统恶性肿瘤的第1位[1-2]。由于胃癌早期无明显临床症状,大部分患者就诊时病情已发展到中晚期阶段,预后极差[3]。因此对胃癌诊断和治疗的研究已成为目前医学工作的重点[4]。
自噬是一个高度保守的有多个步骤参与的代谢过程,通过降解已受损的蛋白质、细胞代谢产物和病变的细胞器来维持细胞内环境的稳态[5]。近期有研究发现胃癌的发生发展与自噬活性的改变有关,且自噬相关基因微管相关蛋白1 轻链3(microtubule-associated protein 1 light chain 3,LC3)和自噬相关基因-5(autophagy related gene-5,ATG5)均是参与自噬活性调控的重要基因。LC3 是哺乳动物中与酵母菌ATG8 同源的基因[6],其编码的蛋白是在高等真核细胞中发现的第1 种自噬体膜蛋白,可作为自噬标志性分子监测自噬活动[7]。而ATG5位于人类6号染色体长臂上,包含384个核苷酸多态性位点(single nucleotide PolymorPhism,SNP),编码276 个氨基酸,是自噬过程中一种重要的ATG 基因[8],在自噬体形成的早期阶段,由ATGl2-ATG5-ATGl6L 形成的ATG5 复合物与自噬体外膜结合,促进了自噬体的伸展扩张[9],另外还促进了LC3 向自噬体的募集。当双层膜结构的自噬体即将形成环状闭合结构时,ATG5 复合物便从膜上脱离下来[10],只留下LC3-II 锚定在自噬体膜上,因此,LC3-II 含量与自噬体数量呈正比。由此可知,ATG5 促进自噬体形成,而LC3 是自噬体形成的标志。
CORREA 等[11]提出的“正常胃黏膜→LGIN→HGIN→胃癌”公认的肠型胃癌发生模式,在该途径中自噬所扮演的角色及意义也引起广泛的关注[12]。然而从正常胃黏膜→不典型增生→胃癌组织中,自噬基因LC3 和ATG5 在其中扮演角色尚未明确。本研究采用实时荧光定量(quantitative realtime Polymerase chain reaction,qRT-PCR)、免疫蛋白印迹(Western Blot)和免疫组织化学法(immunohistochemistry,IHC)从核酸和蛋白两个水平上首次验证LC3 和ATG5 在胃癌发生不同阶段的表达情况,并通过Pearson 相关分析首次分析LC3 与ATG5蛋白在胃癌发生不同阶段的相关关系,为进一步了解胃癌的发生、进展与自噬活性改变之间的关系提供相关依据。
1 资料与方法
1.1 一般资料经河南科技大学第一附属医院医学伦理委员会批准,收集2017-2019年河南科技大学第一附属医院胃镜室及手术室病理确诊的胃新鲜组织共58 例,其中男42 例,女16例,平均年龄为(62.5±12.5)岁。病理提示胃黏膜正常组17 例,不典型增生组19 例,胃癌组22 例,所有标本剪取后即刻一分为二,一半放入10%甲醛溶液中固定;另一半立即放入液氮中,随后转存-80 ℃冰箱备用。胃癌病理分型参照WHO 分型标准,不典型增生诊断参照维也纳分型标准[13],由两位高年资病理医师重新阅片诊断。所有病例均为首次发现,且经组织病理学明确诊断,患者术前未行任何放、化疗,临床资料完整,并签署知情同意书。
1.2 试验试剂qRT-PCR 主要试剂:反转录试剂盒(Aidlab 公司);PCR 引物(上海捷瑞)。Western Blot 主要试剂:BCA 蛋白定量试剂盒(康为世纪);30%聚丙烯酰胺(索莱宝);PVDF 膜(密理博)。免疫组化主要试剂:LC3 兔单克隆抗体(Abcam 公司:ab222776)和ATG5 兔单克隆抗体(Abcam 公司:ab108327);兔/鼠通用型SP 试剂盒(DAB)试剂盒(康为世纪)。
1.3 试验方法
1.3.1 qRT-PCR(1)组织RNA 的提取:每份冻存标本取1 mm3剪碎研磨,加入1 mL Trizol(总RNA提取试剂)溶液裂解后经氯仿等提取细胞总RNA,以DNA/RNA 测定仪测定RNA 的纯度和浓度,调整mRNA 的浓度在1.8~2.0。(2)cDNA 的合成按反录试剂盒说明合成。(3)PCR 反应LC3 和ATG5 引物序列:5′-TGGATTGGTCGTGTTCATCGT-3′(上游引物),5′-CGGCTGTGTAGTCAGGGTAAG-3′(下游引物),ATG5 引物序列:5′-CAGACAACGACTGAAAGACCT-3′(上游引物),5′-CAGGATCAATAGCAGAAGGACAA- 3′(下游引物),以GAPDH 作为内参照。Q-PCR 扩增。设定合适的荧光强度阈值,将每孔样品对应的Ct 值导入Bio-Rad 公司开发的Gene ExPression Analysis 软件,各样本的目的基因扩增量与GAPDH 基因扩增量的比较采用2-ΔΔCt法进行。
1.3.2 Western Blot称取正常胃黏膜组织、不典型增生胃黏膜组织、胃癌组织约100 mg 剪碎,在液氮中充分研磨,加入约100 μL RIPA 蛋白裂解液;4 ℃下12 000 r/min 离心30 min 后取上清,测定蛋白浓度。配制10%的浓缩胶和12%的分离胶,每泳道加总蛋白量20 μg 进行电泳分离;在稳流状态下低温将蛋白转至PVDF 膜,在含5%脱脂奶粉的TBST 溶液中常温封闭1.5 h。分别加入兔抗人LC3 及ATG5 单克隆抗体(1∶1 000),4 ℃孵育过夜。10 min×3 次TBST 洗膜后加入HRP 标记的山羊抗兔二抗(1∶1 000),室温孵育1 h。10 min×3次TBST 洗膜后ECL 进行显影、定影,GAPDH 作为内参。采用Image J 图像分析软件,分别用LC3-Ⅰ、LC3-Ⅱ和ATG5 与GAPDH 灰度比值,表示LC3 和ATG5 蛋白相对表达量。
1.3.3 免疫组化各组胃组织石蜡标本切片,脱蜡,水化,高压热修复抗原,3%过氧化氢氧化15 min;滴加LC3、ATG5 一抗(工作液浓度均为1∶100),4 ℃过夜;滴加通用型二抗,37 ℃孵育30 min;DAB 色,LC3 显色时间为3 min,ATG5 显色时间为5~10 min;苏木素复染,盐酸乙醇分化,返蓝,脱水透明,封片[12]。LC3 用已知结直肠癌的阳性切片作为阳性对照,ATG5 用肝癌切片作为阳性对照,均用PBS 代替一抗作为阴性对照。根据组织切片着色的阳性细胞数和着色面积进行评分,随机挑选5 个高倍镜视野观察(400 ×),采用二级计分法进行结果判断:染色强度评分标准为:未着色,阴性,0 分;着色呈浅黄色,弱阳性,1 分;着色呈黄色或深黄色,中度阳性,2 分;着色较强呈黄褐色,强阳性,3 分;染色面积评分标准为:0 分:无阳性细胞;1 分:阳性细胞计数<25%;2 分:阳性细胞计数占26%~50%;3 分:阳性细胞计数占>50%。免疫组化着色评分=染色强度评分×染色面积评分,0 分记为“-”,表示阴性;1~2 分记为“+”,表示弱阳性;3~4 分记为“++”,表示中阳性;≥5 分记为“+++”,表示强阳性。为方便统计,将“-”、“+”定为阴性,“++”和“+++”定为阳性[14]。
1.4 统计学方法应用SPSS 23.0 软件包进行统计学分析:剂量资料经正态性检验后服从正态分布。(1)LC3 和ATG5mRNA 表达的计量资料用()表示,数据采用方差齐性检验后,应用单因素方差分析,两两比较采用t检验法;(2)LC3 和ATG5蛋白定量表达结果用()表示,数据采用方差齐性检验后,采用单因素方差分析,两两比较采用t检验法;(3)LC3 和ATG5 蛋白阳性表达率,二者与胃癌患者临床病理特征的相关分析,采用χ2检验和Fisher 精确检验分析;(4)LC3 和ATG5 蛋白的相关性分析采用Pearson 相关法;(5)检验水准:α=0.05。以P<0.05 为差异有统计学意义。
2 结果
2.1 qRT-PCR 结果通过qRT-PCR 法检测LC3 mRNA 在不同胃组织中的表达情况,利用2-ΔΔCt法测得正常组中LC3 mRNA表达量为(35.85±27.12),不典型组中LC3 mRNA 表达量为(118.20±15.07),胃癌组中LC3 mRNA 表达量为(165.68±23.88),3 组间差异有统计学意义(F=25.34,P<0.05);不典型组中LC3 mRNA 表达量显著高于正常组,差异有统计学意义(P<0.05);胃癌组中LC3 mRNA 表达量显著高于不典型组,差异有统计学意义(P<0.05)。见表1。
ATG5 mRNA 在不同胃组织中的表达情况:正常组中ATG5 mRNA 表达量为(2.41±1.45),不典型组中ATG5 mRNA 表达量为(8.61±0.49),胃癌组中ATG5 mRNA 表达量为(10.44±0.53),3 组间差异具有统计学意义(F=60.85,P<0.05)。不典型组中ATG5 mRNA 表达量显著高于正常组(P<0.05),胃癌组中ATG5 mRNA 表达量显著高于不典型组,差异有统计学意义(P<0.05)。见表2。
表1 LC3mRNA 在不同胃组织中的相对表达量Tab.1 Relative expression of LC3 mRNA in different gastric tissues ±s

表1 LC3mRNA 在不同胃组织中的相对表达量Tab.1 Relative expression of LC3 mRNA in different gastric tissues ±s
注:正常组与不典型组比较,*P<0.05;正常组与胃癌组比较,#P<0.05;不典型组与胃癌组比较,&P<0.05
分组正常组不典型组胃癌组例数17 19 22 LC3 mRNA 35.85±27.12 118.20±15.07*165.68±23.88# &F 值25.34 P 值0.01
表2 ATG5mRNA 在不同胃组织中的相对表达量Tab.2 Relative expression of ATG5 mRNA in different gastric tissues ±s

表2 ATG5mRNA 在不同胃组织中的相对表达量Tab.2 Relative expression of ATG5 mRNA in different gastric tissues ±s
注:正常组与不典型组比较,*P<0.05;正常组与胃癌组比较,#P<0.05;不典型组与胃癌组比较,&P<0.05
分组正常组不典型组胃癌组例数17 19 22 ATG5mRNA 2.41±1.45 8.61±0.49*10.44±0.53#&F 值60.85 P 值0.01
2.2 Western Blot 结果利用Western blot 法在蛋白水平上,定量检测LC3 和ATG5 在不同胃组织中表达情况,以GAPDH 蛋白作为内参进行对照结果示:LC3-Ⅰ分子量为16 kDa,LC3-Ⅱ分子量为14 kDa,ATG5 蛋白分子量为32 kDa,GAPDH 蛋白的分子量约为37 kDa,利用Image J 软件对试验结果进行定量分析。见图1。
正常组中LC3 的蛋白表达量为(14.78±5.43),不典型组中LC3 的蛋白表达量为(25.89±6.77),胃癌组中LC3 的蛋白表达量为(34.33±12.10),3 组间差异具有统计学意义(F=11.71,P<0.05),不典型组对比正常组LC3 蛋白表达量有显著提高,差异具有统计学意义(P<0.05),胃癌组中LC3蛋白表达量较不典型组有显著提高,差异具有统计学意义(P<0.05)。正常组中ATG5 的蛋白表达量为(0.79±0.32),不典型组中ATG5 的蛋白表达量为(1.35±0.41),胃癌组中ATG5 的蛋白表达量为(2.00±0.75),3 组间比较差异具有统计学意义(F=11.94,P<0.05),不典型组中ATG5 蛋白表达量较正常组有显著提高,差异具有统计学意义(P<0.05),胃癌组中ATG5 蛋白表达量较不典型组有显著提高,差异具有统计学意义(P<0.05)。见表3。

图1 Western Blot 法在蛋白水平上检测LC3 和ATG5 在不同胃组织中表达情况Fig.1 Western Blot method to detect the expression of LC3 and ATG5 in different gastric tissues at protein level
LC3 和ATG5 蛋白表达水平在正常组、不典型组及胃癌组中均呈正相关(r=0.89、0.80、0.72,P<0.05)。见表3。
2.3 免疫组化结果运用免疫组织化学法在蛋白水平上,定性检测LC3 和ATG5 蛋白在不同胃组织中表达情况,镜下可见LC3 和ATG5 的阳性表达,阳性定位主要存在于细胞胞质中,成棕黄色颗粒状染色。部分胞核也可见少许浅黄色阳性着色。胃黏膜正常组织表达以弱阳性为主,不典型增生和胃癌组织中表达则以强阳性为主。见图2、3。
LC3 在58 例不同胃组织中,正常组中有3 例阳性表达,阳性表达率为17.6%;不典型组中有10 例阳性表达,阳性表达率为52.6%,不典型组中明显高于正常组,差异具有统计学意义(P<0.05);胃癌组中有18 例阳性表达,阳性表达率为81.8%,胃癌组中明显高于不典型组,差异具有统计学意义(P<0.05)。见表4。
表3 Western Blot 检测不同胃组织中LC3 和ATG5 蛋白表达和相关性分析Tab.3 Western Blot method to detect LC3 and ATG5 protein expression in different gastric tissues and correlation analysis ±s

表3 Western Blot 检测不同胃组织中LC3 和ATG5 蛋白表达和相关性分析Tab.3 Western Blot method to detect LC3 and ATG5 protein expression in different gastric tissues and correlation analysis ±s
注:正常组与不典型组比较,*P<0.05;不典型组与胃癌组比较,#P<0.05;正常组与不典型组比较,★P<0.05;不典型组与胃癌组比较,&P<0.05
分组正常组不典型组胃癌组例数17 19 22 LC3 蛋白14.78±5.43 25.89±6.77*34.33±12.10#ATG5 蛋白0.79±0.32 1.35±0.41★2.00±0.75&r 值0.89 0.80 0.72 P 值0.01 0.01 0.03

图2 免疫组化法检测不同胃组织中LC3 蛋白表达Fig.2 Immunohistochemical to detect the expression of LC3 proteinin different gastric tissues

图3 免疫组化法检测不同胃组织中ATG5 蛋白表达Fig.3 Immunohistochemical to detect the expression of ATG5 protein in different gastric tissues

表4 LC3 在不同胃组织中的蛋白表达情况Tab.4 Expression of LC3 protein in different gastric tissues
ATG5 在不同胃组织中蛋白表达,正常组中有1 例阳性表达,阳性表达率为5.9%;不典型组中有7 例阳性表达,阳性表达率为36.8%,由Fisher 确切检验法得知:不典型组中明显高于正常组,差异具有统计学意义(P<0.05);胃癌组中有15 例阳性表达,阳性表达率为68.2%,胃癌组阳性表达率高于不典型组,差异具有统计学意义(P<0.05)。见表5。
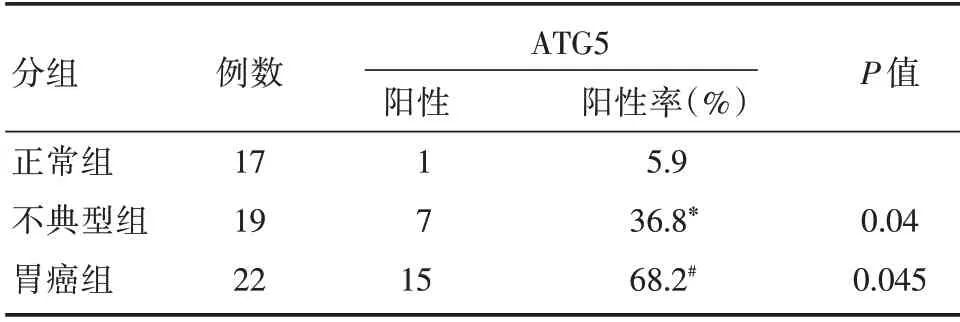
表5 ATG5 在不同胃组织中的蛋白表达情况Tab.5 Expression of ATG5 protein in different gastric tissues
2.4 LC3 和ATG5 蛋白表达与胃癌患者临床病理特征的相关性LC3 蛋白表达情况与性别(P>0.05)、年龄(P>0.05)、浸润深度(P>0.05)、分化程度(P>0.05)及淋巴结状态(P>0.05)均无相关性。ATG5 蛋白表达情况与浸润深度(P<0.05)、分化程度(P<0.05)及淋巴结状态(P<0.05)存在显著相关性。见表6。
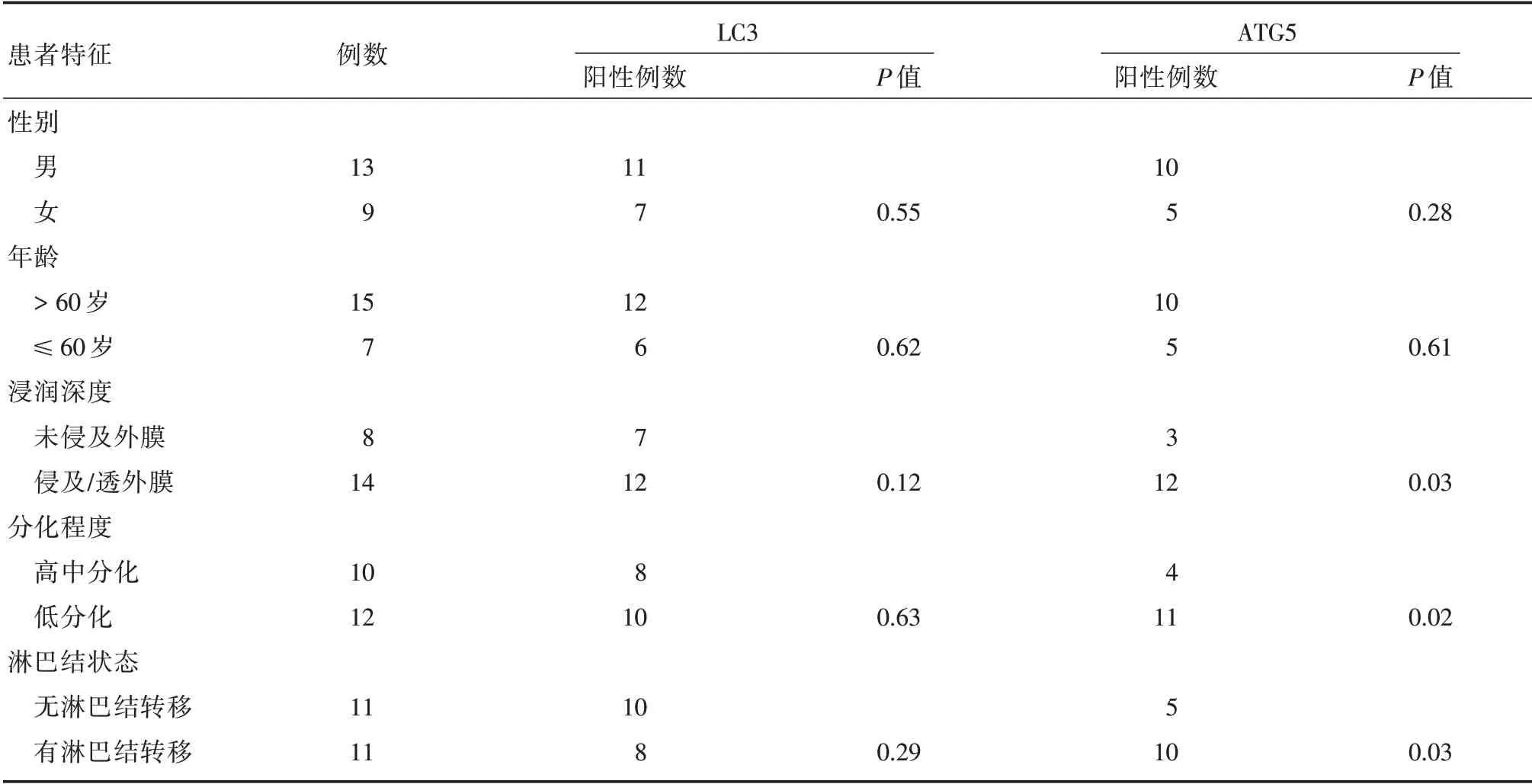
表6 LC3 和ATG5 蛋白表达与胃癌组织临床病理特征Tab.6 Expression of LC3 and ATG5 proteins and clinicopathological characteristics of gastric cancer
3 讨论
自噬是细胞依靠自身溶酶体来清除细胞内代谢废物或受损细胞器、长寿命蛋白质以及入侵微生物的一种维持细胞基本生命活动的过程[15]。从酵母菌到人类,这一过程均高度保守,是维持细胞动态平衡的方式之一。自噬在“正常胃黏膜→LGIN→HGIN→胃癌”公认的肠型胃癌发生模式中所扮演的角色引起了广泛的关注,然而自噬基因LC3 和ATG5 在其中所扮演的角色尚未研究。因此本研究采用qRT-PCR、Western Blot、免疫组织化学法首次从核酸和蛋白两个水平上验证LC3 和ATG5 在肠型胃癌发生模式中的表达情况。试验结果证明:在核酸和蛋白水平上结果一致,相互印证。在不同胃组织中,LC3 和ATG5 的表达也不相同,从正常胃黏膜→不典型增生→胃癌组织,LC3和ATG5 mRNA 和蛋白表达均逐渐上升,并差异具有统计学意义,提示自噬参与并促进胃癌的发生发展过程,为进一步了解胃癌的发生发展与自噬活性改变之间的关系提供相关依据。
自噬基因LC3 是哺乳动物细胞中与ATG8 同源的基因,定位于前自噬泡和自噬体膜的表面,参与自噬体的形成,其含量多少与自噬体的数量呈正比,通过检测LC3 的含量可反映自噬活性[16]。其有Ⅰ型与Ⅱ型两种存在形式,当自噬发生时,LC3-Ⅰ经泛素样加工修饰过程生成其蛋白水解衍生物LC3-Ⅱ(分子量分别为16 kDa 和14 kDa)。LC3-Ⅰ被定位于细胞质,而LC3-Ⅱ结合于自噬体膜表面[17],因此LC3-Ⅱ能更直观的反映自噬体形成的多少,从而反映自噬活性。LIAO 等[18]的研究表明LC3 的阳性表达与Ⅰ-Ⅲ期胃癌患者术后的复发风险呈正相关,与Ⅳ期胃癌患者的生存呈负相关,提示LC3 可作为胃癌预后监测指标之一。李良庆等[19]通过免疫组化对96 例石蜡标本进行研究显示,LC3 在胃癌中的表达明显高于癌旁,提示自噬参与胃癌的发生。胡云峰等[20]应用免疫组化法分析120 例胃癌组织和配对正常的胃组织,结果显示:胃癌组织中LC3 的蛋白表达量明显高于正常组织,且LC3 高表达的患者无疾病进展生存时间更短,提示胃癌组织中有自噬发生,且LC3 的高表达是胃癌的不良预后因素。而目前通过观察正常胃黏膜、不典型增生胃黏膜、胃癌中自噬变化规律的较为鲜见,本研究通过检测LC3 在胃癌演变不同阶段的mRNA 和蛋白表达,更加直观的反应了自噬与胃癌发生发展的关系,从正常组→不典型组→胃癌组,LC3 的mRNA 和蛋白水平逐步增高,且LC3 是自噬形成的标志性基因,得知自噬参与并促进胃癌的发生发展,但LC3 和性别、年龄、浸润深度、分化程度、淋巴结状态均无相关性,可能与LC3 表达量较高而样本量较小有关。既往有一些大样本量的研究,如王晨宇等[21]采用免疫组化对60 例胃癌和40 例癌旁组织进行分析显示,LC3 蛋白与胃癌组织的肿瘤大小、分化程度及TNM 分期相关;黄俊玲等[22]的研究显示LC3 蛋白表达与120 例胃癌患者的肿瘤分化程度和淋巴结转移密切相关。
ATG5 在自噬体膜形成的早期阶段,参与自噬体的形成。宋兆孟等[23]的研究表明在酵母和哺乳动物中去除ATG5 能阻滞自噬,因此,ATG5 在自噬中起重要作用[23-24]。王婷等[25]表明ATG5 在卵巢癌中表达与良性卵巢肿瘤及交界性卵巢肿瘤相比明显升高,下调ATG5 表达水平后卵巢癌增殖能力明显受到抑制。另外,李新等[26]也在检测50 例前列腺上皮内瘤变组织、69 例前列腺癌、30 例良性前列腺增生中ATG5 的表达情况时发现,ATG5 的表达上调可能在前列腺癌的发生发展中起作用。有此可见ATG5 在多种肿瘤中均呈现高表达状态,然而ATG5 在胃癌发展过程中的研究较为少见,本研究从核酸和蛋白两个水平上检测得知,ATG5在不典型增生组和胃癌组织中的mRNA 和蛋白表达显著高于正常组,提示随着肿瘤的逐步进展,ATG5 的表达水平越来越高,自噬作用越来越强。同时,ATG5 与胃癌的浸润深度、分化程度和淋巴结转移均有密切关系,而与患者的年龄、性别无明显相关。相比未侵及外膜,高、中分化胃癌,无淋巴结转移者,ATG5 蛋白在侵及外膜,低分化,有淋巴结转移的胃癌组织中的自噬水平进一步上调,推测恶性程度越高和进展期胃癌的自噬活性水平明显上调,并且肿瘤细胞可通过上调自身自噬水平来促进其增殖生长[18],提示ATG5 相关的自噬水平上调对胃癌的发展具有重要促进作用。
此外,既往研究常分析LC3、ATG5 等单一因子对胃癌的发生发展作用的意义,与之对比,本研究通过Pearson 相关分析首次发现ATG5 与LC3 蛋白在胃癌发展不同阶段呈正相关,提示LC3 和ATG5两者互为调控,在胃癌的发生、发展过程中发挥协同作用。
综上所述,胃癌的发生发展可能与LC3 和ATG5 自噬活性增强有关,且LC3 和ATG5 可能在促进胃癌的发生发展中起相互协同的作用,进而对胃癌的诊治提供潜在的临床应用价值。但目前有关自噬在胃癌中的作用仍存有争议,不同类型、不同阶段的胃癌,自噬水平不同导致的预后也会不同。因此,进一步开展大样本的临床研究以明确自噬对不同类型、不同阶段的胃癌预后的影响。

