地塞米松对大鼠心肌梗死后巨噬细胞极化及心功能的影响
宋吉哲 刘成林 杜爱玲
1潍坊医学院内科学教研室(山东潍坊261000);2潍坊医学院附属医院心内科(山东潍坊261031)
急性心肌梗死(acute myocardial infarction,AMI)发生后,梗死区域随即出现中性粒细胞渗入,之后便有单核巨噬细胞的浸润,并在AMI 后的炎症反应和组织修复中发挥重要作用。巨噬细胞中M2 亚型巨噬细胞通过产生抗炎调节因子(IL-4、IL-10、IL-13、TGF-β等)在炎症的消退、组织重塑过程中发挥关键作用[1-3]。而糖皮质激素在慢性阻塞性肺疾病等炎症性疾病和风湿性疾病治疗中有着无法代替的地位[4],恰恰这部分患者往往具有冠心病危险因素的存在,极易诱发急性心肌梗死。有研究表明,糖皮质激素能够抑制巨噬细胞介导的免疫炎症反应,调节巨噬细胞向M2 型极化,并使其促炎性细胞因子分泌减少,在炎症消退中发挥重要作用[5-8]。特别是对于需要临床常规应用激素治疗但又罹患AMI 的患者来说,糖皮质激素的应用是非常必要的,但是糖皮质激素对于AMI 的影响却鲜有报道。本研究通过大鼠建立AMI 模型,探讨地塞米松对AMI 的影响及可能的机制。
1 材料与方法
1.1 材料
1.1.1 实验仪器Vivid E9 彩色多普勒超声诊断仪(美国GE 公司),实时荧光定量聚合酶链反应仪(美国AppliedBiosystems 公司),Trizol(美国Invitrogen 公司),One Step SYBR®PrimeScriptTMRT-PCR Kit 试剂盒(日本TaKaRa 公司)。
1.1.2 实验动物及分组44只雄性SD大鼠(动物合格证号:SCXK 鲁20190003),体质量220~250 g,采用随机等间隔抽样法抽取8 只为假手术组,其他36 只大鼠采用左冠状动脉前降支结扎法建立AMI 模型,将术后24 h 建模成功存活的19 只大鼠随机分为对照组10 只和实验组9 只。实验组大鼠于模型建立后24 h 给予地塞米松1 mg/kg 肌肉注射1 次,假手术组及对照组大鼠于术后24 h 给予0.2 mL/kg 等容生理盐水肌肉注射。该研究得到了潍坊医学院附属医院医学实验动物伦理委员会的批准。
1.1.3 大鼠AMI 模型的建立实验大鼠的麻醉采用腹腔注射10%水合氯醛(300 mg/kg),将成功麻醉后的SD 大鼠取其仰卧位固定到操作台上,经口腔进行气管插管,成功后连接到小动物呼吸机上,呼吸机设定:呼吸频率设置为60 次/min,潮气量设置为3 mL/l00 g,呼吸时比设置为3∶2。选取大鼠3、4 肋间胸骨左缘0.5 cm 处为手术切口,予以剪毛备皮后碘伏消毒,切开皮肤后钝性分离,暴露出大鼠的心脏,打开心包后在左心耳的下缘用6/0 带线眼科针缝扎左冠状动脉前降支,可见室壁搏动减弱苍白,心电图ST 段或T 波抬高表示成功。然后,缝合大鼠胸廓肌肉、皮下组织和皮肤,关闭大鼠胸腔,随后3 d,每12 h 肌肉注射400 000 U 青霉素。待大鼠的自主呼吸恢复后撤掉呼吸机。假手术组的8 只大鼠只进行开胸、左冠状动脉前降支血管下穿线,但不予血管结扎,其他的手术步骤相同。
1.2 方法
1.2.1 超声心动图检查术后4 周各组大鼠行超声心动图检查,检测各组大鼠左心室舒张末期内径(LVEDD)、左心室收缩末期内径(LVESD)、左心室射血分数(LVEF)、左室短轴缩短率(FS)。
1.2.2 大鼠心肌组织取材及标本制备建模4 周后,各组大鼠用10%水合氯醛300 mg/kg 腹腔注射,麻醉、处死,快速开胸取出心脏,冰盐水冲洗后,沿结扎处垂直于心脏长轴方向将左心室一分为二,部分心肌贮存于液氮中待用于逆转录聚合酶链反应(RT-PCR)的检测,其余部分心肌组织于70%乙醇过夜,随后经乙醇脱水、二甲苯透明、石蜡包埋后切成厚度4 μm 的切片,再经过60 ℃烤片后室温放置过夜,待自然干燥后行苏木精-伊红(HE)染色,应用光学显微镜观察切片病理变化。
1.2.3 RT-PCR 检测巨噬细胞标志物的mRNA 表达水平使用Trizol 法提取梗死区周围心肌细胞总RNA,将1 μg 的RNA 逆转录合成cDNA 第一链,以GAPDH 作为内参基因,RT-PCR 检测M1 型巨噬细胞标志物TNF-α、IL-6 及M2 型巨噬细胞标志物IL-10、TGF-β1 的mRNA 水平。见表1。

表1 RT-PCR 引物序列Tab.1 RT-PCR primer sequences
1.3 统计学方法采用SPSS 23.0 软件对本研究所涉及数据进行相关处理,计量资料采用均数±标准差表示,多重比较采用单因素方差分析,两组间比较采用独立样本t检验;计数资料采用例(%)表示,应用χ2检验;以P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠存活情况比较假手术组大鼠因麻醉过深死亡1只,存活率为87.5%;36只AMI模型组大鼠,术后24 h 内存活19 只,存活率为55.9%,明显低于假手术组(P<0.05);对照组及实验组大鼠1 周内各死亡2 只,差异无统计学意义(P>0.05);其余大鼠存活至实验结束。
2.2 超声心动图结果术后4 周,3 组大鼠LVESD、LVEDD、LVEF、FS 比较差异有统计学意义(均P<0.001),与假手术组比较,对照组及实验组大鼠LVESD、LVEDD 均升高,LVEF、FS 均降低,差异有统计学意义(均P<0.05);与对照组比较,实验组大鼠LVESD、LVEDD 均降低,LVEF、FS 均升高,差异有统计学意义(均P<0.05)。见表2。
表2 术后4 周各组大鼠超声心动图指标比较Tab.2 Comparison of echocardiographic indexes of rats in each group 4 weeks after operation ±s

表2 术后4 周各组大鼠超声心动图指标比较Tab.2 Comparison of echocardiographic indexes of rats in each group 4 weeks after operation ±s
注:与假手术组比较,*P<0.05;与对照组比较,#P<0.05。t1,对照组与假手术组比较;t2,实验组与假手术组比较;t3,实验组与对照组比较
组别假手术组对照组实验组t1值t2值t3值F值例数7 8 7 LVESD(mm)3.75±0.35 7.12±0.58*6.04±0.47*#-13.316-10.326 3.894 93.033 LVEDD(mm)7.48±0.49 9.97±0.86*8.55±0.63*#-6.708-3.558 3.584 24.631 LVEF(%)69.27±6.23 32.60±3.56*39.97±4.71*#14.239 9.924-3.448 114.299 FS(%)50.45±3.22 24.07±3.03*29.77±3.51*#16.340 11.486-3.374 132.926
2.3 左心室组织形态学改变术后4 周HE 染色显示:假手术组的心肌细胞纤长,大小均匀,排列有序,无明显炎性细胞的浸润;对照组的心肌细胞肿大明显,排列杂乱无章,部分心肌纤维出现断裂,可见明显炎性细胞的浸润;实验组心肌细胞稍有肿大,排列稍杂乱,心肌纤维偶有断裂,稍有炎性细胞浸润(图1)。
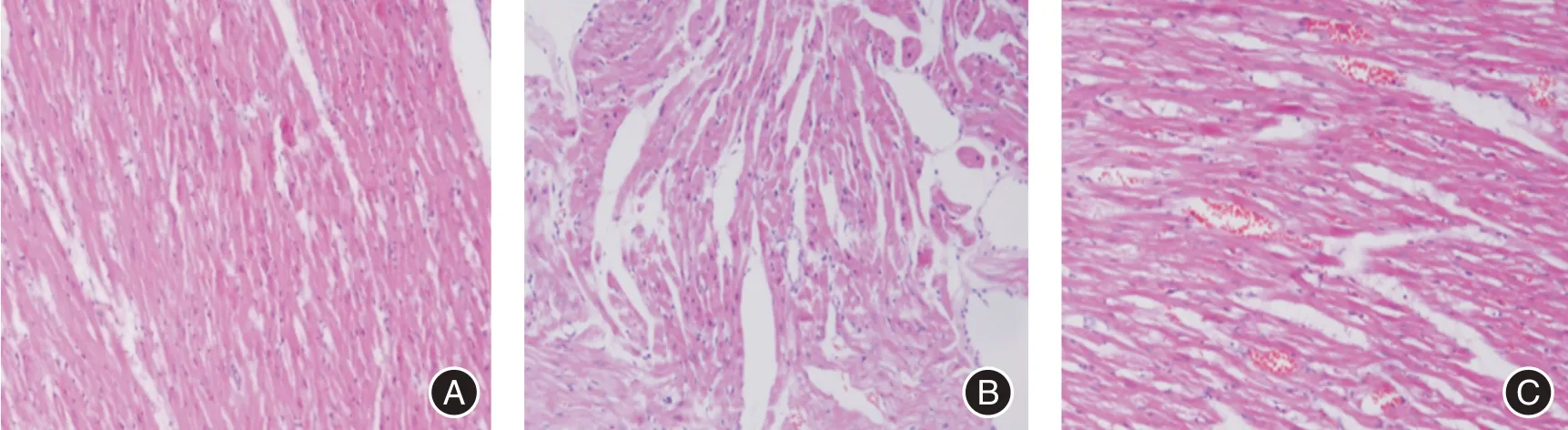
图1 心肌组织HE 染色结果(HE,×200)Fig.1 HE staining results of myocardial tissue(HE,×200)
2.4 术后4周梗死区周围组织M1型巨噬细胞标志物IL-6、TNF-α和M2 型巨噬细胞标志物IL-10、
TGF-β1的mRNA表达水平术后4周,3组大鼠梗死区周围组织IL-6、TNF-α、IL-10和TGF-β1的mRNA表达水平比较差异有统计学意义(均P<0.001)。与假手术组比较,对照组与实验组大鼠IL-6、TNF-α、IL-10、TGF-β1 的mRNA 表达水平明显升高,差异有统计学意义(均P<0.05);与对照组比较,实验组大鼠IL-6、TNF-α mRNA 相对表达量明显降低,差异有统计学意义(P<0.05),IL-10、TGFβ1 的mRNA 表达水平明显升高,差异有统计学意义(P<0.05)。见表3。
表3 各组IL-6、TNF-α、IL-10、TGF-β1 的mRNA 相对表达量统计Tab.3 Statistics of relative expression of IL-6,TNF-α,IL-10 and TGF-β1 mRNA in each group ±s
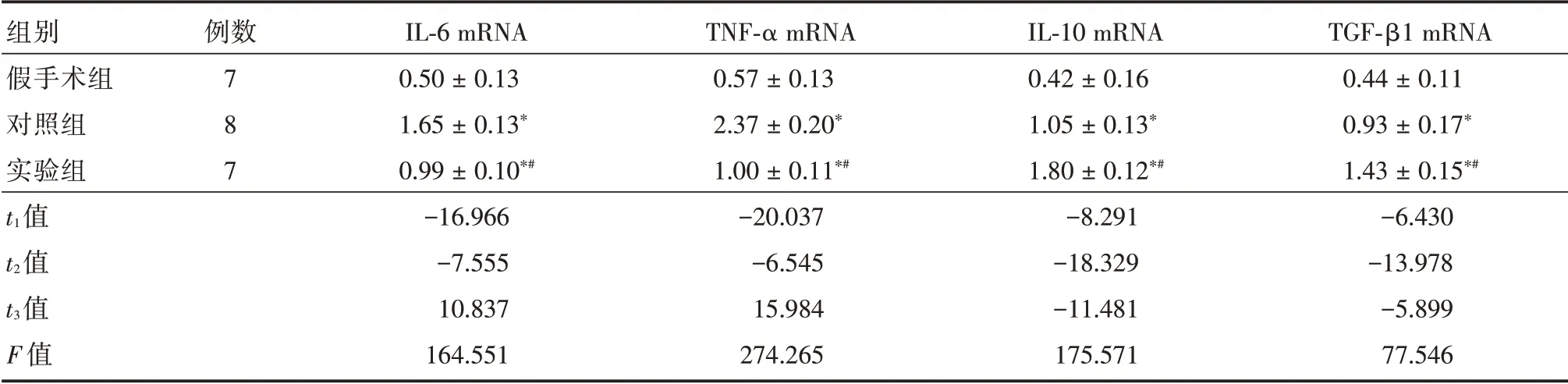
表3 各组IL-6、TNF-α、IL-10、TGF-β1 的mRNA 相对表达量统计Tab.3 Statistics of relative expression of IL-6,TNF-α,IL-10 and TGF-β1 mRNA in each group ±s
注:与假手术组比较,*P<0.05;与对照组比较,#P<0.05。t1,对照组与假手术组比较;t2,实验组与假手术组比较;t3,实验组与对照组比较
组别假手术组对照组实验组t1值t2值t3值F 值例数7 8 7 IL-6 mRNA 0.50±0.13 1.65±0.13*0.99±0.10*#-16.966-7.555 10.837 164.551 TNF-α mRNA 0.57±0.13 2.37±0.20*1.00±0.11*#-20.037-6.545 15.984 274.265 IL-10 mRNA 0.42±0.16 1.05±0.13*1.80±0.12*#-8.291-18.329-11.481 175.571 TGF-β1 mRNA 0.44±0.11 0.93±0.17*1.43±0.15*#-6.430-13.978-5.899 77.546
3 讨论
近年来,AMI 的发病率居高不下[9],心梗后心衰也就成了心血管系统的常见病、多发病,也是致死的主要原因。众所周知,AMI 后的心室重构是其重要病理基础。AMI 出现后,即有大量的中性粒细胞渗入到梗死部位,随后出现单核巨噬细胞的浸润,在AMI 后的炎症反应及损伤坏死组织的修复中发挥着重要作用[10],并影响患者的心室重构及心功能。过度的炎症反应会加重组织损伤,延缓组织修复,在梗死心肌组织修复过程中单核巨噬细胞介导的炎症显得尤为重要[11]。本研究发现,经地塞米松干预后,实验组大鼠的促炎细胞因子TNF-α、IL-6 的表达明显低于对照组,而抑炎细胞因子IL-10、TGF-β1 的表达明显高于对照组,实验组大鼠的心肌组织形态学改变及心功能也显著优于对照组,提示糖皮质激素可调节心肌梗死后心肌组织的炎症因子的表达,小剂量地塞米松可减轻心肌梗死后的炎症反应,减轻心肌损伤,改善心肌梗死后心功能。
巨噬细胞在机体的宿主防御、炎症反应等调节上发挥着重要作用,是先天免疫的重要组成部分,巨噬细胞极化不是固定的,因为巨噬细胞具有足够的可塑性,可以整合多种信号,例如来自微生物、受损组织和正常组织环境的信号[1-3,12-13]。在激活过程中巨噬细胞主要有促炎的M1 型和抗炎的M2 型巨噬细胞两种亚型,M1 型巨噬细胞可以诱导表达TNF-α及IL-6 等细胞因子,M2 型巨噬细胞具有高表达IL-10 的表型特征,可以诱导表达TGF-β等细胞因子[1,12,14-15]。研究[16-17]表明,单核巨噬细胞细胞介导的炎症是心肌缺血再灌注损伤和AMI后愈合过程的主要机制。MASAKI等[18]研究发现,用过氧化物酶体增殖物激活受体-γ(PPAR-γ)激动剂靶向干预动物模型中的单核细胞/巨噬细胞极化,使其偏移于抗炎的M2 型,可抑制急性炎症并促进AMI 后心脏愈合,降低了AMI 后的病死率。
目前,在人体及动物实验研究均发现糖皮质激素是M2 型巨噬细胞极化的重要刺激物[19-20]。本研究发现:术后4 周,对照组及实验组大鼠心肌梗死区周围组织的M1 型巨噬细胞标志物IL-6、TNF-α和M2 型巨噬细胞标志物IL-10、TGF-β1 的mRNA 表达水平均高于假手术组,但在实验组大鼠的M1 型巨噬细胞标志物IL-6、TNF-α明显低于对照组,而M2 型巨噬细胞标志物IL-10、TGF-β1 的mRNA 表达水平明显高于对照组,提示心肌梗死后存在明显巨噬细胞的浸润,而糖皮质激素的干预可能促进心肌梗死区浸润的巨噬细胞向M2 型转化,从而减轻心肌梗死后的炎症反应,减轻心肌损伤,保护心功能。
虽然本研究发现糖皮质激素能够通过调节M1 型巨噬细胞向M2 型极化来抑制心肌组织炎症反应及梗死后心室重构,特别是对于具有糖皮质激素适应征的其他基础疾病的AMI 患者,本研究提供了一定的临床意义,但其具体加用糖皮质激素的时间、剂量以及糖皮质激素的多效性和巨噬细胞的多面性在AMI 的转归和预后中还存在众多未知领域,还需要进一步的研究。

