调控叉头盒转录基因F1表达对非小细胞肺癌细胞上皮间质转化、迁移和侵袭的作用
钟圣鹏 殷俊 傅文凡 江泽勇 戴璐 邓博云 赵健
广州医科大学附属肿瘤医院肺肿瘤外科(广州510095)
叉头盒(forkhead-box,FOX)转录调控基因家族是一个进化保守的转录因子家族,FOX 家族蛋白参与细胞生长、分化、胚胎发生和衰老等多种生物学过程,是调节转录和DNA 修复的DNA 结合蛋白[1-2]。FOX 基因家族不仅在胚胎发育过程中起核心作用,而且在成人体中也起核心作用,研究表明,FOX 家族基因的失调和(或)突变往往会诱发人类的遗传疾病,导致癌症或衰老[3-5]。
叉头盒转录基因F1(forkhead box-F1,FOXF1)是FOX 转录调控基因家族重要的一员,位于人类染色体16q24.1,FOXF1 与多种器官特别是肺的发生发育及功能的维持密切相关[6-9]。胚胎时期,FOXF1 转录因子就是正常肺形态发生不可缺少的因素,FOXF1 可以维持肺内皮细胞的屏障功能,防止肺损伤后出现水肿,对于正常肺内稳态和损伤后的肺修复来说FOXF1 是必需的[10-12]。研究表明FOXF1 基因与多种癌症的发生发展有着密切的联系[6,13-15],GIALMANIDIS 等[14]发现在Hedgehog 阳性非小细胞肺癌中FOXF1的大量表达,但对于FOXF1在非小细胞肺癌中发挥的具体作用及其机制尚未有研究报道。本实验通过调控FOXF1 基因的表达,研究其对非小细胞肺癌细胞上皮间充质转化、迁移和侵袭的影响和作用机制,以探究FOXF1 是否可作为一个潜在的肿瘤治疗的新靶标或转移标志物。
1 材料与方法
1.1 细胞及主要试剂人非小细胞肺癌细胞株PC9 由广州医科大学附属肿瘤医院肿瘤研究所提供并保存;shRNA 慢病毒及阴性对照病毒由GeneCopoeia 公司设计合成;RPMI-1640 培养基、胎牛血清、胰蛋白酶购自GIBCO 公司;CCK-8 细胞增殖试剂盒及实时荧光定量qRT-PCR 检测试剂盒购自上海翊圣生物科技有限公司;Tranwell 小室购自美国Corning 公司;FOXF1 抗体购自Abcam 公司,β-Catenin、N-cadherin、Vimentin、Snail、E-cadherin、ZO-1抗体购自Cell Signaling Technology(CST)公司,GAPDH 抗体购自Affiniti 公司。
1.2 方法
1.2.1 细胞培养将PC9 细胞在含10%胎牛血清的RPIM-1640 完全培养基中培养,培养于37 ℃、5%CO2饱和湿度的细胞培养箱中,2 d 换液1 次,待细胞融和度达80%~90%,用0.25% Trypsin-EDTA溶液消化传代,取处于对数生长期的细胞用于后续实验。
1.2.2 细胞转染和稳定株的构建根据FOXF1 基因序列,由GeneCopoeia 公司设计合成特异序列的shRNA 慢病毒(命名为shFOXF1),同时合成阴性对照shRNA(命名为shControl)。取对数生长期PC9 细胞,将细胞随机分为shRNA 敲低组和阴性对照组,按照shRNA 慢病毒操作说明进行转染,转染成功后传代培养,嘌呤霉素药物筛选,构建稳定表达细胞株。
1.2.3 实时荧光定量Real-time RT-PCR收集对数生长期shRNA 敲低组和阴性对照组细胞,使用TRIzol 试剂盒提取细胞总RNA,按逆转录试剂盒操作说明逆转录合成cDNA,以cDNA 为模板进行PCR 扩增,以GAPDH 为参照,采用2-△△Ct法计算FOXF1 mRNA 的相对表达量。GAPDH 引物序列:Forward:5′-GACTCATGACCACAGTCCATGC-3′,Reverse:5′-AGAGGCAGGGATGATGTTCTG-3′。两对FOXF1 基因PCR 引物序列:Forward 1:5′-TCCCTGGAGCAGCCGTAT-3′,Reverse 1:5′-GCGACTGCGAGTGATACCG-3′;Forward 2:5′-CACTCCCTGGAGCAGCCGTATC-3′,Reverse 2:5′-AAGGCTTGATGTCTTGGTAGGTGA-3′。
1.2.4 CCK-8法检测细胞增殖采用CCK-8 法,取对数生长期细胞,配置2.0×104/mL 细胞悬液,接种于96 孔板,每孔加入100 μL 细胞悬液,实验设3 个复孔,常规培养。贴壁后分别培养0、24、48、72、96、120 h,加10%CCK-8 溶液孵育1 h,吸出孔内液体,加入另一空白96 孔板中上机检测,震荡混匀10 s,酶标仪于450 nm 波长处读取OD值,以测量时间点为横坐标,OD值为纵坐标绘制生长曲线。
1.2.5 平板克隆形成实验检测细胞增殖取对数生长期的各组细胞,分别用0.25%Trypsin-EDTA 溶液消化并吹打成单个细胞,使用含10%胎牛血清的RPMI-1640 培养基,将细胞悬液作梯度倍数稀释,每组细胞分别以每皿1 000、500 个细胞的密度分别接种于6 孔板中,置于37 ℃、5%CO2饱和湿度的细胞培养箱中培养10~14 d,当培养皿中出现肉眼可见的克隆时,终止培养。用PBS 浸洗,加4%多聚甲醛固定细胞,结晶紫染液染色后,将6 孔板倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆数。
1.2.6 Transwell 实验检测细胞迁移准备Corning Transwell 迁移小室及24 孔板,用无血清RPMI-1640培养基调整细胞浓度为2×105/mL,取200 μL 加入上室,将500 μL含10%胎牛血清的RPMI-1640培养基加入下室,培养箱培养36 h后取出小室,PBS洗涤3遍,4%多聚甲醛固定,结晶紫染色,PBS洗涤3遍,棉签轻柔擦去上室面细胞,将小室置于倒置显微镜下观察细胞数量。
1.2.7 Transwell 实验检测细胞侵袭准备Corning Transwell 侵袭小室及24 孔板,水化基底膜,向每个小室上室中加入50 μL无血清培养基,置于37 ℃培养箱30 min后,吸走培养基;使用无血清RPMI-1640培养基调整细胞浓度为5×105/mL,取200 μL 加入上室,将500 μL 含20%胎牛血清的RPMI-1640 培养基加入下室,培养箱培养24 h 后取出小室,后续同1.2.6 操作步骤。
1.2.8 Western Blot 法检测细胞FOXF1 蛋白的表达收集对数生长期的细胞,加入适量RIPA 裂解液和蛋白酶抑制剂PMSF,冰浴裂解细胞30 min,4 ℃12 000g离心15 min,吸取上清液,BCA 试剂盒定量蛋白浓度,100 ℃煮沸10 min 后进行SDSPAGE 电泳。将蛋白半干电转于PDVF 膜上,5%脱脂牛奶封闭1 h 后,加入FOXF1(1∶5 000)、GAPDH(1∶4 000)、β-Catenin(1∶2 000)、N-cadherin(1∶2 000)、Vimentin(1∶2 000)、Snail(1∶2 000)、Slug(1∶2 000)、E-cadherin(1∶2 000)、ZO-1(1∶2 000)抗体4 ℃平衡摇床轻摇孵育过夜。TBST 洗去一抗,加入IgG-HRP 标记二抗(1∶5 000),室温孵育1~2 h:TBST 洗膜3次,化学发光法显影,以GAPDH作为内参。
1.3 统计学方法应用SPSS 19.0 统计软件对数据进行统计分析,GraphPad Prism 7.0 版软件处理数据分析作图,数据采用均数±标准差表示,实验组间比较采用两样本均数t检验,多组之间比较采用单因素方差分析,以P<0.05 表示差异有统计学意义。
2 结果
2.1 shRNA-FOXF1 对PC9 细胞的沉默效果在PC9细胞中转染shRNA-FOXF1慢病毒后,其FOXF1基因表达水平下调。Real-time PCR 实验结果显示,与对照组相比,实验组细胞的FOXF1 mRNA 表达水平明显下调(P<0.01,图1)。Western Blot 实验结果显示,转染shRNA 慢病毒后细胞FOXF1 蛋白的表达量明显减少(P<0.05,图2)。实验结果提示转染成功,有效的干预FOXF1 的表达。

图1 Real-time RT-PCR 检测PC9 细胞系中FOXF1 mRNA水平Fig.1 FOXF1 mRNA levels were determined by real-time PCR in PC9 cell lines
2.2 FOXF1 沉默对细胞增殖的影响CCK8 增殖实验结果如图3示,以450 nm 波长的OD值表示细胞增殖水平,在0、24、48、72、96、120 h 等时间段比较实验组与对照组的OD值。结果与对照组相比,转染shRNA 抑制FOXF1 表达后,PC9 细胞的增殖能力显著降低,在72~120 h 细胞增殖能力下降变得明显,实验组与对照组的OD值变化趋势有显著差异(P<0.01)。平板克隆实验结果如图4示,同样表明抑制FOXF1 表达后,PC9 细胞克隆形成能力显著下降(P<0.01)。
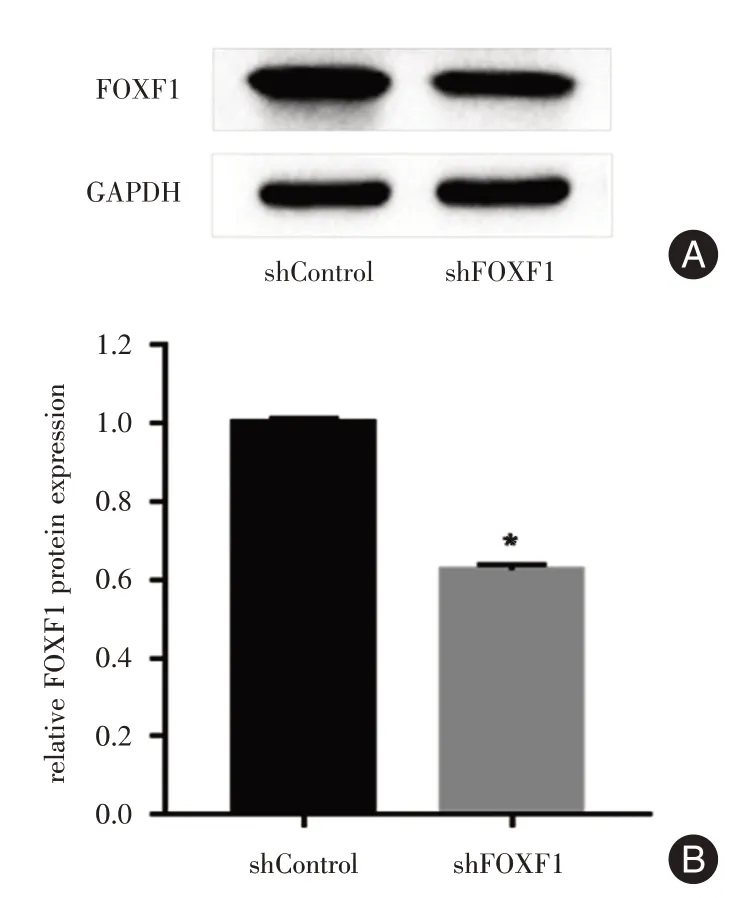
图2 Western Blot 实验检测FOXF1 蛋白水平的变化Fig.2 Experssion of FOXF1 protein were measured by Western Blot

图3 CCK-8 法检测FOXF1 沉默对PC9 细胞增殖的影响Fig.3 The cell counting kit-8 assay was conducted to determine the effect of down-regulation of FOXF1 expression on proliferation of PC9 cells
2.3 FOXF1 沉默对PC9 细胞迁移、侵袭能力的影响Transwell 迁移实验表明,shRNA-FOXF1 干扰后,PC9 细胞迁移能力相对于对照组细胞明显降低(图5A、C),shRNA-FOXF1 组中PC9 细胞的迁移率为(25.30±7.42)%,与对照组(100±13.00)%相比差异有统计学意义(P<0.01),表明沉默FOXF1可抑制癌细胞的体外迁移能力。Transwell 侵袭实验表明,shRNA-FOXF1 干扰后,PC9 细胞侵袭能力相对于对照组细胞明显降低(图5B、D),shRNAFOXF1 组中PC9 细胞的侵袭率为(12.80±2.78)%,与对照组(100±14.51)%相比差异有统计学意义(P<0.01),表明沉默FOXF1 可抑制癌细胞的体外侵袭能力。

图4 平板细胞克隆形成试验检测细胞集落/克隆能力Fig.4 The plate colony were conducted to test for tumorigenicity of PC-9 cells
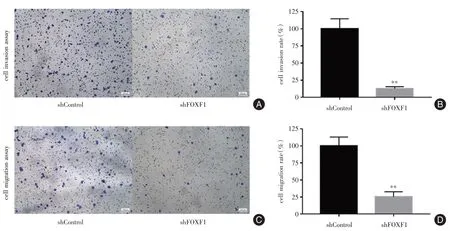
图5 FOXF1 沉默对PC9 细胞迁移与侵袭能力的影响(×10)Fig.5 The effect of shRNA-FOXF1 on migration and invasion in PC9 cells(×10)
2.4 FOXF1 沉默处理对细胞EMT 相关基因表达的影响Western Blot 实验结果显示,与对照组细胞相比,shRNA-FOXF1 转染PC9 细胞后,EMT 相关基因β-Catenin 、N-cadherin、Vimentin、Snail 表达下调,E-cadherin、ZO-1 表达上调,差异有统计学意义(P<0.05,图6)。
3 讨论

图6 FOXF1 沉默对细胞EMT 相关基因表达的影响Fig.6 Down-regulation of FOXF1 expression affects cell EMT-related gene expression
肿瘤进展、转移是导致肺癌患者死亡的根本原因[16-17],若在肿瘤转移初始就提早发现改变治疗方案或针对肿瘤转移机制进行针对治疗,对于延长中晚期肺癌患者的生存期具有十分重要的临床意义。FOX 转录调控基因家族许多成员已被研究证实是调控肿瘤发生发展的抑癌/癌基因,FOXF1基因是作为FOX基因家族中重要的一员,很多研究者对其进行了研究。部分研究者发现FOXF1的表达降低了肿瘤细胞的生长和入侵的潜力,认为FOXF1 基因是抑癌基因[18];而更多研究结果认为FOXF1 是一类癌基因,证实FOXF1 能通过激活Hedgehog、MAPK、ERK5 等通路来促进上皮-间皮细胞转变表型和增强侵袭性潜能[13,19]。不同甚至相同癌症类型中的这些相互矛盾的发现表明FOXF1在癌发生中的作用是复杂的,可能取决于肿瘤类型或组织特异性。研究[14]发现在Hedgehog(HH)阳性非小细胞肺癌中FOXF1 大量表达,这种高丰度与转移呈正相关,本课题组前期工作中通过基因芯片测序技术及RT-qPCR 实验检测非小细胞肺癌组织中FOXF1 表达水平同样验证了这一结论。为进一步探讨和研究FOXF1 与非小细胞肺癌发生发展、侵袭转移之间的关系,加深对FOXF1 基因特性的认识,本实验采用shRNA干扰技术沉默FOXF1的表达,首次在体外研究FOXF1 对肺腺癌细胞PC9 的增殖、上皮间质转化和迁移和侵袭能力的直接影响,为判断FOXF1 能否作为非小细胞肺癌基因治疗的新靶点或肿瘤转移标志物提供一定的依据。
本研究设计合成针对FOXF1 的特异性shRNA慢病毒,对非小细胞肺癌PC9 细胞株进行转染,RT-PCR 实验和Western Blot 实验结果显示,转染后PC9细胞中FOXF1基因表达显著降低,表明FOXF1基因表达被抑制。CCK-8 实验和平板克隆实验表明FOXF1 沉默后PC9 细胞的增殖能力受到抑制,Transwell 迁移及侵袭实验结果显示癌细胞的迁移及侵袭能力明显降低,这些结果初步认定FOXF1在肺癌细胞中可能扮演了癌基因的角色。本研究还通过Western Blot 实验对EMT 标志物进行了检测,发现FOXF1 沉默后可抑制N-cadherin、β-Catenin、Vimentin、Snail 的表达,并促进ZO-1 和E-cadherin的表达,表明FOXF1 沉默后癌细胞的上皮-间质转化受到了抑制。
目前对FOXF1 在NSCLC 中的作用机理研究并不多,本实验在NSCLC 细胞系中直接调控FOXF1的表达,初步评估了FOXF1 在调节NSCLC 肿瘤细胞生长、迁移、侵袭中的作用,判断FOXF1 的表达能促进癌细胞的侵袭转移。本实验组发现A549肺癌细胞系中FOXF1 基因表达水平较低,下一步可在A549 细胞系中过表达FOXF1,正反验证FOXF1 表达对NSCLC 细胞增殖、侵袭能力的影响,进一步说明该条通路的作用。
有研究发现上皮-间质转化与非小细胞肺癌放疗敏感性相关[20],未来笔者将尝试探讨FOXF1 表达与NSCLC 细胞放疗敏感性的关系。而循环肿瘤细胞(CTCs)是近年的热门研究方向,CTCs 是肿瘤转移的主要途径,可以反映肿瘤细胞在特定疾病阶段的异质性[21-22],本实验组希望通过CTCs 捕获联合原代肿瘤干细胞培养技术,研究FOXF1 基因与循环肿瘤细胞、肿瘤干细胞特性之间的关系,进一步阐明FOXF1 在肺癌发生发展过程中扮演的重要作用及相关机制。

