基于数据进行推理的化学深度学习案例分析
——以平衡原理知识教学为例
林建成
(南安市侨光中学,福建 泉州 362314)
一、问题的提出
深度学习相对于浅层次学习而言,是一种基于深度理解的学习方式,要求学习者能够对知识进行理解与批判、联系与建构、迁移与应用,从而对知识进行深层次加工与理解,实现问题分析解决能力和创造性思维等高阶思维能力的发展。[1]“证据推理”是化学学科核心素养的重要组成部分,是一种高阶思维形式,要求学习者“具有证据意识,能基于证据对物质组成、结构及其变化提出可能的假设,通过分析推理加以证实或证伪;建立观点、结论和证据之间的逻辑关系。”[2]要求教师在教学中要树立证据意识,通过收集、获取和整理证据,引导学生进行分析推理,强化学生的高阶思维训练,促使学习者对知识进行深层次加工和深度理解,从而达到深度学习的效果。“证据推理”中的“证据”是客观的、真实的,它可以是知识,也可以是数据。[3]学生通过查阅、收集数据(必要时教师提供数据),利用数据进行推理,更能强化学生的证据意识,发展学生的推理能力,培养学生的核心素养。
化学平衡知识往往需要通过深度理解才能把握知识的本质,才能运用有关原理知识进行分析解决问题,该部分知识是学生关键能力形成的重要载体。但学生在对平衡原理知识的学习和运用过程中存在知识理解不清或不够深入的学习盲点,而有的教师对学生存在的学习盲点没有引起足够的重视,未能提供相关证据引导学生进行推理,仅作浅层次的解释或让学生死记硬背,造成学生对原理知识的理解不清不深入,达不到深度学习效果,更谈不上运用原理知识分析解决问题。为有效解决学生的深度学习问题,笔者梳理了平衡原理中的若干学习盲点,试图让学生充分运用数据进行推理,引导学生主动探究,亲身体验学习的过程与方法,落实“证据推理”素养目标,有效实施素养为本教学。
二、设计思路
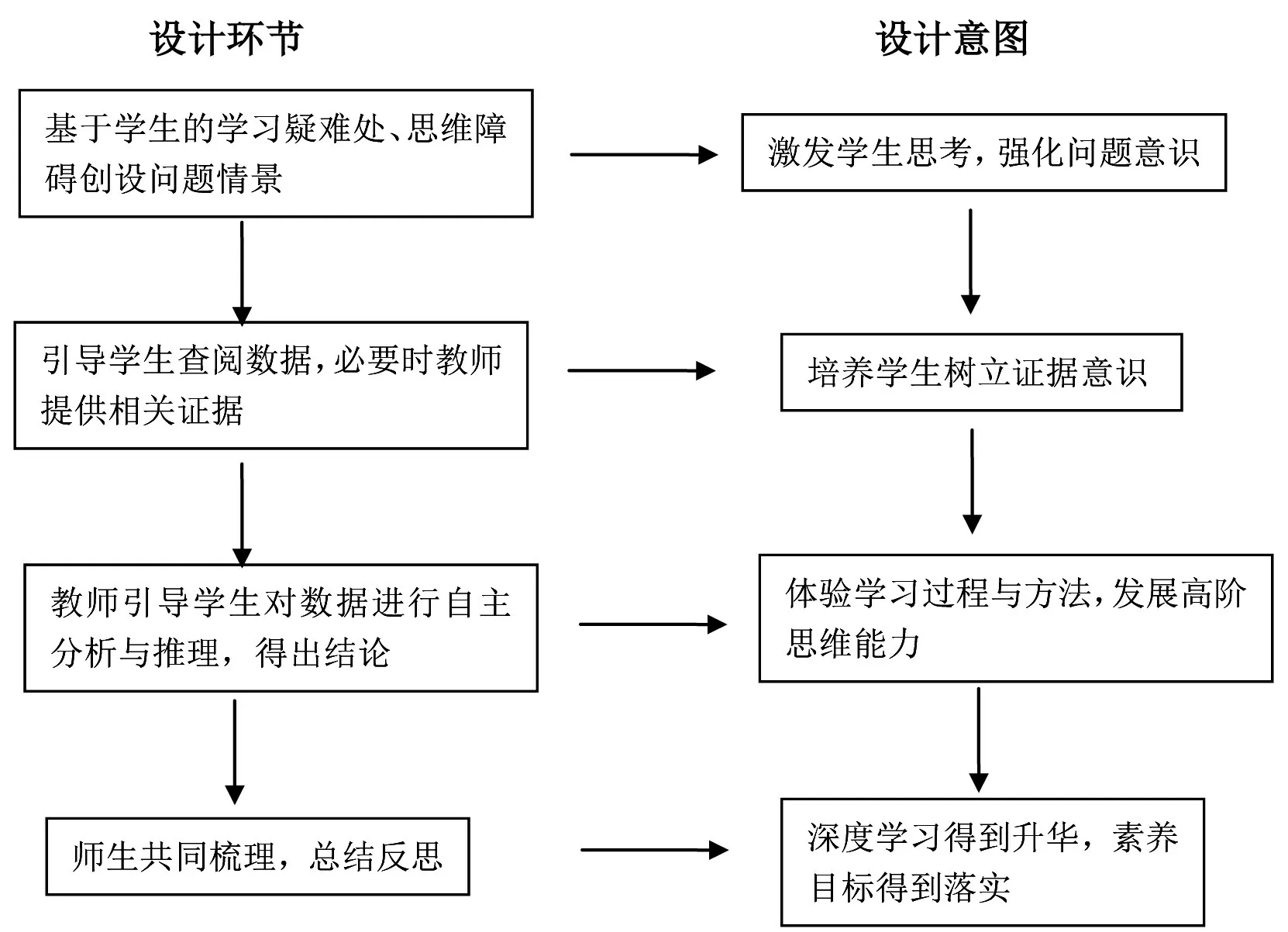
三、案例分析
1.多组分浓度变化对平衡移动影响
勒夏特列原理在解释平衡移动方向时仅适用于单一条件的变化,对多条件变化则无法解决,这也是学生学习的难点。为此,可通过设计相关计算题,让学生通过计算自主推理后认识到勒夏特列原理相对于平衡常数在解决平衡移动问题时具有局限性,对原理的把握更为清晰,理解更为透彻,对如何运用已有知识进行分析解决问题有更深刻的认识。教学基本环节如下:
(1)提出问题促思考
合成氨反应:N2(g)+3H2(g)⇌2NH3(g),在一定条件达到平衡时,当多个组分浓度同时发生变化时,如何判断平衡向哪个方向移动?
(2)设置例题重推理
[例1]某温度下恒压容器中发生反应:N2(g)+3H2(g)⇌2NH3(g),达到平衡时,容器体积为1L,N2、H2和NH3三种物质的量分别为1mol、3mol、2mol。若此时再向容器中充入2mol N2,该平衡将______。
A.向左移动 B.向右移动
C.不移动 D.无法确定移动方向
计算推理过程:
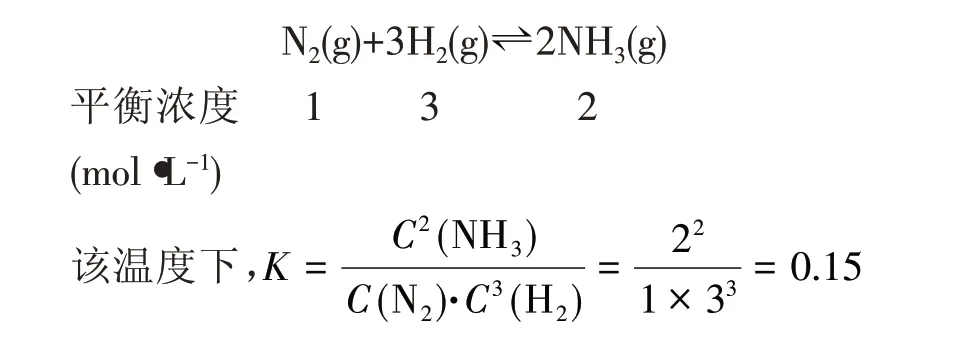
充入2mol N2后,因恒压条件,气体物质的量由6mol 变为8mol,则容器的体积由1L 变为4/3L,故各组分浓度分别改变为:
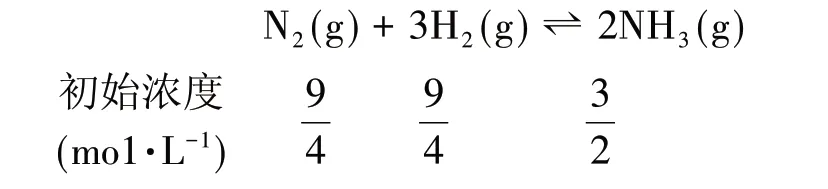
经计算,得出Q=0.09,Q<K,平衡向右移动。
(3)深化问题再思考
将上述例题略作改动,即:将“平衡后再向容器中充入2mol N2”改为“平衡后再向容器中充入54mol N2”,与上述情况对比,平衡方向会不会发生改变?
(4)再次推理获新知
推理过程:
若平衡后向容器中充入N2改为54mol,则气体物质的量由6mol 变为60mol,则容器的体积由1L 变为10L,故各组分浓度分别改变为:
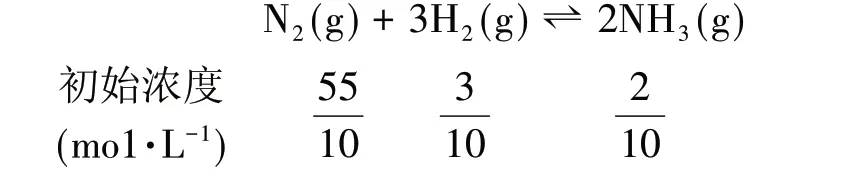
同样算出Q=0.29,Q>K,平衡向左移动。
学生通过前后自主推理后,深刻自主认识到当多个组分浓度同时发生变化,平衡移动方向要运用数据进行推理判断,而不能从主观进行简单臆测或判断,有力强化学生证据意识,发展学生推理能力,落实核心素养目标。
2.弱酸酸式盐溶液酸碱性判断
苏教版《化学反应原理(选修)》中对NaHCO3溶液酸碱性的分析以“问题解决”栏呈现,即“实验测得NaHCO3溶液的pH>7,请从电离和水解两方面分析导致NaHCO3溶液呈碱性的原因”。[4]教材从提供实验事实证据,然后启发引导学生从电离和水解两个方面进行定性分析,得出HCO3-的水解作用大于电离作用的结论。此时教师应抓住教学的最佳时机,让学生查阅HCO3-的电离平衡常数Ka并推算与HCO3-的水解平衡常数Kh,通过对Ka与Kh的大小比较,从定量上进一步深化学生对酸式盐溶液酸碱性的理解。此时,可让学生再通过查阅HSO3-的电离平衡常数和推算与HSO3-的水解平衡常数,判断HSO3-溶液的酸碱性。通过对比分析和推理,达到对弱酸酸式盐溶液呈酸碱性的深度理解。教学基本环节如下:
(1)深化问题促思考
实验测得NaHCO3溶液呈碱性,我们已从电离和水解两方面分析并找到原因。我们已经知道,电离程度和水解程度可以通过平衡常数来反映,大家能从平衡常数的角度来判断HCO3-的电离程度大还是水解程度大吗?(学生思考并交流讨论)
(2)查阅数据并计算
通过查阅,常温下H2CO3的平衡常数为:Ka1=4.3×10-7,Ka2=5.6×10-11,则Kh(HCO3-)=Kw/Ka1=2.3×10-8>Ka2(H2CO3)=5.6×10-11。
结论:NaHCO3溶液中HCO3-的水解作用大于电离作用。
(3)运用类推强认知
运用类似的方法类推常温下NaHSO3溶液的酸碱性,辩证认识弱酸酸式盐的酸碱性。
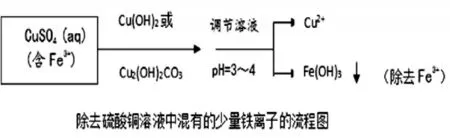
通过查阅,常温下H2SO3的平衡常数为:Ka1=1.54×10-2mol·L-1,Ka2=1.02×10-7mol·L-1,则Kh(HSO3-)=Kw/Ka1=6.5×10-13mol·L-1< 结论:NaHSO3溶液中HSO3-电离作用大于水解作用,溶液呈酸性。 (4)迁移推理缓冲液 运用推理判断弱酸酸式盐的方法,迁移到缓冲溶液酸碱性的判断,达到触类旁通的目的。 [例2]常温下,对比判断等物质的量浓度的CH3COONa 和CH3COOH 混合液与等物质的量浓度的NaCN 和HCN 混合液的酸碱性。 推算及结论:前者Kh(CH3COO-)=Kw/Ka(CH3COOH)=5.6×10-10 3.沉淀溶解平衡原理应用中的三个盲点 学习盲点一:BaSO4转化成BaCO3 苏教版《化学反应原理(选修)》对“沉淀溶解平衡原理的应用”以“将BaSO4转化成BaCO3,然后用盐酸溶解,即可得到含Ba2+的溶液”为例说明分析化学常将难溶性强酸盐转化为难溶性弱酸盐后,再用酸溶解得到可溶性金属盐溶液。转化原理如下:[4] 总反应的离子方程式为:BaSO4+CO32-=BaCO3+SO42- 上述转化虽能说明BaSO4向BaCO3的转化,但教材在这之前刚阐述“溶解能力较强的物质易转化为溶解能力相对较弱的物质”,对BaSO4和BaCO3而言,BaSO4更难溶,这个转化使学生对沉淀间的转化感到迷惑。此时,若能通过数据让学生自主推理,对此转化进行证实,学生对沉淀间的转化就有更深刻的理解。为此,设计教学环节如下: (1)设问激疑促进思考 [问题]BaSO4比BaCO3的溶解度小,往BaSO4中加饱和Na2CO3溶液,BaSO4能否转化成BaCO3,你能通过数据推理来证实吗?(学生思考并交流讨论) (2)设计例题分析解决 [例3]已知:室温下饱和Na2CO3溶液的浓度为1.9mol·L-1,Ksp(BaSO4)=1.1×10-10,Ksp(BaCO3)=2.6×10-9,往BaSO4沉淀中加入饱和Na2CO3溶液,通过计算说明能否实现BaSO4向BaCO3的转化? 通过学生自主进行简单的计算推理并得出结论,将学生的学习引向深度学习,培养学生分析解决问题的关键能力。 (3)深化问题深度理解 [问题]上述转化能否将大量的BaSO4转化成BaCO3?请进行解释。如果要将大量的BaSO4转化成BaCO3应采取什么样的措施。 学生通过思考分析,交流讨论,明确随着BaSO4向BaCO3的转化,SO42-浓度不断增大,且BaSO4比BaCO3更难溶,故只有部分BaSO4转化成BaCO3。明确了这一点以后,学生自然而然就想到了要实现大量BaSO4转化成BaCO3,就必须要减少SO42-浓度,为此也就理解了教材中“转化过程是用饱和Na2CO3溶液处理BaSO4沉淀,处理一段时间后,移走上层清液;再加入饱和Na2CO3溶液,重复处理多次,使绝大部分BaSO4转化为BaCO3”这一段话。 学习盲点二:除去硫酸铜溶液中少量的铁离子 教材中关于除去硫酸铜溶液中少量的铁离子呈现了以下流程:[4] 学生对这个流程图难以理解的是为什么pH=3~4 时能够除去Fe3+(即Fe3+沉淀完全)。为了让学生真正弄清在pH=3~4 的条件下,Cu2+还没沉淀而Fe3+已沉淀完全,对该知识难点设计环节如下: (1)设问激疑促进思考 [问题1]流程图中为什么pH=3~4 时,Cu2+没沉淀而Fe3+却沉淀完全?你能想到用什么方法来证实吗?(学生思考并交流讨论) (2)提供数据自主推理 [问题2]已知:室温下,饱和CuSO4溶液的浓度为1.4mol·L-1,Ksp[Cu(OH)2]=2.0×10-20,当pH=4 时,试通过计算判断能否形成Cu(OH)2沉淀? 计算结果:Qc=1.4×10-20 [问题3]通常情况下,当溶液中离子浓度小于1.0×10-5mol·L-1时表示已被沉淀完全。已知:室温下,Ksp[Fe(OH)3]=2.6×10-39,当pH=3 时,试通过计算判断Fe3+是否沉淀完全? 计算结果:pH=3 时,c(Fe3+)=2.6×10-6mol·L-1,表示Fe3+已沉淀完全。由此可知,当pH=4 时,Fe3+沉淀更为完全。 (3)总结提升提炼方法 [问题4]通过以上例子分析,请同学们思考,要分离或提纯多种难溶性氢氧化物或难溶性金属盐对应金属阳离子的混合液,可设计什么样的方法进行分离提纯?(可运用实例让学生总结提炼出方法) [例4](2015 年江苏,18 节选) 已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1 时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度均小于1×10-6mol·L-1),需调节溶液pH 范围为________。 学习盲点三:CO2通入CaCl2溶液为什么不会产生沉淀,而H2S 通入CuSO4却能产生沉淀 认为CO2通入CaCl2溶液会产生沉淀一直是很大一部分学生学习的误区,即使是到了高三还是有不少学生想当然认为会有沉淀生成。对于H2S 通入CuSO4能产生沉淀感到不理解的是弱酸与强酸盐反应可以得到强酸。为了彻底解决学生存在的这个知识盲点,运用数据引导学生自主进行推理可以让学生深度理解,并在头脑中留下深深的烙印。 (1)巧妙设问引导思考 从沉淀溶解平衡原理知识考虑,要形成CaCO3,溶液中的c(CO32-)与c(Ca2+)必须满足什么条件?同理,要形成CuS 沉淀溶液中的c(S2-)与c(Cu2+)必须满足什么条件? (2)运算推理进行判断 已知:常温下,饱和CaCl2溶液的浓度约为5mol·L-1,H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11,CaCO3的溶度积常数为:Ksp=4.96×10-9,(教师要启发引导学生推导饱和碳酸溶液中,c(CO32-)≈Ka2=5.6×10-11mol·L-1 [运算推理结果]c(Ca2+)·c(CO32-)=2.8×10-10<Ksp(CaCO3),故不能产生沉淀。 同理,让学生查阅或提供以下数据,让学生自主推理即可得出H2S 通入CuSO4能产生沉淀的结论。相关数据如下: 常温下,Ka1(H2S)=9.1×10-8,Ka2(H2S)=1.1×10-12,Ksp(CuS)=1.27×10-36,假设CuSO4溶液的浓度为1mol·L-1。 (3)两个反应对比后的思考 引导学生从电离平衡和沉淀溶解平衡两个因素综合分析上述两个反应,基于证据辩证认识反应的方向,深度理解上述两个反应。 素养教学背景下,充分运用数据引导学生进行推理,有利于促进学生的深度学习,有利于培养学生的推理能力,有利于发展学生思维,有利于落实化学学科核心素养目标。深度学习作为培养和发展学生高阶思维能力的重要学习方式,应引起一线教师的足够重视。要切实有效实施好基于数据进行推理的深度学习,教学中教师首先要树立证据意识,精心设计教学策略,引导学生获取数据、筛选数据、利用数据,并通过数据进行自主分析推理,在推理过程中不断强化证据意识和发展推理能力,从而达到深度理解、深度学习之效。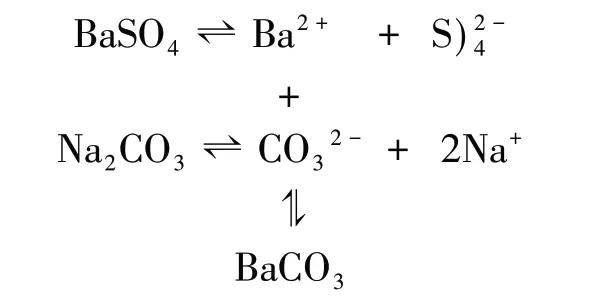
四、结束语

