回顾性分析不同病理类型肝脏恶性肿瘤超声造影表现
王 琴,王金萍,王佳佳,李保启
(安徽中医药大学第一附属医院 超声医学科,安徽 合肥 230031)
肝脏恶性肿瘤包括肝细胞性肝癌(hepatocellular carcinoma,HCC)、肝内胆管细胞癌(intrahepatic cholangiocarcinoma,ICC)及转移性肝癌(metastatic liver cancer,MLC)等[1]。HCC是发病率最高的肝脏恶性肿瘤,是全世界第二大最常见癌症死亡原因,导致每年约74.5万例患者死亡[2]。不同病理类型肝脏恶性肿瘤治疗方案和预后有所不同,因此,早期鉴别肝脏恶性肿瘤类型至关重要。以往研究[3,4]报道超声造影鉴别肝脏良恶性占位有较高敏感性、特异性及一定准确性,但对肝脏恶性肿瘤鉴别诊断报道较少。随着超声造影(contrast-enhanced ultrasound,CEUS)技术不断发展,诊断肝脏占位性病变能力明显提高。本研究通过回顾性分析经病理证实的肝脏恶性肿瘤超声造影表现,探讨早期CEUS在肝脏恶性肿瘤中的鉴别诊断价值。
1 资料与方法
1.1 研究对象
回顾性分析2015年12月~2019年11月入我院行超声造影并经超声引导下穿刺活检或手术病理证实为恶性的38例肝脏肿瘤患者资料,其中,男24例、女14例;年龄39~88岁,平均(64.76±11.54)岁;病变最大径范围为9~93 mm。所有患者均签署书面知情同意书。
1.2 仪器与方法
Siemens Acuson S2000和Acuson Oxana3彩超诊断仪,配备低机械指数、脉冲反向谐波成像技术。采用声诺维(SonoVue)作为造影剂。
所有患者均在造影前接受常规超声检查确定目标病变,检查均由两名主治以上医师配合进行,扫查时使病灶尽可能靠近探头(<10 cm),选择理想切面以清楚显示病变和周围部分肝实质,固定探头位置,切换成超声造影模式,图像以双屏幕格式进行对比成像。将SonoVue和5 mL 0.9%生理盐水混合震荡形成乳白色混悬液,抽取2.4 mL经三通管快速注入患者左侧肘静脉,随之推注5 mL生理盐水冲洗,再使用低机械指数进行实时动态造影,避免微泡破裂。注射SonoVue同时计时,连续录像,直至造影剂廓清;延迟期进行整个肝脏扫描,以筛选可能在造影前未发现的病变,并根据需要进行重复注射;实时、连续观察病灶灌注情况,并将造影动态图像存储于内置工作站。根据2013年更新的造影指南[5]时相划分:肝动脉相通常在注射造影剂后5~20 s内开始,并持续至30~40 s;门脉相通常在约41 s开始,并持续至注射后2 min;延迟相通常开始于注射造影剂后约2 min,并持续到微泡从肝实质中消退,约4~6 min,如需要可适当延长时间以评估延迟相消退情况。最后,分析病灶造影模式、开始增强时间、达峰时间及开始消退时间的变化。
1.3 统计学方法
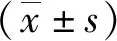
2 结果
(1) 本组中38例患者造影过程顺利,无人发生造影剂过敏反应及其他严重并发症,所有病灶经超声引导下穿刺活检或手术病理证实。
(2) 本组中肝脏恶性肿瘤造影几乎均呈“快进快出”灌注特征,动脉相早期呈高增强(图1),门脉相及延迟相造影剂快速消退,呈低增强或无增强(图2),造影模式见表1。
表1 38例不同病理类型肝脏恶性肿瘤超声造影模式
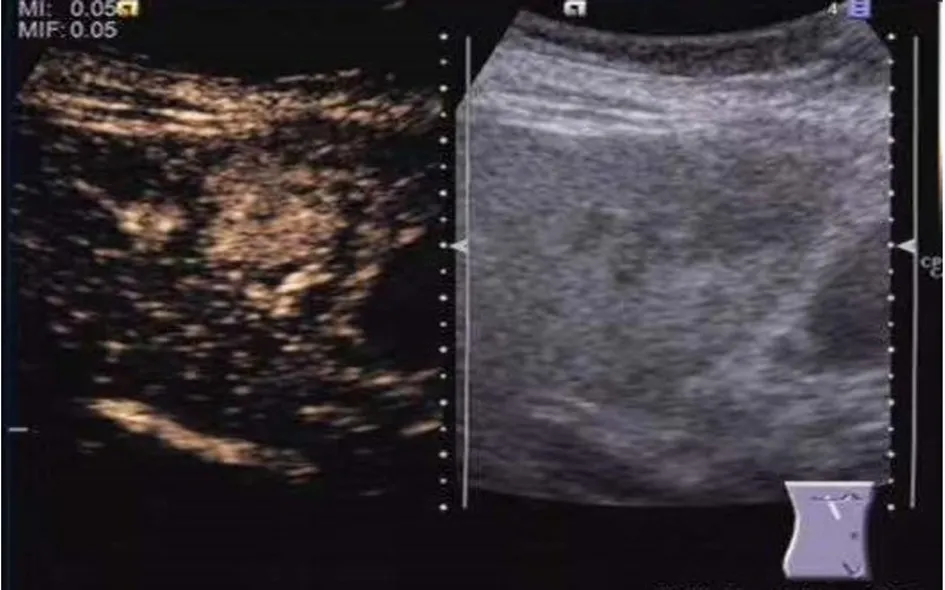
图1 肝细胞性肝癌动脉相呈快速均匀高增强
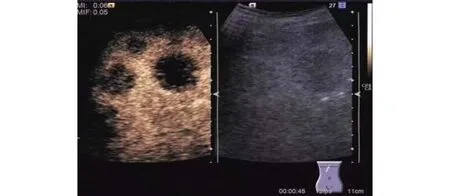
图2 转移性肝癌门脉相造影剂快速消退呈低增强或无增强,呈“黑洞”表现
(3) 本组中肝内胆管细胞癌开始增强时间、达峰时间及开始消退时间均快于肝细胞性肝癌,但慢于转移性肝癌,存在统计学差异(P<0.001),造影时间变化见表2。
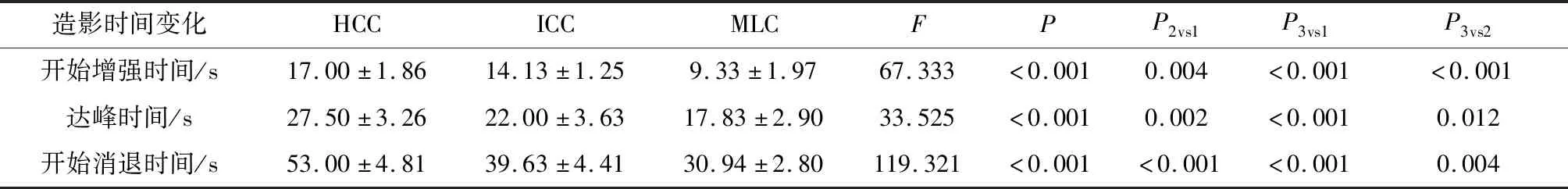
表2 38例不同病理类型肝脏恶性肿瘤超声造影时间变化
3 讨论
超声造影技术是一种具有高时间分辨率的成像技术[6],可全程实时动态观察肿瘤血管微循环并显示组织灌注信息[7],提高对肝脏恶性肿瘤定性诊断准确率;且超声造影剂的过敏性反应发生率约为1/10000[8],在批准剂量下无肾毒性、肝毒性及心脏毒性,近年来在临床应用越发广泛。
随着超声造影技术飞速发展,关于肝脏肿瘤造影的相关报道日益增多,但大部分报道[9,10]侧重于超声造影技术如何提高肝脏肿瘤检出率及评估其良恶性,而对不同类型肝脏肿瘤进行病理分型研究则相对较少。
本研究的38例肝脏恶性肿瘤均经超声引导下穿刺或手术病理结果证实,其中,肝细胞性肝癌 12例、胆管细胞癌8例、转移性肝癌18例。研究中发现,HCC动脉相早期呈整体高增强,门脉及延迟相多数快速消退呈低增强(11/12,91.7%),原因主要是正常肝实质由约75 %的门静脉和约25%的肝动脉双重供血[11],而肝细胞性肝癌90%以上由肝动脉供应,肿瘤血管发育不全,动静脉短路多,动脉相呈“快进”表现,门脉及延迟期相对于正常肝实质造影剂早期廓清[12],呈“快出”表现。1例HCC(1/12,8.3%)门脉和延迟相造影剂消退均不明显,呈等增强,本组将其误诊为炎性病变,经穿刺病理结果为高分化HCC,原因可能是高分化HCC除有肝动脉供血外,还接受门静脉供血,动脉相高增强,门脉相病灶持续接受门静脉灌注,增强区域消退延迟或无消退,即所谓的“快进慢出”,此结果与国内外相关报道[13,14]基本一致。
本研究中ICC大多动脉相呈不均匀高增强(6/8,75.0%),其中4例呈边缘环状增强,中央大部分见无增强区域,并可见“轮辐状”高增强向病灶中央延伸,呈“辐轮征”,门脉及延迟相呈不均匀等增强或低增强,原因主要遵循其病理基础,ICC病理显示病灶周边癌细胞多,血供丰富,而病灶中央以纤维结缔组织为主,供血血管较少,“轮辐征”可能是由于该肿瘤常沿胆管走行,并可能与癌细胞中黏液成分相关,上述特征与Wildner等[15]报道的结果一致。从增强模式上比较,ICC与HCC动脉相均呈高增强,但HCC极少显示边缘增强,ICC与MLC均存在环状增强,但ICC有特征性“轮辐征”表现;从增强时间上比较,ICC开始增强时间、达峰时间及开始消退时间均快于HCC,但慢于MLC,存在统计学差异,这与Yue等[16]报道基本一致;从病史上比较,肝硬化和慢性乙型肝炎是HCC的高风险因素[17],但肝硬化中ICC少见,而MLC通常有明确原发灶。
本组中MLC造影时,一种,表现为动脉相呈不均匀高增强(44.4%),部分病灶边缘见“厚圈样”增强,中央呈无增强区域,原发灶常位于胃、肺、结肠等;另一种,表现为动脉相呈整体均匀高增强(55.6%);随后造影剂均快速消退为低增强或无增强,呈“黑洞”表现。存在两种不同造影模式可能与原发灶类型及级别不同有关,这与Kong等研究结果一致[18],原发灶来自胃肠道恶性肿瘤、胰腺癌、肺癌、卵巢癌,部分乳腺癌的转移性肝癌大多属于乏血管病灶,而来自神经内分泌系统恶性肿瘤、黑色素瘤、肾癌及甲状腺癌的转移性肝癌通常病灶血流较丰富。
4 结论
本研究发现多数不同类型肝脏恶性肿瘤存在一定的自身造影特征,在不同病理类型肝脏恶性肿瘤鉴别诊断中有重要价值。但本研究有不足之处,因是小样本研究,部分问题仍需增大样本量继续探讨,同时,由于肝脏肿瘤病理结构复杂,对一些不典型病例仍需进行穿刺活检,提高诊断的准确性。

