工业丝状真菌土曲霉合成生物技术研究进展及展望
黄雪年,唐慎,吕雪峰
(中国科学院青岛生物能源与过程研究所,山东省合成生物学重点实验室,中国科学院生物燃料重点实验室,山东 青岛266101)
自然界微生物丰富的种质资源、代谢途径及其调控机制的多样性,结合合成生物学使能技术的快速发展,构成了从研发优质微生物底盘细胞到高效微生物细胞工厂及终端目标产品的微生物合成生物技术领域。丝状真菌作为一类重要的微生物,在食品、医药、化工等国计民生的领域发挥了重要的作用,而丝状真菌合成生物技术的发展已经展示了更大的工业应用潜力。
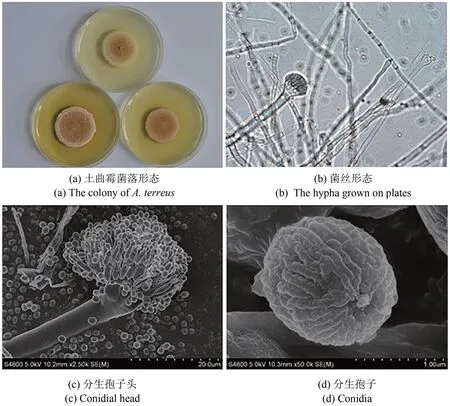
图1 土曲霉的各种形态Fig.1 The morphologies of A.terreus
土曲霉是一种环境中常见的丝状真菌,具有土褐色致密直柱形分生孢子头、密集的产孢细胞和很小的分生孢子(图1),它的无性孢子(分生孢子)的萌发温度范围较宽(11~48 ℃),而且能够耐受高渗透压,可以广泛分布于各种生境中。像其他曲霉一样,土曲霉最初也被认为是严格的无性生殖,通过产生无性孢子进行传播繁殖,直到2013 年才首次观察到它可以进行有性繁殖[1]。由于土曲霉并非传统食品发酵使用真菌,所以不如米曲霉、黑曲霉和红曲霉等食品安全使用微生物那样为大众所知。但事实上,土曲霉已经在生物化工和医药领域展现出了非常大的应用价值,是生物基化学品衣康酸和降血脂药物洛伐他汀的工业生产菌,其产品年销售额高达几十亿美元。成功的生产应用也证明土曲霉在初级代谢产物和次级代谢产物合成方面都具有很强的能力,并展现出了非常突出的工业发酵性能,具有成为典型性丝状真菌底盘细胞应用于合成生物技术开发的价值。近年来,土曲霉在工业菌株改造与发酵工艺优化、生物合成机制解析等方面都引起了国内外学者的关注,使其合成生物技术研究方面取得显著进步。本文将对土曲霉的上述研究进展进行系统介绍,并对土曲霉合成生物技术研究的未来发展进行讨论。
1 土曲霉合成生物技术工具开发
与大肠杆菌和酿酒酵母等模式生物相比,丝状真菌遗传改造技术仍不够系统且相对低效,可供选择的筛选标记、启动子和终止子等遗传改造元件也比较有限。目前只有少数常用的筛选标记被证实在土曲霉中可用,如潮霉素抗性基因hph、吡啶硫氨素抗性基因ptrA、博来霉素抗性基因ble和基于尿嘧啶营养缺陷型的筛选标记pyrG[2-3],还有一些在其他丝状真菌中有效的筛选标记仍有待验证[4]。
(1)启动子构巢曲霉的PgpdA启动子是研究较多的启动子,在丝状真菌中应用广泛,土曲霉最初遗传改造也是使用PgpdA启动子驱动目的基因表达[5]。此外,构巢曲霉PtrpC、PadhA和红曲霉Pmgpd等异源启动子也有被应用于土曲霉遗传改造中。Tet 诱导启动子系统具有较好的可控性,在黑曲霉中有很好的应用效果[6],Sun 等[7]通过用Tet 启动子系统替换土曲霉一个沉默NRPS-like 基因的启动子,成功诱导性激活了该基因。土曲霉糖化酶Gla1 的启动子是最早被使用的土曲霉内源启动子,1999 年Villanueva等[8]用该启动子在土曲霉中异源表达轮状病毒核衣壳蛋白VP6,但未能检测到目的蛋白,可能是目的基因密码子不匹配,也可能是由于土曲霉糖化酶系本就不发达,启动子活性太弱。本文作者研究组为了更好地对土曲霉工业菌株进行代谢工程改造,对土曲霉内源基因3-磷酸甘油醛脱氢酶基因gpdAt和柠檬酸合酶基因citA的启动子进行了系统的比较表征,获得了简短且高效的启动子元件,最短的仅262 bp,克服了很多常用丝状真菌启动子过长(约2 kb)不利于操作的缺点[9-10]。此外,还参照转录组信息,将基因 ATEG_02809、 ATEG_03846、 ATEG_09960(lovA)、 ATEG_09961 (lovB)、 ATEG_09964(lovD)的启动子应用于产洛伐他汀土曲霉工业菌株改造(未发表数据)。
(2)同源重组丝状真菌一个非常显著的特点是DNA 双链断裂修复过程主要是依靠非同源末端连接途径(non-homologous DNA end joining, NHEJ) 和同源重组修复途径(homology recombination, HR),这使得在丝状真菌中外源DNA 主要是通过随机插入的方式整合到基因组上,同源重组整合效率非常低。其优点是当只需要表达某个目的基因时,可与筛选标记共转化,得到表达元件整合位点和拷贝数都有差异的转化子库,这些不确定性有利于筛选到性能更好的转化子。其缺点也很明显,依赖基因打靶的一些遗传改造策略执行难度大,如基因敲除、基因定点表达、同源基因或突变体体内比较分析、启动子替换等。研究人员在丝状真菌模式生物粗糙脉孢菌中发现通过失活NHEJ 途径可以显著提高外源基因的同源重组效率,从而解决基因打靶效率低的问题[11]。这一技术很快被推广应用,极大地促进了丝状真菌的遗传改造研究。本文作者研究组[12]在土曲霉工业菌株中通过敲除ku80基因阻断NHEJ 途径,成功将基因打靶效率从不到5%提高到90%以上,随后进一步敲除pyrG基因获得了尿嘧啶营养缺陷型底盘细胞,并建立了基于pyrGAn的双向筛选遗传转化体系。最后结合改良后的Cre/loxP位点特异性重组系统对pyrGAn筛选标记进行快速切除,实现筛选标记的循环使用,解决了筛选标记不足的问题[12-13]。利用这个遗传操作平台可以对土曲霉进行多基因、多位点、多策略的遗传改造。
(3)基因编辑基于细菌和古细菌免疫机制开发的CRISPR/Cas9 基因编辑技术,因其简单、高效备受瞩目,广泛应用于各类生物细胞的遗传改造研究中。由于缺乏质粒和可靠的强启动子元件等,CRISPR/Cas9 技术在丝状真菌中的应用进度相对滞后。近几年经过改良后也被成功地应用在越来越多的丝状真菌中[14-15],包括粗糙脉菌[16]、里氏木霉[17]、米曲霉[18]、黑曲霉[19-20]和玉蜀黍黑粉菌[21]等。田朝光课题组[22]在产纤维素酶嗜热毁丝霉中利用CRISPR/Cas9 技术实现了多个基因的同时敲除,显示出了该技术在丝状真菌基因编辑中的优势和应用前景。目前,还没有关于CRISPR/Cas9 技术在土曲霉中应用的报道。
2 降血脂药物洛伐他汀的土曲霉细胞工厂
高血脂是心血管疾病的重要诱因,控制血脂水平是预防继发心血管疾病的有效手段。他汀类药物能够通过抑制羟甲戊二酰辅酶A(HMGCoA)还原酶活性来降低胆固醇的体内合成,成为最主要的降血脂药物,占市场总额的80%以上。巨大的商业价值使得他汀类降血脂药物研发成为最成功、最著名的药物研发案例之一。洛伐他汀(lovastatin)是由土曲霉合成的一种聚酮类化合物,是首个被批准上市的他汀类降血脂药物(美国食品药品监督管理局FDA 于1987年批准),备受瞩目。
2.1 洛伐他汀的生物合成
洛伐他汀,又名monacolin K,最早于1979 年在红曲霉中被首次发现,随后Merck公司研究团队发现土曲霉也能合成洛伐他汀,且具有更高的产量,并最终成功应用于洛伐他汀的工业生产[23]。作为明星小分子,土曲霉的洛伐他汀合成基因簇于1999 年被首次鉴定,引起学术界的广泛关注[24]。通过一系列的反向遗传学和生物化学研究,洛伐他汀的生物合成途径被完全鉴定,整个合成途径受特异性转录激活因子LovE 的调控,碳骨架主要由两个还原型PKS(LovB 和LovF)参与合成(图2)。首先,LovB 在烯酰基还原酶LovC 的作用下合成dihydromonacolin L[25],然后在硫酯酶LovG 的作用下从LovB 的ACP 结构域上释放下来[26],接着在细胞色素P-450 酶LovA 的作用下发生羟基化和脱水作用生成monacolin L,随后LovA继续催化C8 位发生羟基化生成母核monacolin J[27]。与此同时,另外一个PKS LovF 负责合成2-甲基丁酸侧链,在酰基转移酶LovD 的作用下转移至monacolin J 的C8 位羟基上生成终产物洛伐他汀[24,28]。
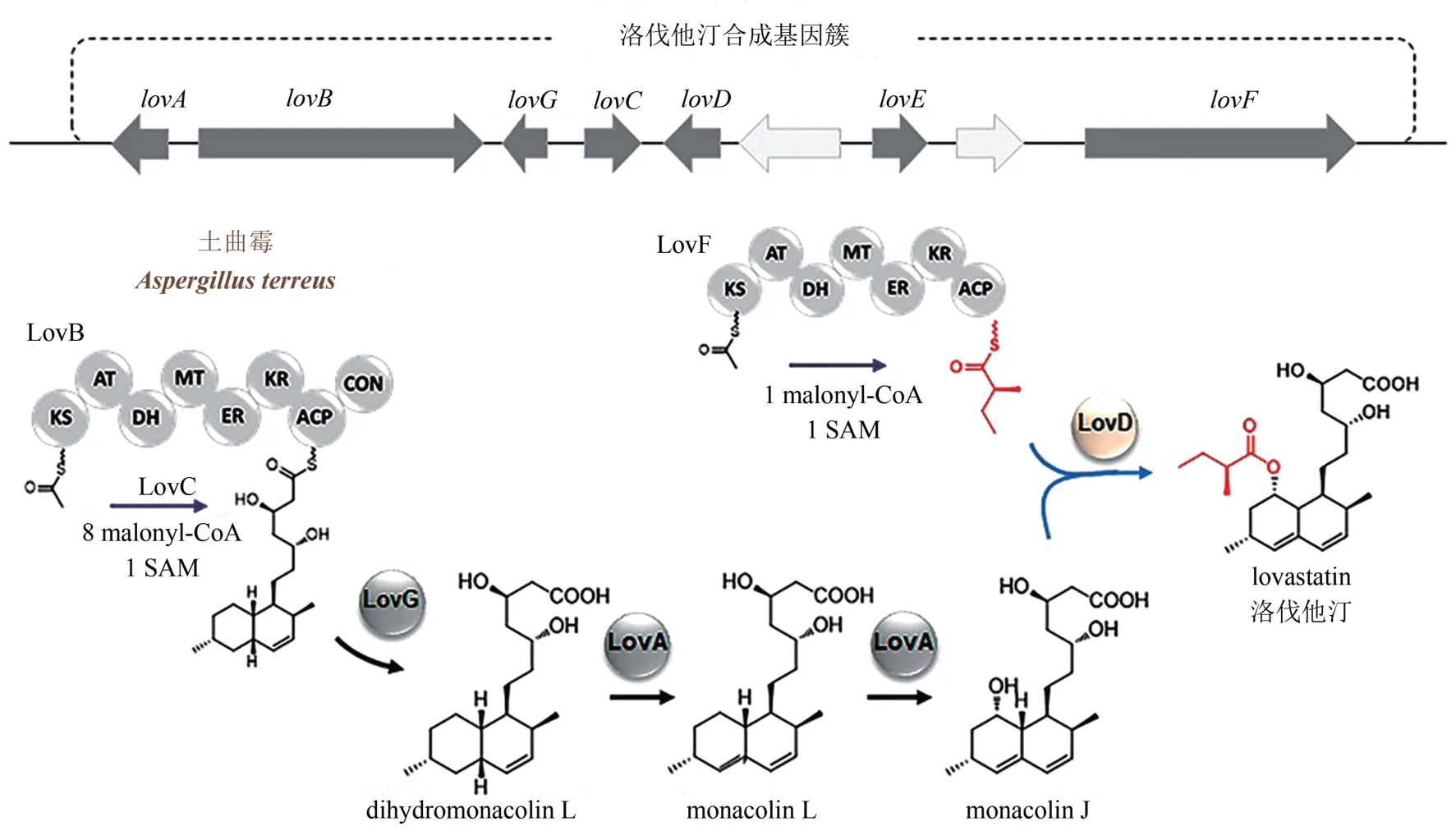
图2 土曲霉洛伐他汀生物合成途径Fig.2 Biosynthesis pathway of lovastain in A.terreus
洛伐他汀工业生产菌株主要是通过诱变育种方式筛选获得的,围绕生物合成途径的代谢工程改造的成功案例很少。LaeA 是一个来源于构巢曲霉的次级代谢产物合成全局性调控因子,在土曲霉ATCC20542 中过表达LaeA 将洛伐他汀产量提高了4~7 倍[29]。在土曲霉ATCC20542 中用组成型强启动子PadhA替换乙酰辅酶A 羧化酶ACCase的启动子,强化前体供应,但是效果并不显著,只将洛伐他汀产量从62.7mg/L 提高到88mg/L[30]。研究人员还发现敲除土曲霉ATCC20542 的甾醇调节元件结合蛋白(SREBP)和SREBP 分裂激活蛋白(ACAP)分别将洛伐他汀产量提高了2.6 倍和5.1 倍[31]。但是这些改造都是在普通低产菌株中进行的,洛伐他汀初始产量比工业菌株低了约两个数量级,目前还没有在高产菌株中成功改造的报道。
2.2 合成生物技术策略改进辛伐他汀生产工艺
1992 年,Merck 公司又基于洛伐他汀开发了药效更好的半合成衍生物辛伐他汀(simvastatin,Zocor),作为第二代他汀类药物,迅速成为全球畅销药物,专利期过后年销售额仍稳定达到30 亿美元。与洛伐他汀相比辛伐他汀只是在侧链上多了一个甲基,在工业上辛伐他汀是以洛伐他汀为原料通过多步化学反应合成的,其生产工艺大致可分为三个步骤。首先是土曲霉发酵生产洛伐他汀,然后通过碱水解洛伐他汀获得无侧链的monacolin J,最后通过化学方法重新加上新的侧链合成辛伐他汀。Tang 课题组基于土曲霉的酰基转移酶LovD 建立了一种从monacolin J 到辛伐他汀的生物催化方法,可替代原来的化学法,该成果获得2012 年美国总统绿色化学挑战奖的绿色合成路线奖[32-35]。至此,碱水解洛伐他汀生产monacolin J 成为唯一未被生物催化替代的工艺,该过程复杂繁琐、反应条件苛刻,而且需要使用大量的浓酸、浓碱和有机试剂,环境污染严重,因此开发一种绿色高效的monacolin J 生产工艺非常有必要。包括Merck 在内的研究团队也曾尝试开发生物转化方法,但是由于效率太低,都未能实现工业应用[36-39]。
基于构建的土曲霉遗传操作平台,本文作者研究组以洛伐他汀工业生产菌株为底盘细胞进行系统的代谢工程改造,构建了能直接发酵生产monacolin J 的土曲霉细胞工厂(图3)。首先,鉴定了一个具有自主知识产权的洛伐他汀水解酶PcEST,能够高效地水解洛伐他汀的2-甲基丁酸侧链生成monacolin J,催化效率达到国外专利酶的232 倍[40-41]。鉴于该酶的高效催化性能,利用内源启动子PgpdAt构建了水解酶PcEST 的真菌表达元件,并整合至洛伐他汀土曲霉工业生产菌株的基因组上,使PcEST 在土曲霉菌株中高效异源表达,成功将95%的洛伐他汀转化成monacolin J,获得了第一代生产monacolin J 的土曲霉细胞工厂,打通了技术路线(图3)[40]。
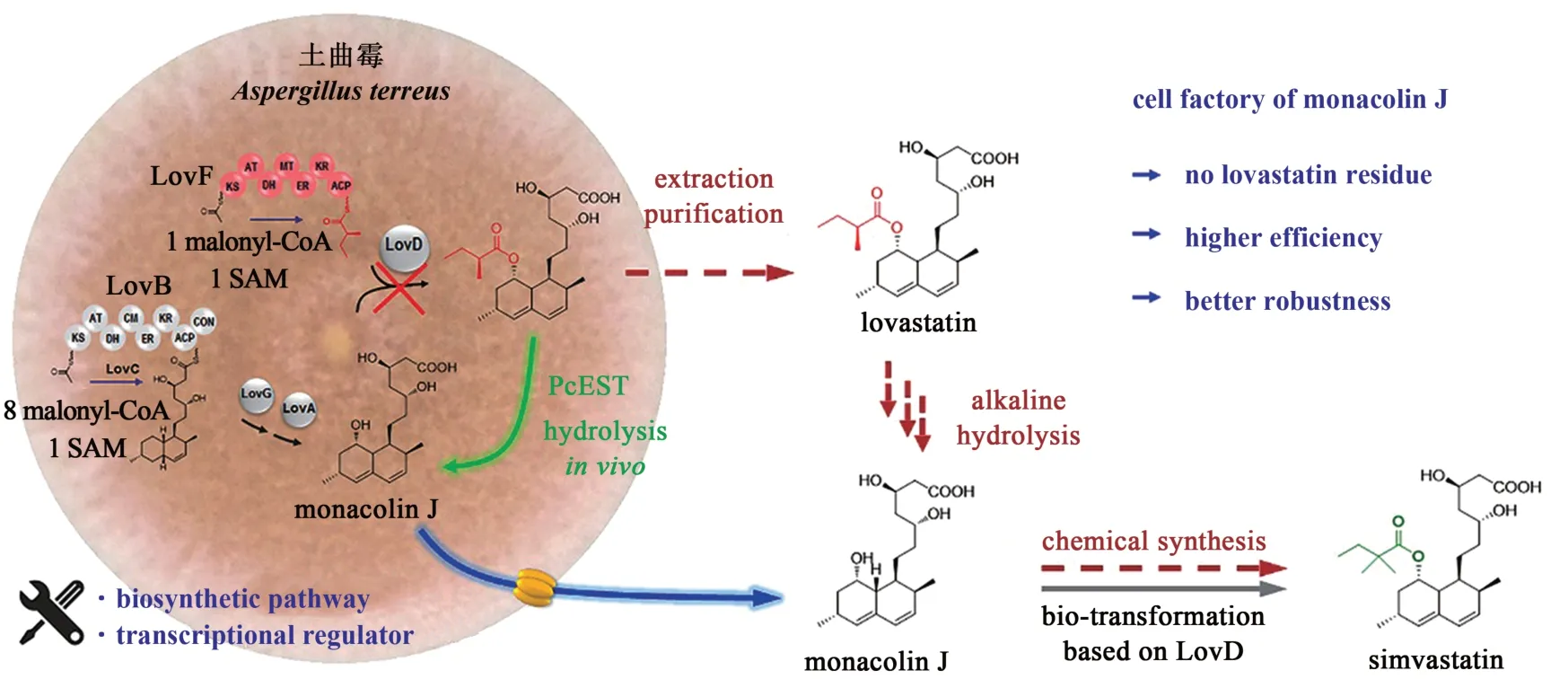
图3 生产辛伐他汀前体物monacolin J土曲霉细胞工厂的设计策略Fig.3 Construction of monacolin J-producing cell factory in A.terreus
在工业生产中洛伐他汀残留超过0.5%会增加分离纯化的难度,而第一代细胞工厂有5%的残留,会增加企业生产成本。研究组开发了水解酶PcEST 高通量筛选方法,采用定向进化技术获得了高效的水解酶PcEST 突变体,结合启动子优化构建了第二代细胞工厂,在实验室条件下成功将残留控制在0.5%以下,但是发酵条件变化对水解效率影响较大,稳定性不足并不适合大规模的工业生产[42]。随后,研究组通过基因组重测序对工业菌株的生物合成途径和遗传背景进行了分析,利用建立的高效遗传操作平台克服工业菌株遗传背景复杂等困难,实现了负责侧链合成的PKS 基因lovF的完全敲除,成功阻断了洛伐他汀合成的最后一步反应,实现了monacolin J 的高效积累,获得了完全无洛伐他汀残留的第三代土曲霉细胞工厂[43]。
真菌次级代谢产物的合成受环境因素的影响很大,这些外部因素在细胞内通过全局调控和特异性调控最终影响到整个合成途径。会使得在工业生产过程中批次间波动很大,增加工艺控制难度,这一现象同样存在于土曲霉发酵生产洛伐他汀的工业生产过程中。研究组在第三代产monacolin J 细胞工厂的基础上,以土曲霉内源组成型强启动子PgpdAt过表达基因簇特异性转录调控因子lovE和构巢曲霉laeA,其中过表达laeA未能提高monacolin J 的产量。而过表达lovE显著加强lovE的转录并维持在较高水平,将monacolin J 产量从 10.73mmol/L 提高到了16.36mmol/L,提高了52.5%。此外,还发现第三代菌株和过表达laeA菌株的monacolin J 产量受培养基影响很大,在两种不同培养基中的产量相差约30%,而过表达lovE的菌株在两种不同培养基中发酵合成的monacolin J 差异很小,这说明用组成型强启动子过表达lovE有助于维持合成途径的通量保持稳定,从而提高菌株的发酵鲁棒性,对发酵环境变化有更好的适应能力[43]。这项工作证明转录水平的改造是一种很有效的合成生物学改造策略,不仅能提高目标化合物的产量,还可以提高菌株的发酵鲁棒性。这种改造策略在生产次级代谢产物的丝状真菌工业菌株中应用较少,而该研究是一个可供参考的成功案例。
3 生物基化学品衣康酸的土曲霉细胞工厂
衣康酸是由土曲霉发酵产生的一种不饱和二元有机酸,分子内部含有一个活泼的双键和两个羧基,双键和羧基呈共轭关系,使得衣康酸的性质非常活泼,既可以自身聚合也能与其他单体发生聚合反应,因此广泛应用于化学合成工业,例如合成树脂、塑料、合成纤维和制药领域等,应用前景广阔[44]。目前衣康酸的全球需求量约为4~6 万吨/年,年销售额近10 亿元/年,并保持逐年增长趋势,市场处于供不应求状态。基于衣康酸的应用前景,美国能源部已将其列为十二种最具价值的生物基平台化合物之一,引起广泛关注[45]。
3.1 衣康酸生物合成途径
土曲霉合成衣康酸很早就被发现和应用,但是直到2002 年发现顺乌头酸脱羧酶CadA 之后才确定它是通过顺乌头酸脱羧生成的,2008 年获得了CadA 的核苷酸序列,并通过体外酶活和酿酒酵母中异源表达确定了其活性[46]。2011 年,Li 等[47]通过比较转录组分析发现cadA的转录水平确实与衣康酸产量呈正相关,而且还发现毗邻的三个基因也表现出一致的变化趋势,包括一个线粒体三羧酸转运蛋白编码基因mttA、一个MFS 超家族转运蛋白基因mfsA和一个转录调控因子,提示这三个基因可能也与衣康酸的合成相关,共同组成衣康酸合成基因簇。更有意思的是衣康酸基因簇与洛伐他汀基因簇相邻,在发酵工艺研究中也初步发现两者的合成具有相关性,但是尚未被更系统的研究证实[48]。
基于前期的生物化学分析和近期的组学研究结果,提出了生物合成途径的模型(图4)。葡萄糖经糖酵解途径后进行三羧酸循环生成柠檬酸,乌头酸酶催化柠檬酸合成顺乌头酸,顺乌头酸在线粒体三羧酸转运蛋白MttA 的作用下转运到细胞质中,然后由定位于细胞质的顺乌头酸脱羧酶CadA 催化脱羧生成衣康酸,最后经MFS 转运蛋白MfsA 分泌至细胞外[47,49]。另外,柠檬酸也可能通过MttA 转运到细胞质中,然后由细胞质乌头酸酶催化生成顺乌头酸,继而合成衣康酸。虽然整个合成过程非常简单,仅在TCA 循环的基础上多了一步由CadA 催化的脱羧反应就能合成衣康酸,但是关于其合成的调控机制尚未研究。土曲霉工业菌株的衣康酸发酵产量可达到80g/L,糖酸转化率高于60%。而三羧酸循环是高效的物质与能量转换的核心环节,顺乌头酸只是乌头酸酶催化柠檬酸合成异柠檬酸反应过程中的一个中间体,绝大部分生物中只存在极少量顺乌头酸,因此只有在特殊机制作用下土曲霉才能实现衣康酸的高效积累。
3.2 衣康酸菌株代谢工程改造
土曲霉液体深层发酵生产衣康酸最早由辉瑞公司于1955 年实现工业化应用,近20 年随着我国生物技术产业水平的快速发展,衣康酸发酵产业基本转移到了我国。较高的成本(2 美元/千克)仍然是限制其下游应用领域拓展的主要因素。虽然在工业生产过程中,通过菌株诱变和发酵工艺优化已经将产量提高到了80g/L,但之后近40 年菌株性能没能再进一步提高。随着真菌遗传改造技术的进步,菌株的理性改造被寄予厚望(图5)。6-磷酸果糖激酶(PfkA)是糖酵解途径中的关键限速酶,受下游产物柠檬酸和能量物质ATP 的反馈抑制,为了解除通过PfkA 靶点对糖酵解的反馈抑制,研究人员通过定点突变破坏磷酸化位点和删除抑制物结合区域的方式获得活性更高且不受柠檬酸反馈抑制的PfkA 突变体mtPfkA[50]。随后,将该突变体酶引入产衣康酸土曲霉菌株中进行异源表达,加快糖酵解途径的通量,把衣康酸的产量从15g/L提高至30g/L,发酵周期由150h 缩短为100h,效果显著[5]。但是该策略在工业菌株中应用时并没有效果,可能是工业菌株产量已经远高于30g/L,糖酵解通量已经很高,并非限速环节[51]。
增强菌株的逆境抵抗力是合成生物技术研究的重要策略,有利于提高菌株的发酵强度。工业生产时发现发酵过程中搅拌和通气的连续性非常重要,中断5min 就会延滞衣康酸的合成并显著影响最终产量,说明在发酵过程中呼吸作用非常活跃且很重要,溶氧不足会打破平衡改变代谢流。为了提高菌株抵抗缺氧逆境的能力,Lin 等[52]通过在土曲霉中过表达透明颤菌血红蛋白,把衣康酸的发酵产量由40g/L 提高到46.8g/L。但在工业菌株中过表达透明颤菌血红蛋白在正常的衣康酸发酵条件下未能提高产量,只在供氧不足条件下有小幅的改善[9]。另外,在土曲霉发酵产衣康酸过程中,快速将大量葡萄糖转化成衣康酸,高强度呼吸作用会产生氧自由基, 影响细胞活性, 交替氧化酶(alternative oxidase,AOX)是线粒体呼吸链中交替呼吸途径的末端氧化酶,研究表明它不仅有助于去除氧自由基还有助于提高细胞抗逆性[53]。研究人员在产衣康酸土曲霉工业菌株中过表达土曲霉内源和来自黑曲霉的异源aoX1基因,衣康酸合成能力不但没有提高,反而显著下降(本文作者课题组未发表结果)。这一结果说明过表达的AOX 确实在土曲霉中行使了功能,但是由于衣康酸积累机制较复杂,该改造策略整体而言并不有益于衣康酸的积累。可能是衣康酸积累机制和能量平衡有关,因为交替呼吸途径会将正常的电子传递和能量合成过程进行解离,从而改变细胞能量状态,影响衣康酸的高效积累。
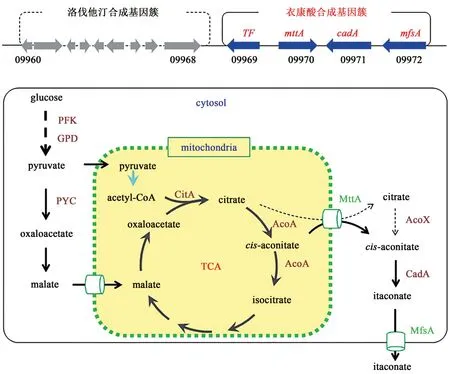
图4 土曲霉的衣康酸生物合成途径Fig.4 The biosynthesis pathway of itaconic acid in A.terreus
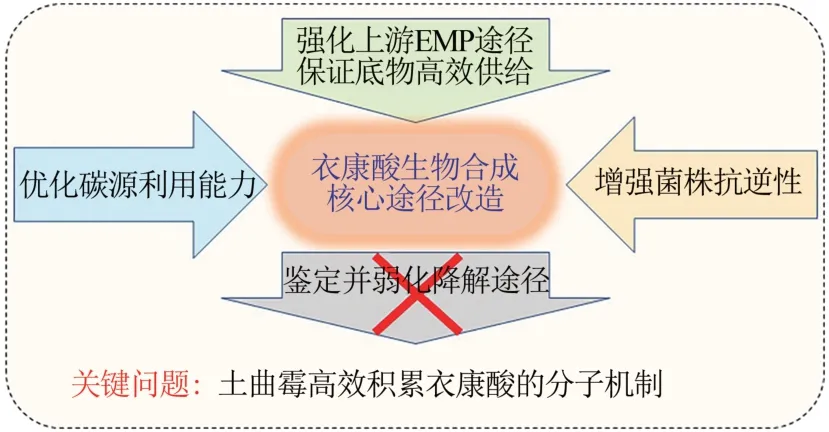
图5 产衣康酸土曲霉菌株改造策略Fig.5 Metabolic engineering of the itaconic acid-producing A.terreus
基于生物合成途径的解析,本研究组在工业生产菌株中对衣康酸合成途径进行了系统的代谢工程改造[51]。用强启动子PgpdAt对衣康酸合成途径中的关键酶(顺乌头酸脱羧酶CadA、柠檬酸合酶CitA、乌头酸酶AcoA、丙酮酸羧化酶PYC、三磷酸甘油醛脱氢酶GPD 和黑曲霉6-磷酸果糖激酶突变体mtPfkA)、转运蛋白(线粒体三羧酸转运蛋白MttA、衣康酸分泌蛋白MfsA)和调控因子(ATEG_09969、ATEG_01954)进行过表达。其中过表达顺乌头酸脱羧酶CadA 将衣康酸产量从80.5g/L 提高到88.1g/L,提高了9.4%,并且在生产中显著缩短了发酵时间。MfsA 被推测是负责将衣康酸分泌至细胞外的转运蛋白,过表达MfsA 将衣康酸产量提高了5%,这显示MfsA 确实与衣康酸分泌有关。但是过表达其他基因并没有达到提高产量的效果。
除了合成途径改造之外,研究人员还关注了衣康酸降解途径。研究过程中发现土曲霉能够利用衣康酸作为唯一碳源进行生长,这说明土曲霉中存在降解衣康酸的途径。通过转录组和体外酶活分析,发现衣康酸可以在衣康酰-CoA转移酶AtIct、衣康酰-CoA 水合酶AtIch 和柠苹酰-CoA 裂解酶AtCcl 的作用下转化成丙酮酸和乙酰-CoA,重新回到中心碳循环中[54]。在工业菌株中分别敲除这三个基因,基因缺失菌株的细胞提取物确实不再能降解衣康酸,但是在正常发酵条件下衣康酸产量无显著变化。可能是衣康酸发酵过程中葡萄糖供应充足,且该条件下有利于衣康酸的合成和积累,降解途径处于沉默状态,因此阻断降解途径无法提高衣康酸的最终产量。
此外,本文作者课题组通过对土曲霉菌株进行基因工程改造简化了衣康酸发酵工艺[10]。土曲霉的淀粉水解酶系不如黑曲霉发达,在工业上只能利用淀粉水解葡萄糖作为碳源进行发酵,而淀粉水解制糖需要经过淀粉酶处理、高温喷射液化和糖化酶水解糖化过程,增加了生产成本。用强启动子在土曲霉中异源表达来自黑曲霉的糖化酶gla1,并根据蛋白组数据进行信号肽优化,使土曲霉直接利用淀粉液化液发酵生产衣康酸的产量从约20g/L 提高到了67.6g/L。再结合发酵工艺优化,产量达到78.2g/L,接近利用葡萄糖作为碳源时的产量,省去了淀粉液化液的糖化过程。
除了天然生产菌株的改造,也有研究尝试通过合成生物技术用其他异源底盘细胞来生产衣康酸,包括柠檬酸生产菌株黑曲霉、解脂耶氏酵母、大肠杆菌等[55-56]。但是合成能力仍远低于土曲霉,围绕土曲霉工业菌株的代谢工程改造仍然是重要关注点。目前土曲霉的改造虽然有一定效果但并未取得重大突破,其原因是关键的衣康酸积累机制尚不清楚。因此,解析积累机制并进行针对性的改造仍值得期待,多个层面的机制均有可能。在酶学层面,通常乌头酸酶催化柠檬酸转化成异柠檬酸的过程中很少释放并积累顺乌头酸,土曲霉乌头酸酶可能具有特殊的酶学特性使其与其他物种不同,可以积累顺乌头酸进而合成衣康酸。在化合物反馈抑制层面,有研究显示衣康酸能够抑制异柠檬酸裂合酶活性,因此衣康酸的合成可以进一步抑制异柠檬酸经TCA 的消耗,从而积累顺乌头酸合成衣康酸。另外,土曲霉合成衣康酸时需要限氮少磷的条件,提示可能存在物质合成与能量/还原力平衡调控。
4 土曲霉次级代谢产物生物合成研究
丝状真菌具有很好的次级代谢产物合成潜力,产生了许多与人类生活密切相关的重要次级代谢产物,如青霉素、他汀类降血脂药物、免疫抑制剂环孢霉素以及食品色素等。这些化合物的生物合成主要是由核心酶负责合成基本骨架,然后在修饰酶的辅助下合成更具结构多样性的终产物,这些相关基因通常会在基因组上形成一个特异性的生物合成基因簇。根据核心基因的不同,次级代谢产物通常可分为聚酮合酶(polyketide synthase,PKS)合成的聚酮类、非核糖体肽合成酶(non ribosomal peptide synthetase,NRPS)合成的非核糖体肽类、萜烯环化酶(terpene cyclase,TC)合成的萜类和二甲烯丙基色氨酸合成酶 (dimethylallyl tryptophan synthase,DMATS)合成的吲哚类等。近年来,组学研究发现丝状真菌合成次级代谢产物的潜力被严重低估,次级代谢产物合成基因簇数量远超预期,也远多于该物种中已发现的次级代谢产物的数量,在实验室基本培养条件下大部分基因簇都处于沉默状态。如何挖掘这些潜在的次级代谢产物资源成为新的关注点,也陆续开发了很多激活沉默基因簇策略,大致可以分为非特异性激活和特异性激活两类[57-60]。
非特异性激活包括单菌多次级代谢产物方法(one strain-many compounds,OSMAC)、表观遗传基因改造、化学表观遗传和全局调控因子调控等策略。OSMAC 是基于次级代谢产物生物合成受复杂的环境因素影响,通过优化发酵条件可以改变一些合成途径的转录水平从而获得不同的产物,常用的是优化培养基和培养条件,通过与放线菌共培养的方法也成功激活一些化合物的合成途径[61]。此外,基因的转录还会受到表观遗传的影响,组蛋白去乙酰化、甲基化和SUMO 化等表观遗传修饰会影响基因组局部区域是处于常染色质还是异染色质状态,异染色质状态下基因不会被转录或者转录不活跃[62]。一些生物合成基因簇就是因为位于异染色质区域从而处于沉默状态,敲除负责组蛋白去乙酰化的hdaA基因[63]、甲基化的cclA基因[64]或SUMO 化的sumO基因[65]都可以改变染色质的表观遗传修饰,从而会影响或激活一些次级代谢产物的合成。化学表观遗传策略则是通过在培养过程中添加相应的组蛋白修饰酶抑制剂来替代上述相关基因敲除,从而获得类似效果[62,66]。全局调控是真菌次级代谢产物调控的一个重要环节,LaeA 是研究最多的一个真菌次级代谢相关的全局调控因子,在曲霉中普遍存在,通过敲除或过表达laeA常被用于促进或激活某些次级代谢产物的合成[29,67-71]。
特异性激活策略包括核心基因启动子替换、特异性转录调控因子激活和基因簇异源重构等。次级代谢产物骨架通常是由核心基因负责合成,用可控强启动子替换核心基因的天然启动子是发掘新化合物的一个有效手段[7,72-73]。但是其缺陷也很明显,次级代谢产物的合成通常是需要很多酶或辅助蛋白共同参与的复杂过程,包括产物的释放、转运和后修饰等,只激活一个核心基因得到的只是一个中间体或者根本无法得到产物。特异性转录调控因子激活策略可以很好弥补这一不足,获得了很好的应用效果。真菌次级代谢产物合成基因簇内通常会有一个转录调控因子,可以特异性地调控其所在基因簇的转录,从而调控代谢产物的合成[74]。通过启动子替换或者过表达方式激活特异性转录调控因子,可以进一步激活整个基因簇,从而获得最终产物[75-77]。除此之外,将基因簇在模式底盘细胞中进行异源重构也是一种常用的基因簇挖掘研究策略[78],常用的底盘细胞包括大肠杆菌[79]、酿酒酵母[25]、链霉菌[80]和为丝状真菌开发的构巢曲霉[81]。异源重构策略对于没有特异性转录调控因子的基因簇尤为重要。它的缺点在于基因簇通常较大,很难准确预测各基因的相关性和作用顺序,目标基因数量多,操作难度大。
土曲霉作为洛伐他汀降血脂药物开发的成功案例,其出色的次级代谢产物合成能力很早就受到研究者的关注,发现了很多新颖的化合物(表1)。生物信息学分析也证实了土曲霉确实具有强大的次级代谢产物合成能力,有31 个PKS、17 个NRPS、19 个类NRPS 以及2 个PKS-NRPS 杂合酶。除了洛伐他汀之外,近年来还有不少土曲霉基因簇被成功鉴定,并发现了丝状真菌次级代谢产物合成新机制。但是,这些研究主要集中在PKS 和NRPS 类,萜类和吲哚类的研究还比较少。下文将对部分代表性研究工作进行介绍,包括化合物类型、生物合成途径和研究方法。
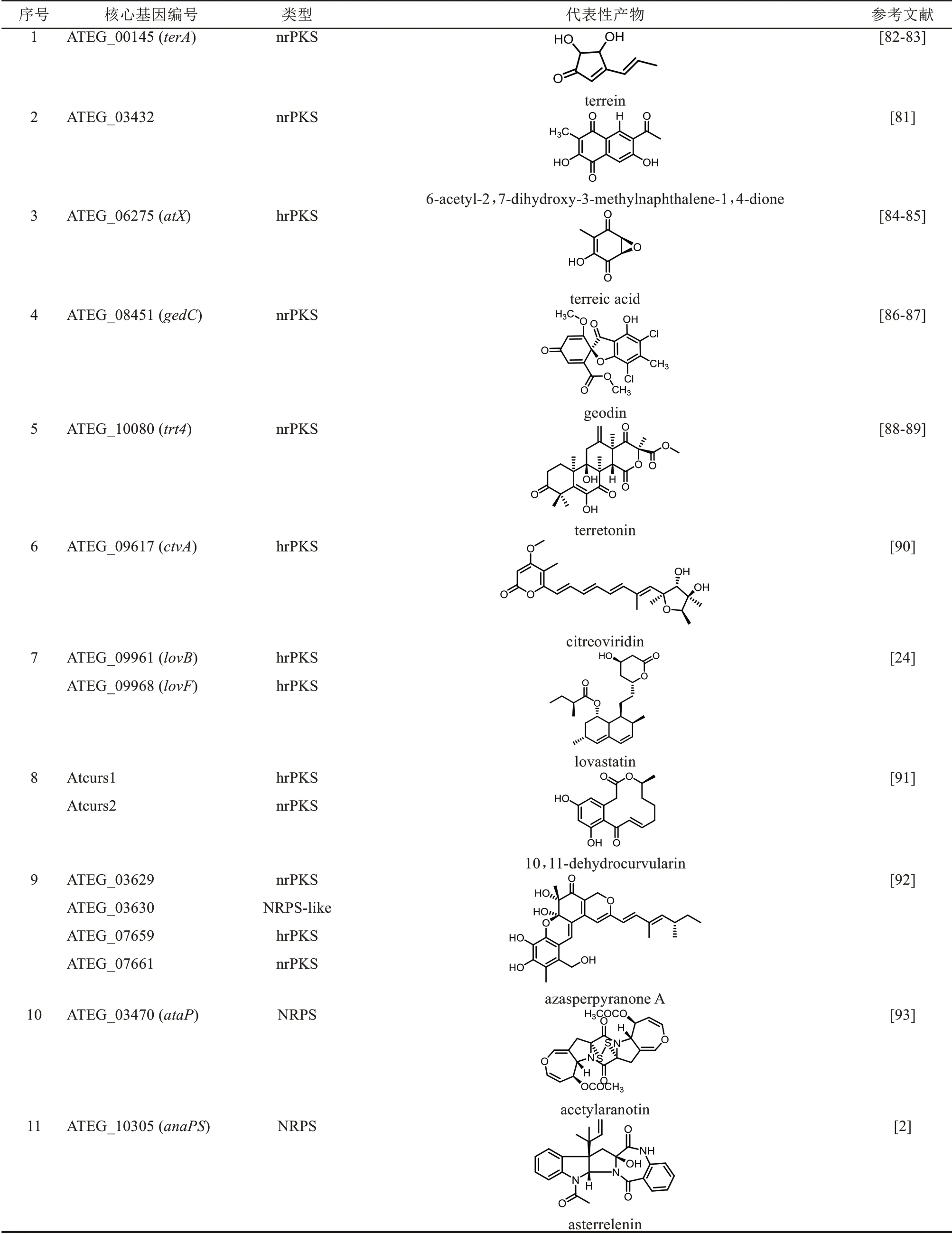
表1 土曲霉已被研究基因簇及其下游产物Tab.1 Biosynthetic gene clusters and products identified in A.terreus
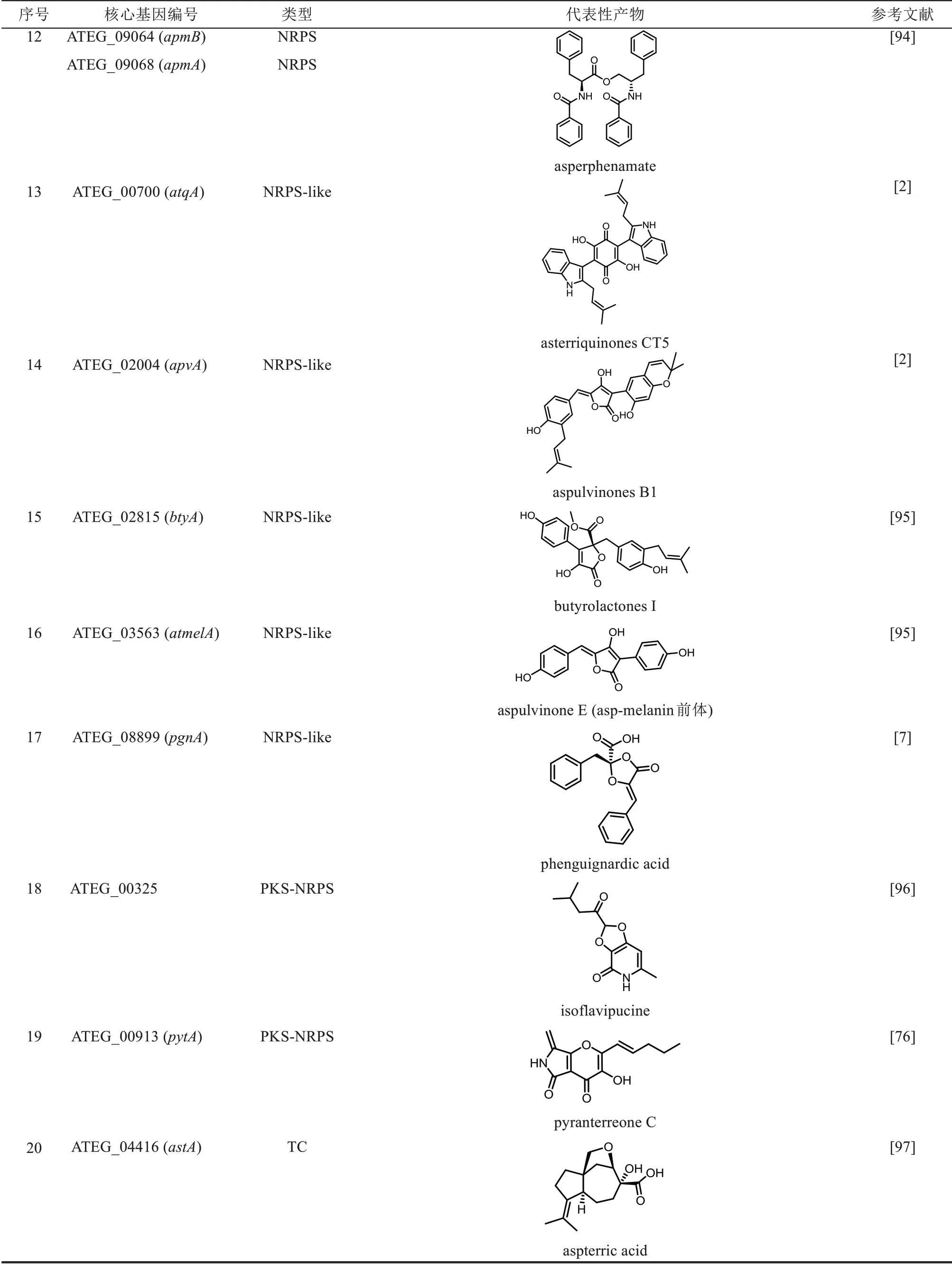
续表
4.1 聚酮类天然产物
聚酮是研究较多的一类次级代谢产物,土曲霉中共有31 个PKS 基因,其中13 个的产物已经被鉴定。 其中洛伐他汀基因簇和10, 11-dehydrocurvularin基因簇都分别含有2个PKS基因,azasperpyranones基因簇含有3个PKS。
4.1.1 土曲霉酮
土曲霉酮(+)-terrein是土曲霉中最主要的次级代谢产物之一,具有抗菌、抗癌、抑制植物生长等多种生物活性。土曲霉酮的结构于20 世纪50年代被鉴定,随后的生物合成途径研究证明了其来源于聚酮合成途径[98],是从一个6元环变到5元环[82],直到2014 年其生物合成基因簇和合成途径才被发现(图6)。Zaehle 等[83]在挖掘土曲霉黑色素合成基因簇时,发现敲除nrPKS 基因ATEG_00145(terA)使菌株失去了土曲霉酮合成能力。随后通过生物信息学和转录水平分析对其基因簇进行了预测,并进行了基因敲除验证,结合异源重构提出了其生物合成途径。TerA 以乙酰辅酶A作为起始单元、以丙二酰辅酶A 作为延伸单元,但它的产物链长控制并不严谨,会因延伸次数差异合成不同分子量的产物,当4个丙二酰辅酶A 延伸单元被利用时会合成 2, 3-dehydro-6-hydroxymellein,进一步被TerB 或其他酮还原酶还原为6-hydroxymellein,并最终在TerC、TerD、TerE 和TerF 的作用下形成终产物土曲霉酮。目前,具体在哪些酶作用下从6 元环中间产物变成变成5元环土曲霉酮尚不清楚,有待进一步解析。随后,该课题组还发现土曲霉酮生物合成至少受三种独立的环境因素诱导,甲硫氨酸、限氮和缺铁,这些环境因素通过全局调控因子AreA、AtfA 和HapX 将信号最终传递至生物合成基因簇,诱导土曲霉酮合成[99]。
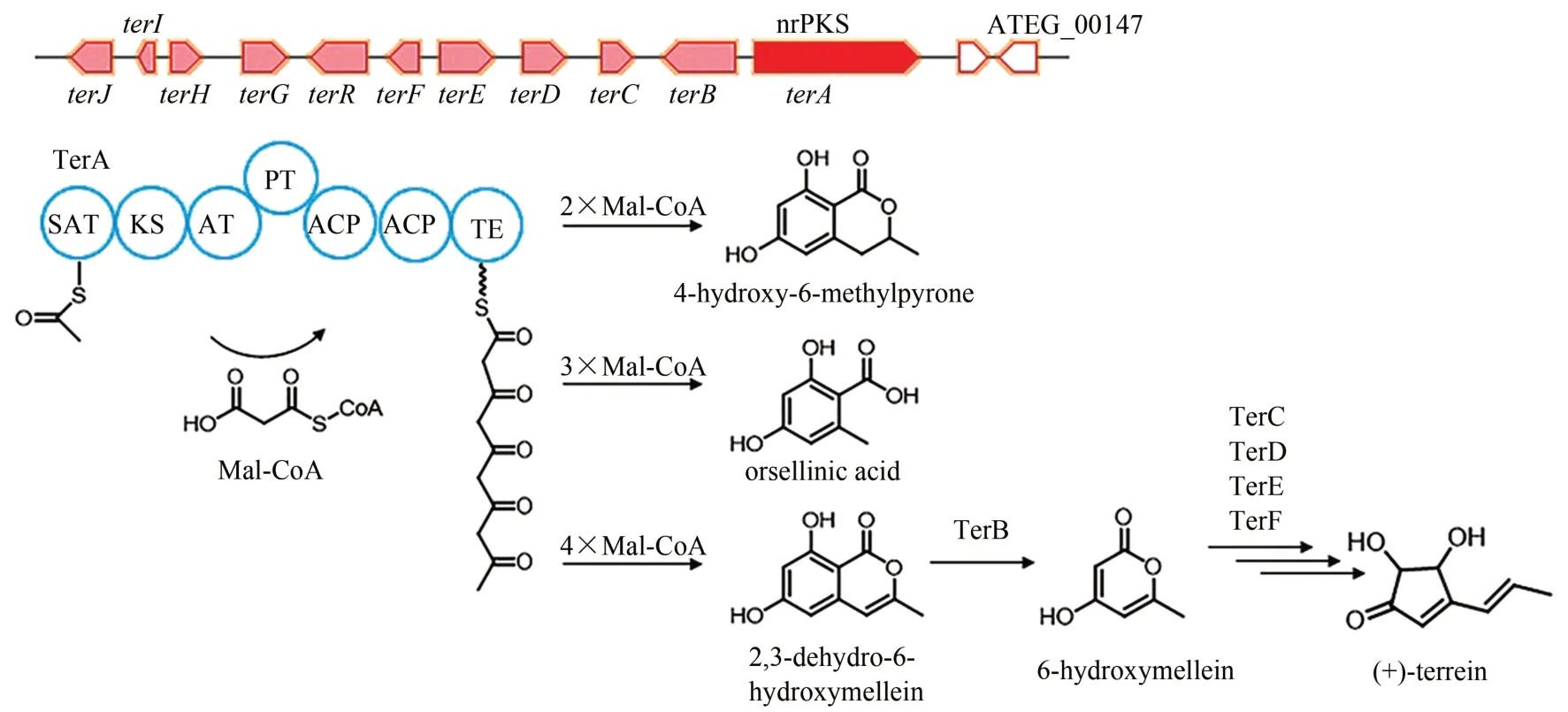
图6 (+)-Terrein的生物合成基因簇及合成途径Fig.6 Gene cluster in the biosynthesis pathway of(+)-terrein in A.terreus
4.1.2 土曲霉酸
土曲霉酸(terreic acid)也是一种从土曲霉中分离得到的quinone epoxide化合物,具有良好的抑制布鲁顿氏酪氨酸激酶活性而成为潜在的癌症治疗药物,因此受到关注。Boruta 等[100]通过OSMAC 策略激活了土曲霉ATCC20542 中terreic acid的生物合成,然后根据生物信息学分析推测其生物合成的是PKS ATEG_06275 所在基因簇(从ATEG_06272 到ATEG_06278),但是并未进行实验验证。2014年,Guo等[84]将土曲霉中核心基因atX(ATEG_06275) 两侧从ATEG_06270 到ATEG_06282的12个基因分别进行敲除,通过对敲除菌株发酵液的分析,鉴定了terreic acid 的生物合成基因簇,并提出了初步的生物合成途径假设,但是仍有一些问题未解决。随后,蔡孟浩课题组通过在甲醇酵母中进行合成途径的异源重构,修正并完善了terreic acid 的生物合成途径[85]。由hrPKS AtX 合成并释放中间产物6-methylsalicylic acid,在脱羧酶AtA的催化下脱羧羟化形成3-methylcatechol,进一步在P-450单加氧酶AtE作用下生成3-methyl-1,2,4-benzenetriol,然后在被环氧酶AtD 氧化羟基化生成terremutin,最后在氧化还原酶AtC的作用下形成terreic acid(图7)。
4.1.3 黄绿青霉素
黄绿青霉素(citreoviridin)是一种ATP 合酶抑制剂,被作为乳腺癌靶向治疗药物研究。研究人员发现生物体中负责某抑制剂生物合成的基因簇中通常会存在一个额外的靶基因拷贝或者一个抗性基因,以这些抗性基因作为定位导向,可作为预测抑制剂类型次级代谢产物生物合成基因簇的有效策略。研究人员利用生物信息学分析发现,citreoviridin 的作用靶点ATP 合成酶β 链CtvE 位于hrPKS CtvA(ATEG_09617)所在基因簇内,从而推测该基因簇即负责citreoviridin 生物合成。Lin等[90]通过在构巢曲霉中重构citreoviridin 生物合成途径,发现ctvA、ctvB、ctvC和ctvD即可实现citreoviridin 的生物合成。首先,由核心酶CtvA 合成一个α-pyrone 中间体,在SAM 依赖型甲基转移酶CtvB 的催化下羟基甲基化生成citreomontanin,然后末端烯烃异构化形成(17Z)-hexaene,再被FAD 单加氧酶CtvC 双环氧化,最终由水解酶CtvD催化tetrahydrofuran ring 的形成,进而生成终产物citreoviridin(图8)。
4.2 非核糖体肽类天然产物
非核糖体肽类化合物是由NRPS 合成的含氨基酸次级代谢产物,土曲霉中共有17 个NRPS 基因,目前,其中4 个的产物已经被鉴定。
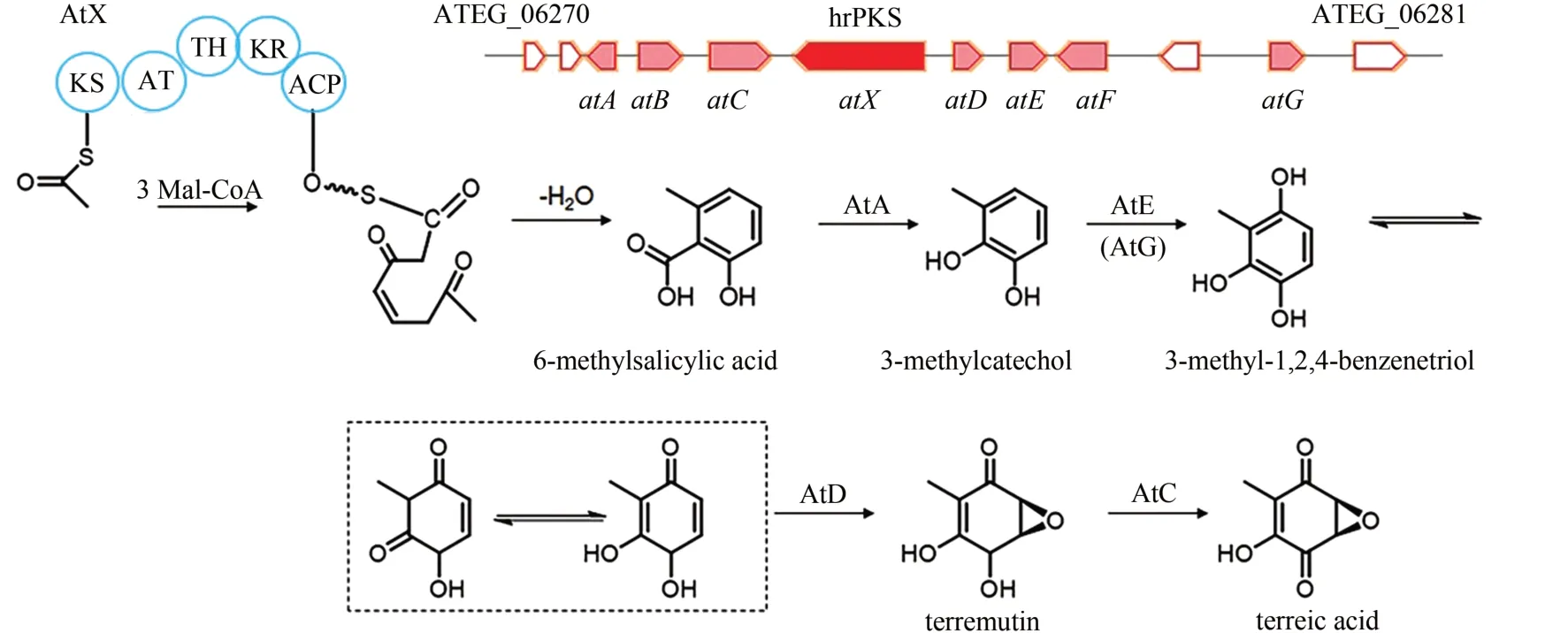
图7 Terreic acid的生物合成基因簇及合成途径Fig.7 Gene cluster in the biosynthesis pathway of terreic acid in A.terreus
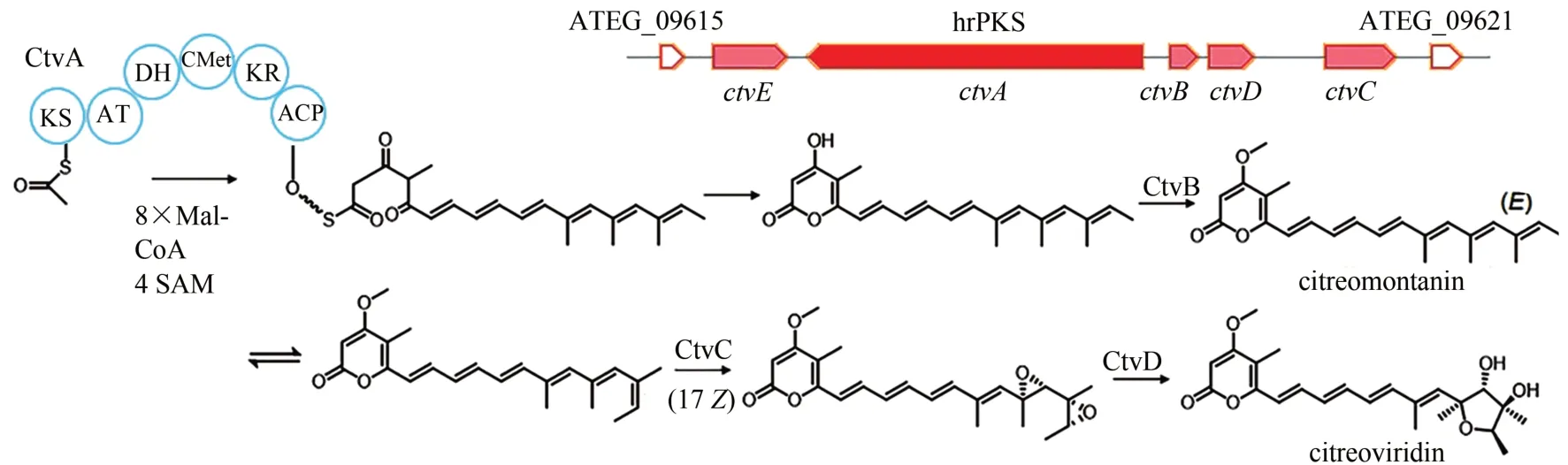
图8 Citreoviridin的生物合成基因簇及合成途径Fig.8 Gene cluster in the biosynthesis pathway of citreoviridin in A.terreus
Acetylaranotin 是一种属于多硫代二酮哌嗪(epipolythiodioxopiperizine, ETP) 的类真菌毒素,通常具有独特的二硫化桥或多硫化桥。根据丝状真菌ETP 类化合物生物合成基因簇系统发育分析,土曲霉中有两个疑似NRPS 基因ATEG_03470 和ATEG_08427 负责acetylaranotin 的合成[101]。2013 年,Wang 课题组[93]通过基因敲除的方式确认ATEG_03470 是acetylaranotin 合成的核心酶, 敲除ATEG_03470 之后不再合成acetylaranotin。进一步通过生物信息学分析和体内基因敲除鉴定了acetylaranotin 的生物合成基因簇,包括NRPS 基因ataP(ATEG_03470)和8 个相关基因,并基于敲除菌株中间产物积累和生物信息学分析提出了生物合成途径(图9)。两个苯丙氨酸在核心酶AtaP 的作用下形成二聚体cyclo-(L-Phe-L-Phe),由AtaTC 中AtaC 结构域催化发生双羟基化,然后在AtaIMG 的谷胱甘肽转移酶结构域(AtaG)作用下结合两分子谷胱甘肽,紧接着又通过二肽酶AtaJ 水解脱去两分子谷氨酸,在ATaIMG 的碳-硫裂解酶结构域(AtaI)作用下继续水解生成表二硫醇中间体。AtaTC 的巯基氧化酶结构域(AtaT)将游离的两个巯基氧化形成跨环二硫化桥,并由P-450 酶AtaF 催化发生双环氧化,进一步生成具有吡咯烷结构的中间体,然后在酰基转移酶AtaH 作用下乙酰化,最终通过苯甲酸对-羟化酶AtaY 催化形成oxepine 环,获得acetylaranotin[93]。
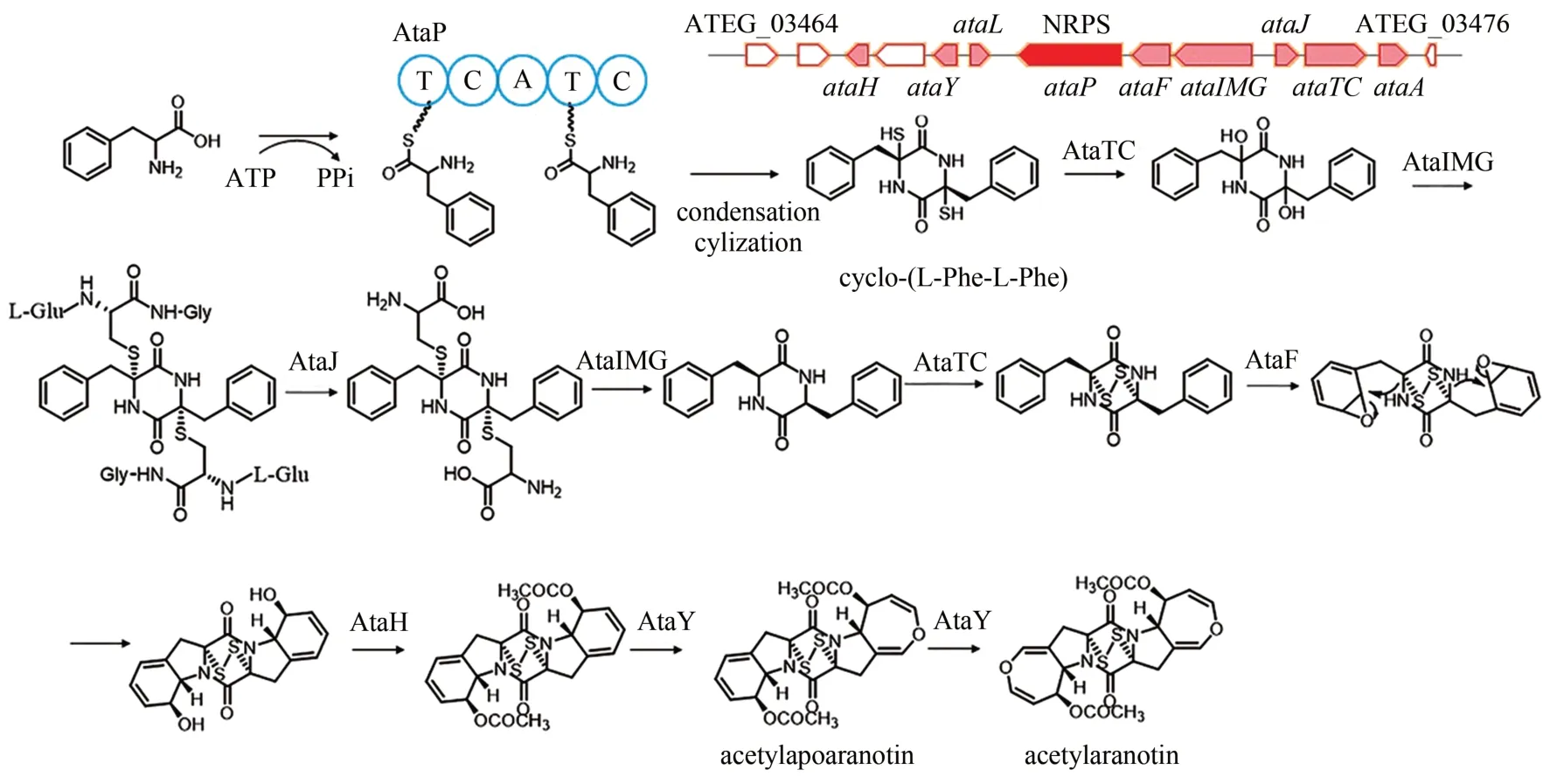
图9 Acetylaranotin的生物合成基因簇及合成途径Fig.9 Gene cluster in the biosynthesis pathway of acetylaranotin in A.terreus
4.3 类非核糖体肽天然产物
NRPS-like 与NRPS 的差异在于C 结构域,被TE 或R 结构域所取代。土曲霉中共有19 个NRPSlike 基因,Wang 课题组做了比较系统的研究,目前有6个已经完成了产物鉴定[2,7,95]。
黑色素是自然界中一种常见的色素,真菌通过合成黑色素来抵御逆境。真菌比较常见的黑色素是一种来源于真菌聚酮途径的二羟基萘(DHN)类黑色素,但是基因组挖掘并未在土曲霉中发现合成DHN 黑色素的PKS 基因。Guo 等[2]发现在土曲霉中敲除NRPS-like ATEG_03563(atmelA)后,会产生白化的孢子。进一步的基因敲除和体外酶活等实验证实ATEG_03563 和酪氨酸酶ATEG_03564 负责合成一种新的非典型孢子色素Aspmelanin,并提出了其生物合成途径[95]。两分子的对羟基苯丙酮酸在AtmelA 的作用下生成aspulvinone E,然后在酪氨酸酶TyrP的催化下发生羟基化生成不稳定的中间产物,并最终自发形成孢子色素Asp-melanin。在此期间研究人员还发现孢子色素Asp-melanin 合成过程中存在空间调控现象(图10)。AtmelA 和ApvA(ATEG_02004)这两个NRPS-like 合成的产物都是化合物aspulvinone E,ApvA 只在菌丝中产生aspulvinone E 并最终形成aspulvinone 类化合物,而AtmelA 只在分生孢子中产生aspulvinone E,并最终参与孢子色素的合成[102]。另外还发现,催化aspulvinone E 形成aspulvinone H 的异戊烯基转移酶AbpB,同时还可以催化NRPS-like BtyA(ATEG_02815)的产物butyrolactone Ⅱ发生类似的反应生成butyrolactone I。这种空间分布可能是转录调控及酶定位的差异导致的,也说明真菌次级代谢产物合成具有复杂的调控机制。
4.4 萜类天然产物
萜类是最丰富的一类次级代谢产物,结构新颖且活性好,在植物和真菌中都有大量存在。土曲霉有很好的萜类合成潜力,含有12 个萜类生物合成基因簇,绝大部分还未被鉴定,值得关注。
4.4.1 Aspterric acid
Aspterric acid 是一种强效除草剂,抑制二羟酸脱水酶(DHAD)的活性可达亚微摩尔级。土曲霉中aspterric acid 的生物合成基因簇是通过抗性基因作为预测导向被发现的。研究人员分析发现DHAD 同源基因astD位于一个萜类合成基因簇内,基因簇中包括一个TC 基因astA(ATEG_04416),还有两个细胞色素P-450 酶基因astB和astC。由于该基因簇在土曲霉中是沉默的,Yan 等[97]将该基因簇中的基因逐步在酿酒酵母中异源表达,成功产生了aspterric acid 和其中间体,从而解析了其生物合成途径(图11)。farnesyl diphosphate 在AstA的作用下环化生成(-)-daucane,然后在AstB 的作用下进一步氧化,将甲基转化为羧酸并形成环氧化物,另一个甲基被AstC 氧化生成羟基并推动分子内环氧化合物的开环,生成aspterric acid。
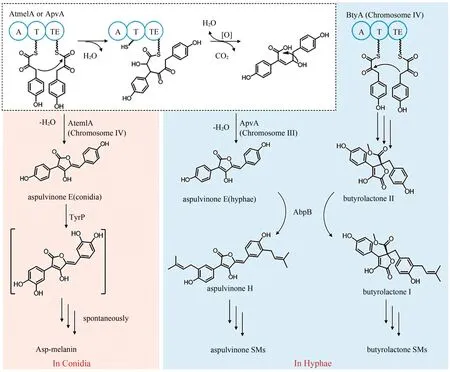
图10 土曲霉Asp类黑色素的生物合成机制Fig.10 Biosynthesis of Asp-melanin in A.terreus
4.4.2 土曲杂萜
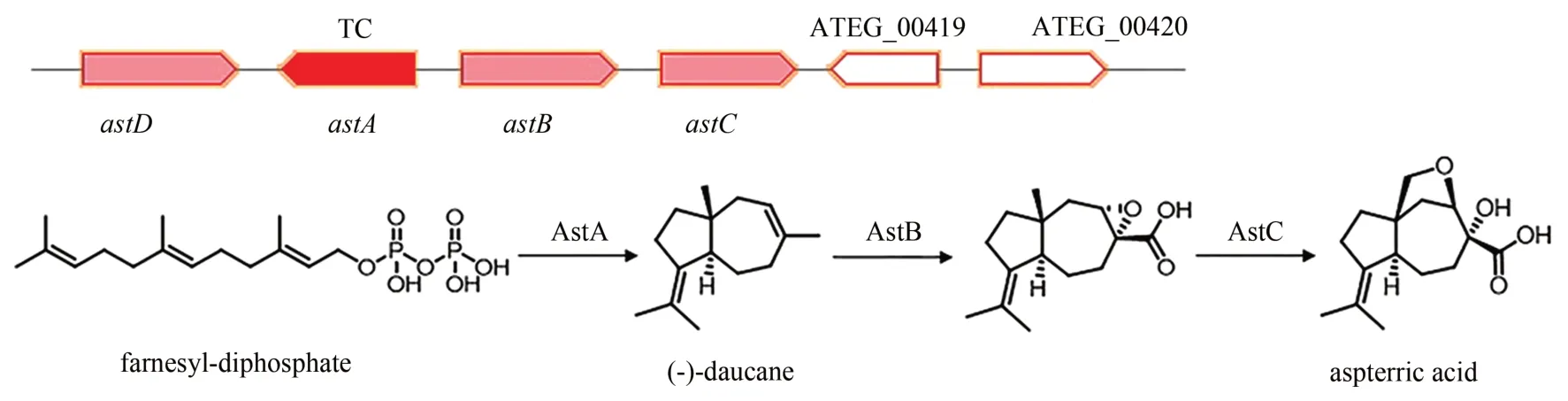
图11 Aspterric acid的生物合成基因簇及合成途径Fig.11 Gene cluster in the biosynthesis pathway of aspterric acid in A.terreus
土曲杂萜(terretonin)是土曲霉中一种聚酮-萜类杂合的混源萜类化合物,早在20 世纪80 年代,研究人员就用同位素标记证明terretonin 的合成包括聚酮和萜类途径[103]。这说明其生物合成应该同时需要PKS 和异戊烯基转移酶参与。Guo等[88]通过生物信息学分析,发现nrPKS 基因ATEG_10080(trt4)附近有一个异戊烯基转移酶基因ATEG_10078(trt2),这表明trt4和trt2可能参与terretonin 的合成。随后基因敲除实验证实了这一推测,结合与构巢曲霉austiol合成基因簇的比对分析结果,最终确定了合成terretonin 基因簇的范围,并初步提出了terretonin 的生物合成途径假设。Matsuda 等[89]通过在米曲霉中异源重构的方式进一步完整解析了terretonin 的生物合成途径。即Trt4 负责合成并释放聚酮化合物3, 5-dimethylorsellinic acid (DMOA), 然后farnesyl pyrophosphate(FPP)与DMOA 在Trt2 的催化下生成farnesyl-DMOA,紧接着依次在Trt5、Trt8、Trt1、Trt9、Trt3 的作用下发生甲基化、环氧化、环化、氧化和羟基化生成terrenoid,随后在多功能P-450 酶Trt6 和异构酶Trt14 共同作用下形成terretonin D,最终由Trt7 催化两次氧化生成terretonin(图12)。该杂合化合物是由基因簇内两个不同类型核心酶共同参与合成的。
4.5 聚酮-非核糖体肽杂合天然产物
PKS-NRPS杂合酶是一类比较特殊的次级代谢产物合成核心酶,此类酶中同时含有PKS 和NRPS模块,因此其产物通常是聚酮和氨基酸的含氮复合物,结构新颖,所以受到关注。土曲霉NIH2624基因簇注释结果显示土曲霉只有一个PKS-NRPS杂合酶基因ATEG_00325。近期,本研究组通过基因组挖掘策略在土曲霉中又发现了一个PKS-NRPS杂合酶ATEG_00913。
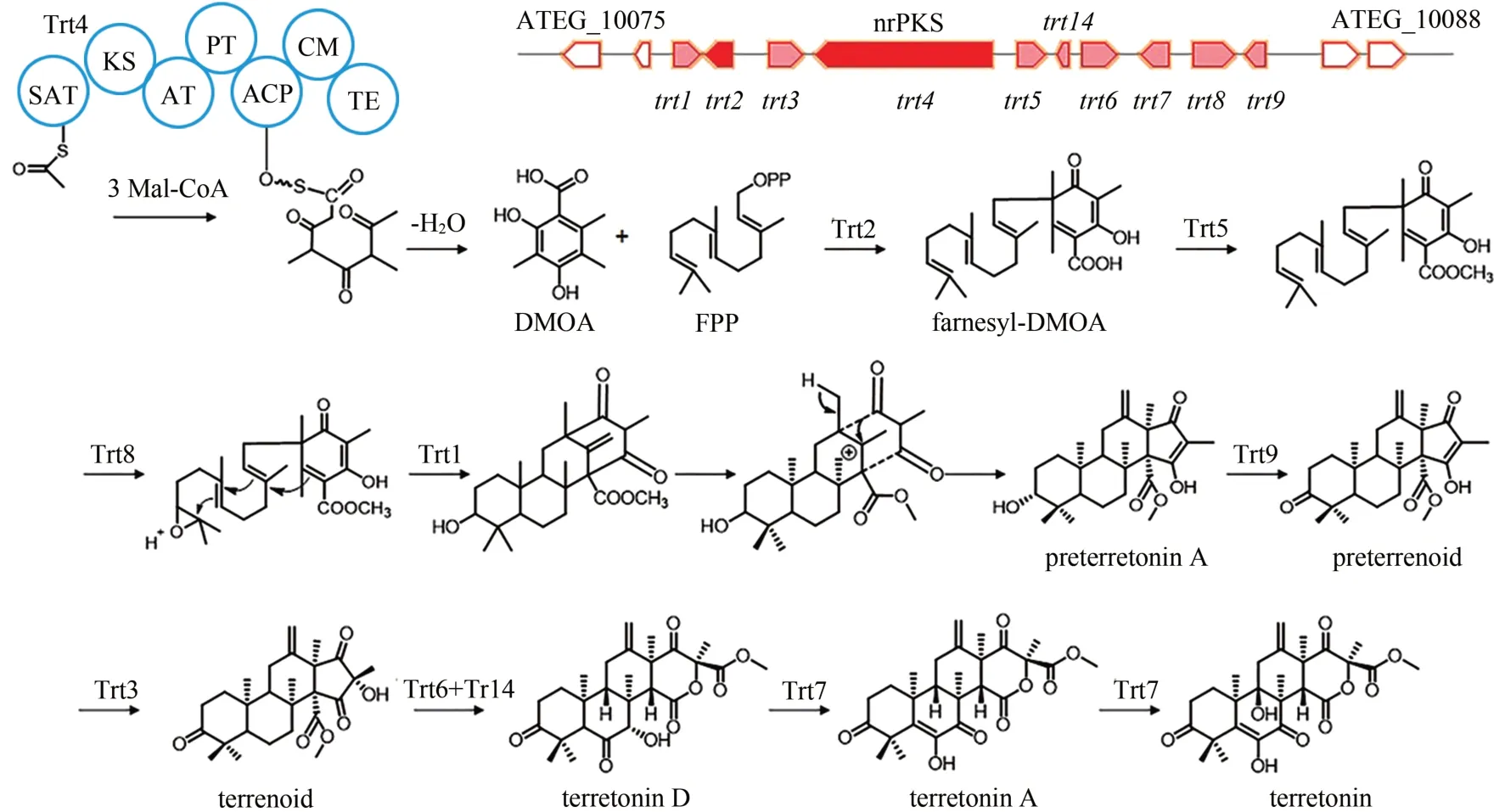
图12 Terretonin的生物合成基因簇及合成途径Fig.12 Gene cluster in the biosynthesis pathway of terretonin acid
4.5.1 异戊二霉素
PKS-NRPS 杂合酶编码基因ATEG_00325 所在基因簇在实验室条件下是沉默的,Gressler 等[96]研究发现该基因簇的表达受部分氨基酸的诱导和糖的抑制,RT-PCR 分析显示在产生异戊二霉素(isoflavipucine)的条件下与ATEG_00325 相邻的一些基因的转录水平有相关性,预测isoflavipucine的生物合成基因簇可能包含ATEG_00325、ATEG_00326、 ATEG_00329、 ATEG_00330、 ATEG_00331 这五个基因,并且通过同位素标记实验推测了其可能的生物合成途径,但是很多关键的反应还有待实验验证(图13)。这项研究不仅提出了一种系统诱导真菌沉默基因簇的方法,还关注到了初级和次级代谢产物之间的紧密联系。
4.5.2 土曲吡喃酮
土曲霉MEFC01 重测序后进行antiSMASH 分析发现了之前被注释为PKS 的ATEG_00913(pytA)其实是一个PKS-NRPS 编码基因。由于该基因簇在实验室条件下是沉默的,本研究组用土曲霉内源组成型强启动子PgpdAt替换基因簇中特异性转录调控因子ATEG_00919的天然启动子,成功激活了这个沉默的基因簇,发现该基因簇合成一类土曲吡喃酮(pyranterreones)化合物。随后,通过氨基酸C13 标记方式确定杂合酶的NRPS 模块是选择丝氨酸作为延伸底物,结合基因敲除结果提出了这类聚酮-氨基酸杂合化合物的生物合成途径(图14)[76]。该研究从基因组测序到沉默基因簇激活,再到基因敲除和分子探针标记,是丝状真菌次级代谢产物基因组挖掘的一个成功案例。
4.6 合成一个目标天然产物的两个独立基因簇间的协同调控机制
如上所述实例,次级代谢产物的合成通常只含有一个核心基因,只有少数基因簇中含有两个核心基因,如洛伐他汀基因簇含有两个PKS。另外,次级代谢产物合成相关基因通常位于同一个基因簇内,极少有两个独立的基因簇共同合成一个化合物。近期,本研究组在土曲霉中发现了一种复杂新颖的丝状真菌次级代谢产物合成及调控机制(图15)。
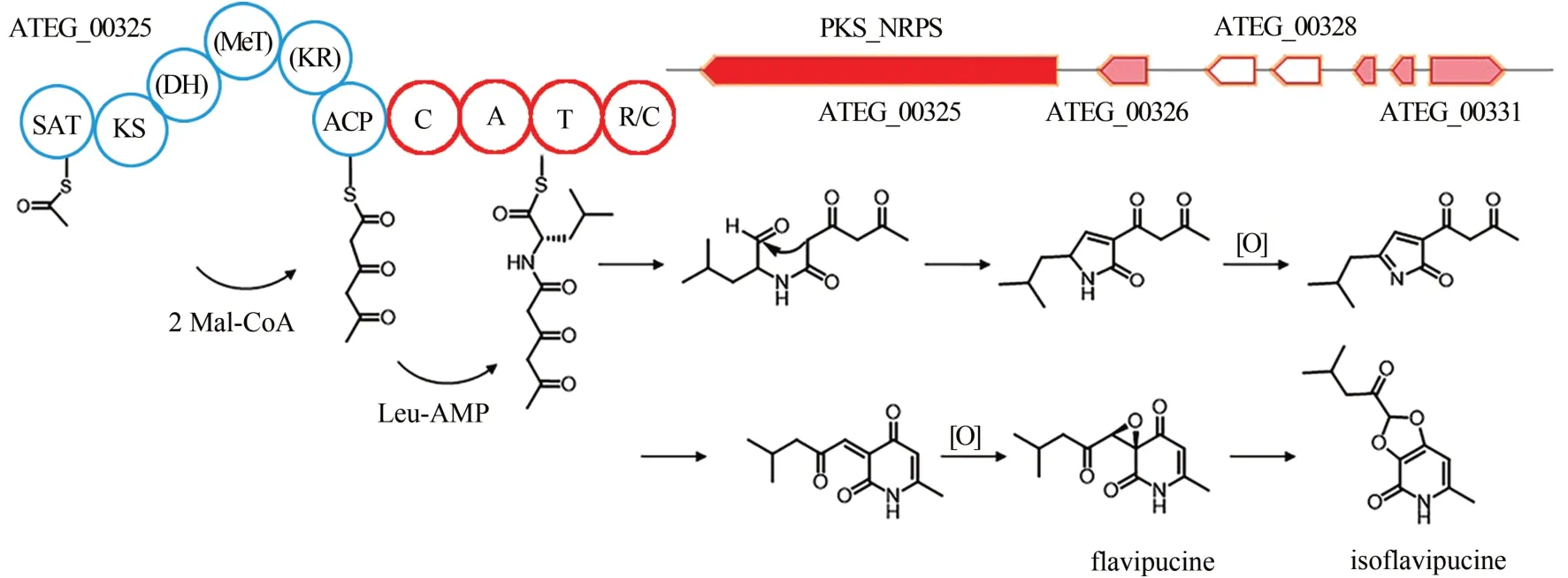
图13 Isoflavipucine的生物合成基因簇及合成途径Fig.13 Gene cluster in the biosynthesis pathway of isoflavipucine in A.terreus
基因簇A含有ATEG_03629(nrPKS)和ATEG_03630(NRPS-like)两个核心基因,基因簇B 含有ATEG_07659(hrPKS)和ATEG_07661(nrPKS)两个核心基因,由于这两个基因簇在实验室基本培养基条件下是沉默的,以前报道都只是通过异源重构方式进行了初步鉴定。Zhao 课题组在酿酒酵母中异源表达了ATEG_03629 和ATEG_03630 这两个核心酶基因,发现其能够合成5-甲基苔色醛[104]。Wang 课题组通过在构巢曲霉中异源重构ATEG_07659/ATEG_07661 基因簇,发现该基因簇能够合成asperfuranone[81]。本研究组通过培养条件优化成功激活这两个基因簇,并意外发现这两个独立基因簇共同参与合成一类含有6/6/6/6 稠环(6/6/6/6 tetracyclic system) 的新化合物azasperpyranones。在此基础上,进一步通过体内基因敲除和体外酶学验证,对两个基因簇内各基因进行了功能分析,系统解析该类化合物的生物合成途径。同时,还发现这两个独立的基因簇之间虽然存在空间距离,但是存在一种由三个转录调控因子介导的多层级转录调控,使得它们能够相互协调共同参与同一个化合物的合成[92]。
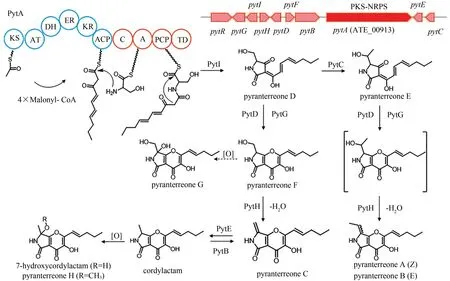
图14 Pyranterreones的生物合成基因簇及途径Fig.14 Gene cluster in the biosynthesis pathway of pyranterreones in A.terreus
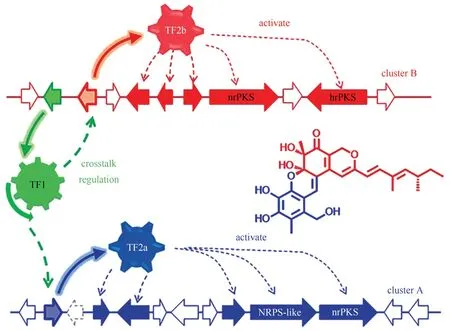
图15 两个独立基因簇协同合成化合物azasperpyranonesFig.15 Synergistic synthesis of azasperpyranones under the catalysis of key enzymes encoded by two gene clusters
这是首次在丝状真菌中发现由两个独立的基因簇中的四个核心基因共同合成一个次级代谢产物,也是首次发现两个独立基因簇在多层级的协同调控机制下共同作用,这种合成机制有助于生物合成结构更加复杂的化合物,并获得更加有益于生存的生物活性。该发现对于研究丝状真菌合成复杂化合物的生物机制具有重要意义,为真菌次级代谢产物生物合成途径解析和新型天然产物基因组挖掘提供了新思路。
5 土曲霉底盘细胞的合成生物技术应用前景
很多具有应用价值的次级代谢产物由于天然宿主调控机制复杂、培养难度大或者周期较长等因素,生产效率非常低,严重阻碍了其应用开发前景,例如植物、难培养微生物和一些极端微生物。随着合成生物学近年来的快速发展,构建目标产品导向的异源高效微生物细胞工厂成为研究热点。将完整的合成途径在底盘细胞进行异源重构,以避免天然宿主的特异性调控,从而实现高产,而在此过程中底盘细胞的选择非常重要。通过工业发酵生产衣康酸和洛伐他汀,土曲霉展现出了强大的初级代谢产物和次级代谢产物生产能力,以及良好的工业发酵性能,生长快速、营养需求简单且碳源利用率高,工业生产具有高效率、低成本的优势。并且土曲霉产孢能力强、抗逆性能好,菌丝体发酵形态适合大规模发酵,在我国已经建立了成熟的土曲霉发酵工艺,最大单罐体积300t。由此可知,这些土曲霉工业菌株具备作为底盘细胞用于合成生物技术开发不同目标产品的优良条件,工业发酵放大难度相对较小,有利于实现最终的产业化应用。
5.1 次级代谢产物基因组挖掘的异源底盘细胞
在异源底盘细胞中重构合成途径是鉴定沉默基因簇的一种有效方法,真菌天然产物由于其生物合成机制的一些特殊性,使得其在大肠杆菌和酿酒酵母等模式生物中很难高效异源重构。首先,大肠杆菌属于原核生物,缺少真核生物转录后mRNA 剪接机制,酿酒酵母虽然属于真核生物,但是并不能很准确地识别其它真核生物基因内含子和外显子,异源表达时都需要使用目的基因的cDNA,尤其是在基因簇包含的基因较多时操作难度会较大。其次,由于缺少相关的磷酸泛酰巯基乙胺基转移酶,PKS 和NRPS 在野生型大肠杆菌和酿酒酵母中都没有活性,通过引入合适的外源磷酸泛酰巯基乙胺基转移酶可以解决该问题,但是活性仍旧较低[25,79]。另外,真菌P-450催化系统与原核生物的具有一定特殊性,还原伴侣不能通用,而且丝状真菌P-450 酶在细菌或酿酒酵母中功能性表达难度很大。丝状真菌作为异源表达宿主可以很大程度上避免这些问题,可以准确地完成其他真菌来源基因转录后的后修饰,不需要额外去除基因中的内含子,可以实现合成基因簇的整体转移整合。研究人员开发并利用构巢曲霉作为底盘细胞成功鉴定了一些真菌沉默基因簇的产物,这说明用丝状真菌作为底盘细胞是切实可行的[81]。但是,如果底盘细胞次级代谢产物本身的合成能力较弱,获得产物量会很少,会增加后续研究的难度。产洛伐他汀土曲霉工业菌株具有很高的洛伐他汀产量,这说明其次级代谢产物合成能力强,合成前体供应充足,P-450 催化系统高效,更容易实现目标途径化合物的高产,有助于新型天然产物生物合成途径解析研究。
5.2 聚酮类化合物高效合成的细胞工厂
聚酮类化合物在丝状真菌、蕈菌和植物中广泛存在,并显示出很好的应用价值,如药物和天然色素等,很多中药的活性成分也是聚酮。有些化合物由于产量太低或者培养种植效率太低,大量制备难度大,成本很高,限制了其下游研发或推广应用。土曲霉工业菌株卓越的洛伐他汀生产能力说明其聚酮类天然产物合成的上游途径非常发达,作为底盘细胞用于生产其他异源次级代谢产物,尤其是聚酮类化合物时可以保证充足的底物供应,是目标化合物高产的重要保障。例如,蒽醌类化合物大黄素是中药大黄的主要活性成分,也是一种天然色素,由于中药植物种植效率低、限制多,使得其成本很高且产能很低,应用市场受限。近期,本研究组以产洛伐他汀土曲霉工业菌株作为底盘细胞,开发了能直接合成大黄素的细胞工厂,初步摇瓶发酵产量达到了2g/L[105]。这说明土曲霉确实是聚酮类化合物生物合成的理想底盘细胞,至于其他类型天然产物的适用性有待评估。而且,成熟的土曲霉工业发酵基础,使其相较于其它底盘细胞开发的细胞工厂,在发酵规模放大方面难度相对较小,更具产业化竞争力。
5.3 高值有机酸生物合成的细胞工厂
如前所述,产衣康酸土曲霉菌株能快速地通过中心代谢途径,将简单的葡萄糖碳源转化成衣康酸,其他有机酸副产物极少,说明它具有很好的葡萄糖摄取及转化能力。而且该菌株具有很好的低pH 耐受能力,发酵初始pH 约4.0,开始产酸后pH可降至2.0。例如,反式乌头酸是一种不饱和三羧酸,具有很好的杀线虫活性和成为具有重要应用价值生物基化学品的潜力,但是由于缺乏可靠的生产方式,其应用潜力未能挖掘。近期,本研究组以产衣康酸工业菌株为底盘细胞,将其改造成能够发酵生产反式乌头酸的细胞工厂,初步的20t 发酵罐示范产量达到30g/L[106]。发酵过程中pH 低至1.5,在该条件下大肠杆菌和酵母等底盘细胞很难正常生长。因此,在设计初级代谢产物细胞工厂时,尤其是酸性化合物,土曲霉是一种可供选择的底盘细胞。
6 展望
随着合成生物技术的快速发展,很多微生物底盘细胞被陆续开发和应用。土曲霉作为丝状真菌底盘细胞,因其卓越的发酵性能和成熟的工业应用基础而受到关注。相较于目前已经开发相对成熟的其他模式微生物体系,土曲霉合成生物技术研究还有很多不足之处需要加强。首先,可选用的遗传元件少,如筛选标记、启动子和终止子等,遗传元件是合成生物技术开发的基础模块,遗传改造元件库的建设将是一个重要研究任务。尤其是启动子,包括土曲霉在内的丝状真菌启动子元件很少进行系统表征,其强弱及变化趋势都不明确,这也使得丝状真菌目前还很难像大肠杆菌和酿酒酵母等模式生物那样进行相对定量可控性的遗传改造。其次,CRISPR/Cas9基因编辑技术有待开发,一些丝状真菌中已经成功开发了CRISPR/Cas9基因编辑技术,展现出明显先进性的同时也有一些不足,比如编辑效率比在酵母中要低得多,不同基因位点的编辑效率也不同,还有应用策略有局限性,目前还仅限于基因的定点突变、替换和敲除破坏。在开发适用于土曲霉CRISPR/Cas9基因编辑技术的同时应该努力改善上述缺陷。最后,细胞工厂性能评估也是合成生物技术开发的一个重要环节,相较于单细胞微生物,多细胞真菌的高通量分析难度更大,开发可靠的高通量筛选和发酵评估方法将是一个很具挑战的任务。加强上述研究将显著提升土曲霉及丝状真菌合成生物技术研究水平,提供更多可供选择的设计策略,构建更加高效的土曲霉细胞工厂。此外,这些也是丝状真菌相关研究中的共性问题,土曲霉合成生物技术研究也将促进其他丝状真菌的发展。

