甲醇生物转化的机遇与挑战
高教琪,周雍进
(1 中国科学院大连化学物理研究所生物技术研究部,辽宁大连116023; 2 大连市能源生物技术重点实验室,辽宁 大连116023)
煤、石油等化石资源是目前人类生活生产主要能量来源,然而其资源有限性以及利用过程带来的环境污染问题,迫使我们发展更加高效的洁净利用路线。我国煤炭资源相对丰富,但劣质煤含量高,直接燃烧污染较大,急需发展洁净转化过程实现煤炭高效洁净利用。虽然氢能在能量密度(142 kJ/g)和洁净等方面拥有其他燃料不可比拟的独特优势[1],但其在能量储存方便性、使用安全性、基础设施建设以及体积能量密度方面还存在许多限制因素[2]。甲醇含有碳、氢两种元素,可看作氢载体,且碳元素还能用来合成多种化学品。其液态特性有利于储存与运输,能够与现有石油等基础设施对接,被看作一种具有潜力的化工原料[3-5]。甲醇可以由煤炭与天然气大规模制备,特别是,近年来提出了“液态阳光”路线,CO2直接加氢获得甲醇。因此,甲醇将成为丰富的原料,建立高效转化路线是保证未来能源及化学品需求的可行路径。
目前,甲醇已经在化工路线中广泛用于原料或者中间体合成甲醛、叔丁基甲酯(MTBE)和乙酸等,占到全球甲醇消耗总量的65%~70%[1,6]。近年来,甲醇制烯烃技术(MTO)解决了我国短链烯烃供应不足的难题[3]。同时,生物合成系统(酶及微生物细胞)选择性好、过程绿色、条件温和,能高选择性合成结构更加复杂的含氧化学品以及能量密度更高的液体燃料。因此,生物系统与化工路线互为补充,有望成为甲醇高效转化的另一可行路径,推动我国煤炭及一碳资源洁净利用[7-9]。
本文首先简要介绍了甲醇制备方法,然后详细综述了近年来微生物甲醇转化的研究进展,特别从天然甲基营养型和合成甲基营养微生物细胞工厂构建论述了目前甲醇生物转化的进展,并探讨了甲醇生物转化所面临的机遇与挑战。
1 甲醇的合成
近年来,甲醇市场不断扩大,截止到2015年,全球市场甲醇需求量超过8千万吨[6]。甲烷是甲醇合成的最重要原料,目前工业化生产的甲醇绝大部分来源于甲烷合成途径。该路线从合成气(由CO、H2和部分CO2组成)制备出发,经化学催化方法获得甲醇。除此之外,以绿色化学技术路线(如CO2加氢)以及条件温和且环境友好的甲烷生物转化合成甲醇的技术也得到了广泛关注(图1)。
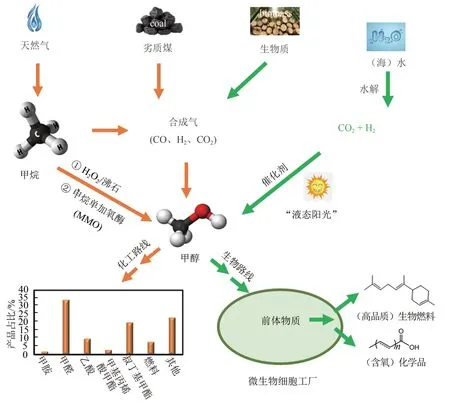
图1 甲醇合成与转化示意图Fig.1 Overviews on the production and transformation of methanol
1.1 基于合成气的甲醇合成
基于合成气的甲醇化学合成路径包括3 个步骤:①合成气制备;②合成气制备粗甲醇;③甲醇精馏纯化[1,6]。合成气既可来源于不可再生资源天然气和煤等,也可使用可再生生物质进行合成(图1)。最广泛应用的合成气制备技术为甲烷蒸气重排:在特定温度(800~1000oC)与压力(20~30atm)(latm=1.01×105Pa)下发生水煤气变换反应(WGS)[10]。天然气是甲烷最主要来源,甲烷占比达85%,因此天然气可直接用于基于合成气的甲醇生产,目前全球90%以上的甲醇来源于天然气制备[11]。虽然目前我国天然气储量相对丰富,但依然有30.1%的消耗依赖于进口[12],近年来可燃冰的发现有望缓解天然气供应不足。
我国煤炭资源相对丰富,储量占全球总量12.8%,而且基本无需依赖进口[12]。特别是劣质煤的洁净利用具有重要经济意义和社会意义。以煤炭为原料的甲醇制备过程与天然气相似,煤炭经过气化、部分氧化和蒸气处理等过程,生成沼气(CH4和CO2)、合成气(H2、CO、CO2)和一些碱性气体[1],用于甲醇制备。这一过程为传统的热化学技术,反应温度在800~1000oC[13]。
最近,利用可再生生物质合成甲醇快速发展。与煤炭路线相似,生物质也能够使用传统的高温气化技术进行甲醇合成,但是生成的焦油类物质严重影响合成效率[14]。因此,生物质焙烧技术或称为温和热解技术,逐渐应用于生物质气化过程,200~300oC 厌氧条件有利于生物质低损失、合成气高得率以及下游甲醇合成[15]。
合成气制备甲醇过程中,H2、CO 和CO2比例会因原料来源和处理工艺而有所差异,并影响最终甲醇得率。巴斯夫股份公司(BASF)、杜邦公司(DuPont)及英国帝国化学工业公司(ICI)等化工巨头均开发了合成气制备甲醇流程。其差别在于反应器设计和催化剂种类。其中ICI 公司开发的工艺甲醇得率最高,甲醇产量占全球60%以上,该工艺路线条件催化剂为Cu/ZnO/Al2O3,压力为35~54 bar (1bar=1×105Pa), 温度为 200~300oC[16]。同时,以含有CO2成分的合成气作为原料也可以实现甲醇合成,该反应过程在低温条件下进行,一步法实现转化率70%~100%[17]。
1.2 甲烷氧化制备甲醇
近年来,天然气的大量挖掘为甲醇制备提供了更加充足的原料。因此,利用天然气主要成分甲烷直接氧化合成甲醇的一步法技术路线受到广泛关注,取得一定进展。
1.2.1 甲烷直接氧化
热力学上,甲烷直接氧化形成甲醇在室温条件下就能够自发进行。但实际上,由于甲醇化学性质更加活泼且其C—H 键能量更低,利用化学催化实现甲烷直接氧化面临着低转化率(小于3%)以及过氧化(副产物CO 和CO2)等难题[18]。尽管如此,甲烷直接氧化由于其原料广泛一直以来受到学者们的广泛关注。虽然Hg、Au、Pt 等贵金属催化剂在强酸和盐离子环境下能实现甲烷氧化[19-20],但是仍然面临副产物以及环境不友好等问题。最近,肖丰收研究团队利用“分子围栏”技术,设计了一种疏水的沸石纳米催化剂,将双氧水有效锁在催化剂内部,在70oC 低温条件下,甲烷转化率达到17.3%,甲醇得率为15.9%[21],显著提升了过程效率。
1.2.2 甲烷生物氧化
自然界中存在一类甲烷氧化菌,在甲烷单加氧酶(MMO)催化下,能天然转化甲烷生成甲醇。该过程条件更加温和,选择性更高,越来越受到关注。MMO 可分为两类,一类是颗粒性甲烷单加氧酶(pMMO),是铜离子依赖的膜蛋白;另一类是可溶性甲烷单加氧酶(sMMO),是铁离子依赖的胞浆蛋白。近年来,Sazinsky 等[22]针对于两种MMO 结构、底物通道以及催化机制开展了系列研究。这些研究为实现生物催化甲烷高选择性转化成甲醇奠定了良好理论基础。
甲烷氧化菌可被直接用来催化甲烷到甲醇的氧化过程[23]。比如,甲烷氧化菌Methylosinus trichosporiumOB3b 能实现一定量甲醇积累(1.12 g/L),转化率为60%,但是,其效率还不够高[0.028 g/(L·h)][24]。可以看出,生物路线较低的甲醇合成效率难以满足工业化生产需求。目前,MMO 难以实现异源表达,而甲烷氧化菌缺乏遗传操作工具,很难进行遗传改造,无法实现甲烷氧化过程强化。因此,甲醇生物合成任重而道远。
1.3 基于CO2加氢的甲醇合成
基于化石燃料的甲醇合成终究不可持续,拓展甲醇合成原料迫在眉睫。大气中CO2浓度日益增高(2016年已经达到400µL/L[25]),因其导致的全球气候变暖也急需寻求CO2控制、捕获以及利用方式。相比于控制排放与CO2捕获,CO2转化与利用既能降低温室效应,又能缓解由于化石燃料枯竭导致的资源危机。但是,CO2是高度稳定分子,其活化和转化过程十分耗能,需要具有高吉布斯自由能分子协助[26]。H2(来源于电/光解水或者生物质气化的可再生能源[27])是CO2的理想还原剂,因此,CO2加氢合成甲醇的技术路线(CO2+3H2=CH3OH+H2O)是绿色环保、极具应用前景的甲醇合成方式。
CO2加氢过程可以通过电催化[28]、光催化[29]和热催化实现。相比于电催化和光催化,热催化能为这一过程提供更多能量,成为CO2加氢主要催化方式[30-33]。催化剂选择也决定CO2加氢过程的选择性和转化率。目前,常用催化剂包括铜基催化剂(Cu-ZnO)[30]、铟基催化剂(In2O3)[31-32]、ZnOZrO2[34]、Pd/Pt基催化剂[31,33]等。最近,Wang等[34]利用Cu-ZnO-ZrO2催化剂,在493K、3.0 MPa条件下,实现18.2%的甲醇转化率和80.2%的甲醇选择性。目前,CO2加氢合成甲醇一方面局限于CO2和H2的原料来源[6],另一方面合适催化剂的选择,能够在温和条件下实现甲醇高转化率、高得率和高选择性。最近,液态阳光路线目标是利用太阳光实现氢气生产以及CO2加氢,该策略若能成功将真正实现甲醇的可持续供应[35]。随着研究不断深入,CO2加氢合成甲醇将逐步替代现有基于天然气的甲醇合成模式。
2 天然甲基营养型微生物的甲醇利用
所谓“甲基营养型”,就是指微生物能够天然利用甲醇作为唯一碳源和能源进行细胞生长和代谢过程,包括甲基营养型细菌(如甲醇芽孢杆菌和扭脱甲基杆菌等)和甲醇酵母(如毕赤巴斯德酵母和多形汉逊酵母等)[5]。甲醇异化过程,也就是氧化生成CO2的过程并不限于甲基营养型微生物,例如谷氨酸棒状杆菌也能够氧化甲醇生成CO2[36]。但是,甲醇同化途径只存在于甲基营养型微生物中,包括核酮糖-5 磷酸循环(Ru5P 循环)和丝氨酸循环(存在于甲基营养型细菌),以及木酮糖-5 磷酸循环(Xu5P循环)(存在于甲醇酵母)(图2)。
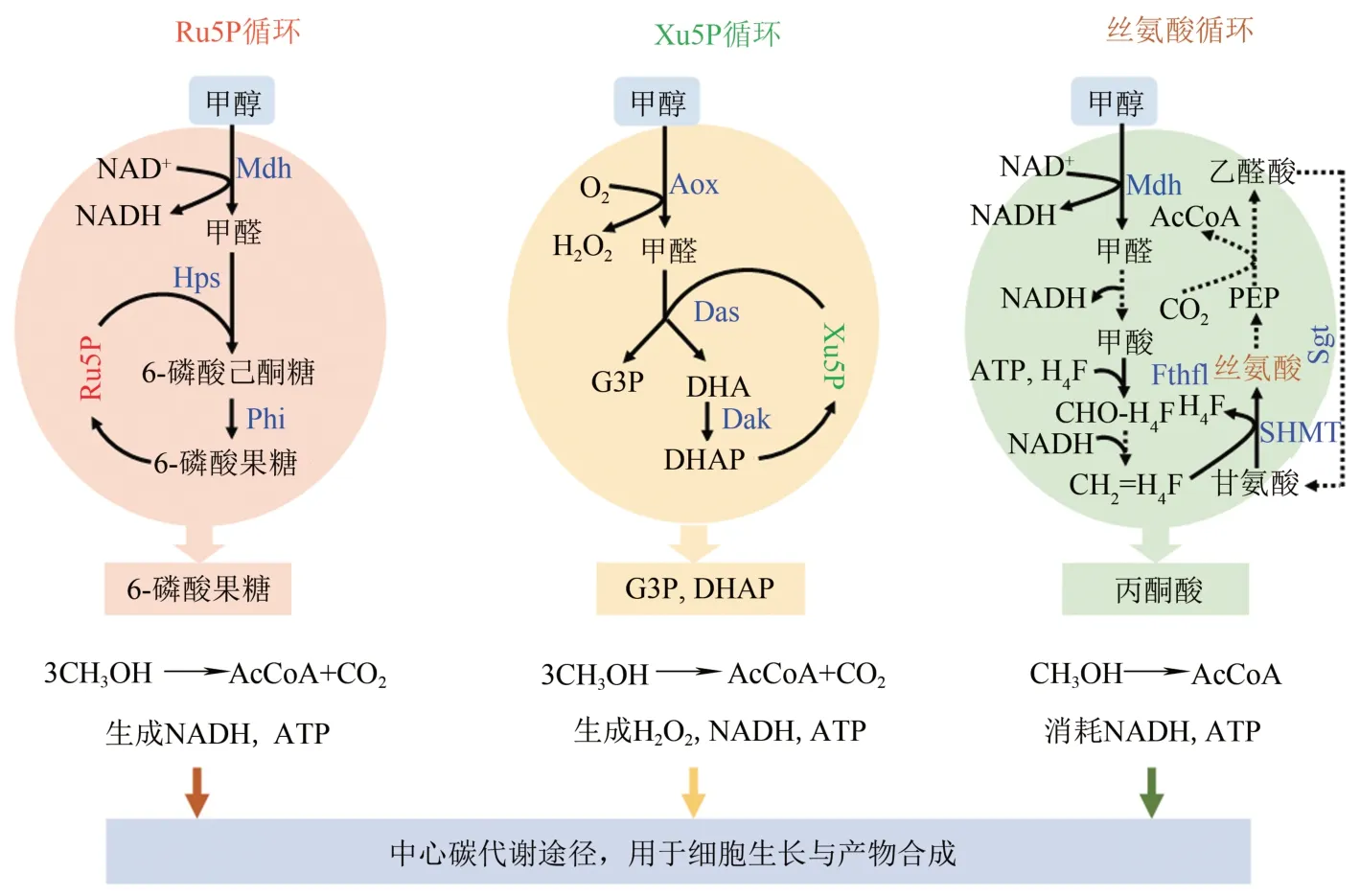
图2 天然甲醇代谢途径Fig.2 Native metabolic pathways for methanol assimilation
2.1 甲醇氧化
甲醇同化过程严格来说开始于甲醛,因此,在所有甲基营养型和能够代谢甲醇的非甲基营养型微生物中,甲醇首先被氧化生成甲醛,进而被同化用于细胞生长和产物合成。
在细菌中,甲醇氧化过程由甲醇脱氢酶(Mdh)催化。在甲醇芽孢杆菌中,存在3 个NAD依赖型Mdh,具有广泛的底物特异性[37]。甲醇氧化生成的还原力以NADH 形式储存,用于细胞其他代谢活动。不同甲醇芽孢杆菌的Mdh 在构象、表达、调控等方面差异较大,导致了其甲醇生长多样性[38],也为人工构建甲基营养型微生物提供了更多可能(表1)。在扭脱甲基杆菌中,Mdh 以吡咯并喹啉醌(pyrroloquinoline quinone, PQQ)作为辅因子,其捕获的电子最终通过呼吸链传递给O2[50]。PQQ 依赖的Mdh 更复杂,而且很多微生物中并不含有PQQ,因此,PQQ 依赖的Mdh 很难用于构建异源甲醇氧化细胞。特别地,一些非甲基营养型微生物也能够完成甲醇氧化过程,其目的是捕获甲醇氧化生成的还原力,并实现甲醇和甲醛的脱毒。比如,谷氨酸棒状杆菌中含有内源甲醇氧化途径,并最终生成CO2。该甲醇氧化过程依赖乙醇代谢相关基因,氧化产物甲酸经甲酸脱氢酶(FdhF)氧化生成CO2[36]。
在甲醇酵母中,甲醇氧化过程相对简单,由醇氧化酶Aox 催化,生成的还原力贮存于H2O2,并进一步被过氧化氢酶分解为H2O 和O2。巴斯德毕赤酵母含有两个醇氧化酶基因AOX1和AOX2,而在多形汉逊酵母中只发现1 个醇氧化酶基因AOX1[51]。
2.2 甲基营养型细菌的甲醛同化及细胞工厂构建
2.2.1 甲基营养型细菌的甲醛同化
甲醇氧化成甲醛后,经甲醛同化途径进入中心代谢,用于提供细胞生长所需前体以及能量。甲基营养型细菌含有两种不同的甲醛同化途径:Ru5P 循环和丝氨酸循环。Ru5P 循环以质粒pBM19/pBM20 形式存在于甲醇芽孢杆菌[52]。甲醛与核酮糖-5 磷酸(Ru5P)发生缩合反应生成6-磷酸己酮糖,进而转化为6-磷酸果糖,二者分别由3-乙酮糖-6-磷酸合成酶(Hps)和6-磷酸-3-己酮糖异构酶(Phi)催化(图2)。甲醛经过Ru5P循环途径合成乙酰辅酶A 进入中心碳代谢过程会导致1分子碳以CO2的形式损失,最大碳得率仅为67%,但同时该过程也会生成NADH 和ATP。丝氨酸循环途径存在于扭脱甲基杆菌中。天然的丝氨酸循环过程十分复杂[53],首先,甲醛在一系列自发反应过程中进一步被氧化生成甲酸;然后,在H4F的参与下形成中间产物CH2=H4F,其与甘氨酸发生反应生成丝氨酸,该过程由该途径关键酶丝氨酸羟甲基转移酶(SHMT)催化;接着,该循环经由甘油酸盐、磷酸烯醇式丙酮酸、草酰乙酸生成苹果酸,苹果酸裂解形成乙酰辅酶A 和乙醛酸盐;最后,乙醛酸重新生成甘氨酸完成整个循环过程。该循环过程不会消耗碳,其理论碳得率为100%。但是,该循环需要大量能量ATP 和还原力NADH参与,会造成碳的氧化消耗。
2.2.2 甲基营养型细菌细胞工厂
天然甲基营养型细菌种类众多,但以甲醇芽孢杆菌(Bacillus methanolicus)和扭脱甲基杆菌(Methylorubrum extorquens)研究最为深入、应用最为广泛,被认为是构建天然甲基营养型细菌细胞工厂的优良宿主。
甲醇芽孢杆菌是革兰氏阳性甲基营养型细菌,因其良好的耐高温特性(最适生长温度50~55oC),成为研究细菌甲基营养型以及进行甲醇转化的优良宿主。近年来,基因编辑工具开发和代谢途径探索使得甲醇芽孢杆菌成为了生产氨基酸及其衍生物的理想菌株[54]。特别是两个代表菌株MGA3 和PB1 的全基因组测序展示了两者在生长、代谢、合成等方面的差异性,为后续改造提供了理论基础[38]。野生型MGA3 能够合成60g/L 的L-谷氨酸和少量L-赖氨酸;而在相同条件下,PB1只能合成1.6g/L 的L-谷氨酸[38]。MGA3 菌株经过突变,L-赖氨酸产量提高到11g/L,同时伴有59g/L的L-谷氨酸。但是,目前无法获得只合成L-谷氨酸或L-赖氨酸单一产物的甲醇芽孢杆菌突变体[39]。最近,甲醇芽孢杆菌代谢工程改造实现了甲醇转化合成γ-氨基丁酸[40]和尸胺[41](表1),拓展了甲醇芽孢杆菌产物谱。
扭脱甲基杆菌属于α-变形菌门好氧细菌,因其易培养、具有完备基因组等多组学信息以及完善的基因操作工具,成为另一个甲基营养型细菌模式菌株[50,55]。扭脱甲基杆菌适于合成以乙酰辅酶A为前体的化合物,特别是甲羟戊酸及萜类化合物(表1)。野生型扭脱甲基杆菌能够通过甲基赤藓糖醇-4磷酸(MEP)途径合成类胡萝卜素,暗示了其具有生产萜类物质的潜力[46]。但是,内源MEP复杂的调控机制可能阻碍产物高效合成。为避开MEP途径的严紧调控,外源引入甲羟戊酸(MVA)途径成为目前萜类细胞工厂的常用策略[56]。因此,构建高产甲羟戊酸的扭脱甲基杆菌平台,将为后续不同萜类物质生产奠定基础。在此基础上,通过人工诱变及实验室适应性进化,提高了甲醇耐受性并进一步提高了甲羟戊酸产量[42]。以此为基础,强化下游合成途径,过表达来源于酿酒酵母的FPP合酶(Erg20)和α-葎草烯合成酶,阻断竞争途径(敲除类胡萝卜素合成途径),α-葎草烯产量达到1.65g/L[46]。除此之外,扭脱甲基杆菌还可以用于合成其他以乙酰辅酶A为前体的化合物,包括一些羧酸类化合物(3-羟基丙酸和2-羟基丁酸)以及短链醇类,如1-丁醇(表1),显示扭脱甲基杆菌在作为细胞工厂方面的应用潜力。
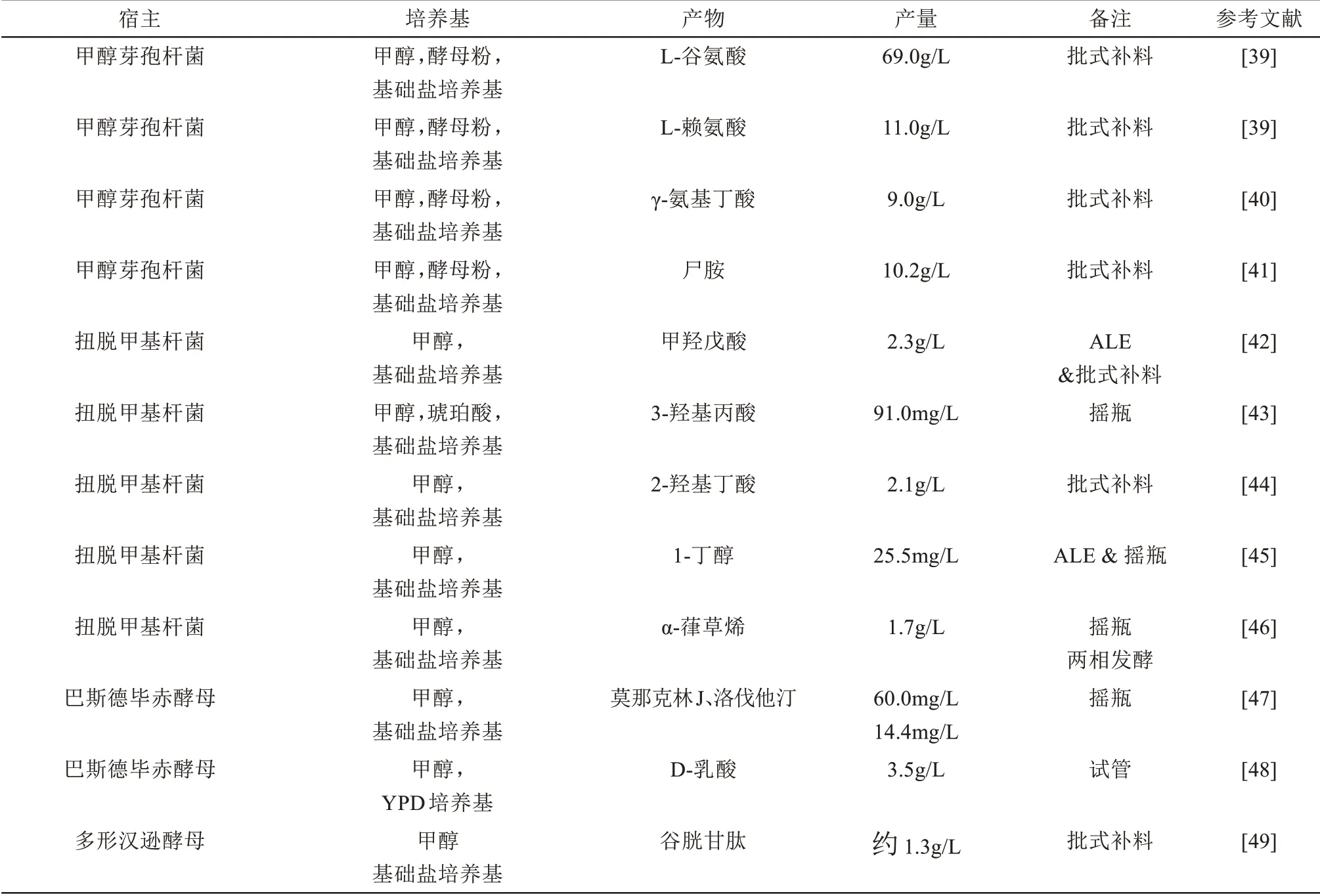
表1 天然甲基营养型细胞工厂构建Tab.1 Construction of cell factories in native methylotrophs
2.3 甲醇酵母甲醛同化及细胞工厂构建
2.3.1 甲醇酵母甲醛同化——Xu5P循环途径
甲醇酵母以Xu5P循环同化甲醇氧化产物甲醛,其过程与Ru5P 类似(图2)。甲醛在二羟丙酮合酶(Das)作用下生成3-磷酸甘油醛(G3P)和二羟丙酮(DHA)。DHA 进一步合成磷酸二羟丙酮(DHAP),该过程由二羟丙酮激酶(Dak)催化。最终产物G3P和DHAP,以及生成的能量和还原力进入糖酵解途径参与细胞代谢过程。但是同样,合成1 分子乙酰辅酶A 进入中心代谢会有1 分子碳以CO2形式流失,该循环最大碳得率也为67%。
2.3.2 甲醇酵母细胞工厂构建
甲醇酵母,以巴斯德毕赤酵母和多形汉逊酵母为代表,广泛用于蛋白表达。然而,甲醇生物转化合成化学品研究还处于起步阶段,相关报道较少,产量较低[57]。与甲基营养型细菌相比,甲醇酵母中存在亚细胞器结构有利于实现代谢途径区域化调控,特别是过氧化物酶体区域化[58],为代谢工程改造提供了新思路。
巴斯德毕赤酵母(Komagataella phaffii)是最重要的蛋白表达宿主之一,其在蛋白表达[57]、遗传工具开发[59]、过程工程优化[59]以及代谢工程改造[57-59]等方面得到广泛研究。尽管毕赤酵母已用于合成多种化合物,但大多都是以葡萄糖等可发酵糖作为底物[57-59]。以甲醇作为底物的报道很少,即使添加甲醇也是用作诱导剂[60](表1)。华东理工大学蔡孟浩团队通过改造毕赤酵母,实现了以甲醇为唯一碳源和能源合成了两种药物分子莫那克林J和洛伐他汀,产量分别为60.0 mg/L 和14.4 mg/L。通过共培养策略及过程工程优化,以甘油为底物的批式补料发酵过程,莫那克林J 和洛伐他汀产量分别达到594 mg/L 和251 mg/L[47]。Yamada 等[48]将D-乳酸脱氢酶整合到毕赤酵母rDNA位点,实现了甲醇到乳酸的生物转化。
多形汉逊酵母(Ogataea polymorpha)是另一种重要的甲醇酵母,具有广泛底物谱,能够天然利用木糖和甲醇等碳源,且能够耐受50oC 以上高温,这些优良特性使其成为一种潜在的优良微生物细胞工厂[61]。汉逊酵母能够天然利用木糖和耐高温的特性,使其长期以来一直作为蛋白表达以及纤维素乙醇发酵的优良宿主[62]。但是,利用汉逊酵母进行甲醇生物转化合成化合物报道较少。尽管汉逊酵母能够在以甲醇为唯一碳源和能源的合成培养基中高效合成谷胱甘肽等蛋白产物[49],但由于组学信息和遗传操作工具的匮乏、甲醇利用与耐受性差以及代谢调控复杂,汉逊酵母甲醇细胞工厂的构建还需要进一步研究。本文作者课题组一直以汉逊酵母作为研究对象,构建了相对完善的基于CRISPR/Cas9 的精准基因组编辑系统,并首次实现了以甲醇为唯一碳源和能源的合成培养基生产脂肪酸及其衍生物。
2.4 存在问题及解决策略
2.4.1 碳损失与能量消耗
天然甲基营养型微生物能够高效利用甲醇进行细胞生长与产物合成,但其甲醇利用途径存在碳损失与能量消耗等问题。RuMP 与XuMP 相似,如果以乙酰辅酶A 为终产物,3 分子甲醇合成1 分子乙酰辅酶A,同时伴有1 分子碳以CO2的形式损失,最大碳得率仅为67%;而丝氨酸途径不会造成碳损失,而且1 分子甲醇还能同化1 分子CO2生成1 分子乙酰辅酶A。但是该过程需要消耗ATP 与NADH,能量消耗在某种程度上也是碳源的损失过程。因此,提高碳得率、减少能量消耗是强化甲醇转化的必然要求。
人工甲醇同化途径构建是一种很好的解决思路(图3)[53,63-65]。Liao 团队提出构建没有碳损失和能量消耗的人工甲醇代谢途径。他们构建的甲醇缩合途径(MCC)将非氧化糖酵解(NOG)与RuMP途径相结合,通过13C 同位素标记证实了其功能,并利用体外无细胞体系合成了乙醇和丁醇等产物[63];随后,江会峰团队设计了合成乙酰辅酶A(SACA)途径,实现甲醇利用,而且SACA途径被证明是迄今为止途径最短、ATP非依赖、碳节省以及氧气不敏感的甲醇同化途径[64]。这些研究为实现高碳得率、能量非依赖的甲醇利用奠定了基础,也为构建人工甲基营养型提供了新思路与工具。
2.4.2 遗传操作工具匮乏
与模式微生物相比,甲基营养型微生物遗传操作工具匮乏,难以实现下游产物合成途径的快速搭建和代谢途径重构。特别是甲醇酵母,其较高的非同源末端连接强度,使得基因组精准编辑存在困难[66]。
近年来,随着CRISPR/Cas9 技术的不断发展,在甲基营养型微生物,特别是甲醇酵母中构建了相对完善的基因编辑工具,极大地提高了其基因编辑效率[66]。均报道了在巴斯德毕赤酵母和多形汉逊酵母中基于CRISPR/Cas9技术的基因编辑系统,基因编辑效率最高分别达到90%以上和70%以上[67-71]。但是,针对提高细胞同源重组效率和降低非同源末端连接强度的策略,尽管尝试了环形donor DNA[70]、引入抗性基因[69]、敲除Ku 蛋白[68,70]以及延长donor DNA同源臂[67],转化效率以及同源重组效率等方面效果不尽如人意。因此,作者课题组尝试构建更加完善的甲醇酵母精准基因组编辑工具。作者分别在巴斯德毕赤酵母和多形汉逊酵母中构建了CRISPR/Cas9体系,将基因编辑效率均提高到90%以上,并且通过提高同源重组结合动态调控非同源末端连接等策略,进一步将二者的同源重组效率分别提高到50%以上(未发表数据)。这些研究将有望解决甲基营养型微生物遗传操作困难的问题,加快对其理论与应用研究进程。
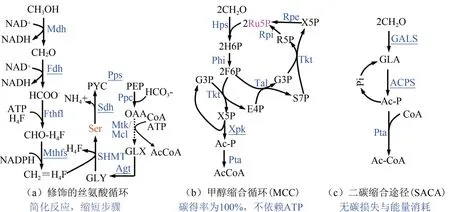
图3 人工修饰/构建甲醇代谢途径Fig.3 Artificial/modified metabolic pathways for methanol assimilation
3 构建非天然甲基营养型微生物
3.1 大肠杆菌
大肠杆菌是研究最为广泛和深入的原核表达宿主,因此,将模式微生物大肠杆菌转化为甲基营养型微生物在理论研究与工业应用领域均具有重要意义。近年来,国内外在人工构建甲基营养型大肠杆菌方面展开了系列研究(表2)。总体来说,更为简单的Ru5P 循环途径受到研究学者的广泛关注,只需表达Mdh、Hps 和Phi 三个酶就可以将甲醇代谢途径引入到大肠杆菌中,实现甲醇同化。13C 标记技术表明,在共培养底物存在的条件下,人工构建甲基营养型大肠杆菌能够同化甲醇,使其进入中心碳代谢途径用于细胞生长和代谢,甚至合成一些目标产物[72-73]。然而,尽管尝试了不同来源、不同组合的甲醇代谢途径,但是获得的重组大肠杆菌始终无法以甲醇为唯一碳源和能源进行生长与代谢,需要添加共利用底物,如核糖、酵母粉、葡萄糖等(表2)。其中,Liao团队[53]首先尝试将扭脱甲基杆菌的丝氨酸循环途径(图3)引入大肠杆菌中。通过简化甲醛氧化步骤,改变氨基供应模式,以及避免羟基丙酮酸作为中间体,重构了丝氨酸循环途径,实现1分子甲醇(甲酸)和1分子碳酸氢盐生成1分子乙酰辅酶A,这个过程消耗3分子ATP和1 分子NADH。尽管所构建的甲基营养型大肠杆菌仍需要木糖作为共底物才能正常生长,这一研究为实现人工甲基营养型提供了新思路。后续研究可以考虑引入不同来源的甲醇代谢途径,甚至人工构建更为理想的全新甲醇代谢途径[63-64]。
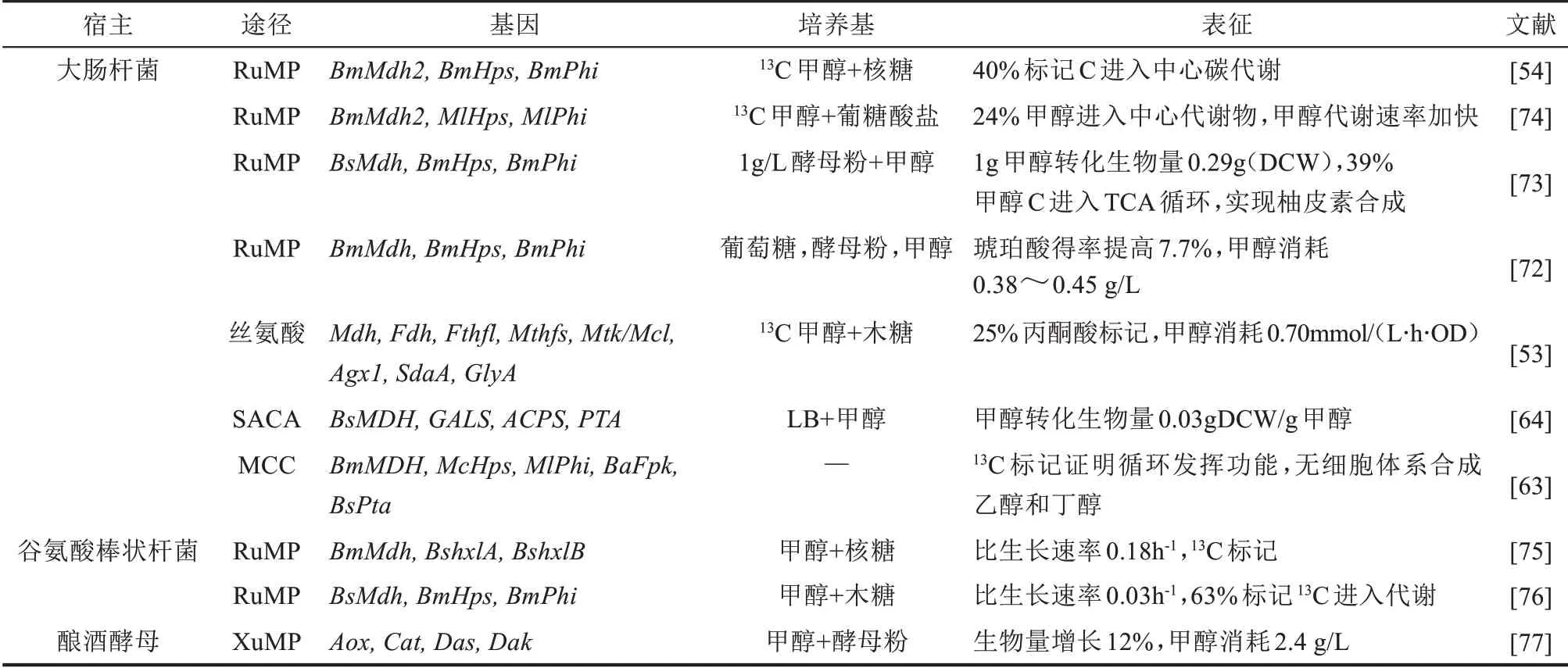
表2 人工构建甲基营养型酵母Tab.2 Construction of artificial methylotrophs
3.2 谷氨酸棒状杆菌
谷氨酸棒状杆菌是一种革兰氏阳性非致病菌,是L-谷氨酸和L-赖氨酸工业化生产的主要宿主[78]。因其具有广泛的底物谱(葡萄糖、果糖、麦芽糖、核糖和蔗糖等)、完善的基因编辑工具以及生理特性,谷氨酸棒状杆菌正逐渐成为构建人工甲基营养型微生物的优良宿主[79]。
为了避免内源甲醇氧化和甲醛脱毒,需要敲除某些脱氢酶(Ald、FadH、AdhE、FdhF等)[36,75-76]。Ru5P循环依然是构建甲基营养型谷氨酸棒状杆菌的首选方案,通过过表达不同来源的Mdh、Hps 和Phi,尽管能够使酶在细胞内正常表达并发挥功能,但依然无法实现以甲醇为唯一碳源和能源的细胞代谢过程,同样需要添加核糖或木糖作为共同碳源[75-76]。特别地,孙际宾团队[75]通过表达木糖还原酶(xlyA)并敲除核糖磷酸异构酶(Rpi),实现了甲醇和木糖的共利用,并结合实验室适应性进化,进一步提高了共利用条件下细胞的生长速率。
3.3 酿酒酵母
酿酒酵母,作为真核微生物的模式菌株,因其良好的基因操作性能,被广泛应用于细胞工厂构建[80]。作为人工甲基营养型宿主,酿酒酵母的甲醇耐受能力是大肠杆菌和谷氨酸棒状杆菌等原核细菌无法比拟的[81]。南京工业大学首先尝试将毕赤酵母甲醇代谢途径整合到酿酒酵母细胞,分别在单独甲醇培养基和甲醇+1 g/L酵母粉培养基中观察细胞生长与甲醇消耗情况。尽管酵母粉能够促进甲醇利用及细胞生长,但是基于甲醇的细胞生长还有待进一步优化[77]。
3.4 甲醇利用强化
无论是原核细菌,如大肠杆菌和谷氨酸棒状杆菌,还是真核酵母,如酿酒酵母,人工构建的甲醇利用途径均无法实现以甲醇为唯一碳源和能源的细胞生长与代谢。这其中的瓶颈问题亟待解决,其中之一是甲醇到甲醛氧化效率。一方面,异源表达Mdh活性不足,这可以通过寻找不同Mdh来源以及酶的定向进化等策略解决[82-83];另一方面,以NADH 为辅因子的氧化过程在热力学上存在挑战。例如,在大肠杆菌中,当甲醇浓度为250mmol/L,NAD:NADH 为31.3:1 时,在热力学上该反应达到平衡时的甲醛浓度只有50μmol/L[84]。也就是说,只有保证甲醛的快速同化才能产生源源不断的反应驱动力保证甲醇的正常利用。因此,探究甲醛快速利用的代谢工程策略对甲醇的利用过程至关重要。
(1)共利用底物。除了表2 中展示的共利用底物,氨基酸,特别是苏氨酸也是一种重要的甲醇共利用底物,而且氨基酸的合成与分解调控(如亮氨酸响应的调控蛋白Lrp)也对提高甲醇利用效率十分重要[85]。同时,通过构建“合成甲醇营养缺陷型”也能够进一步推动甲醇与木糖/核糖的共利用过程。当细胞无法以木糖/核糖为碳源进行生长时,会迫使细胞增强在甲醇存在条件下的木糖/核糖利用,从而促进三者之间共利用过程[86]。
(2)增加前体供给。以甲醇为唯一碳源和能源的基础培养基进行生长与代谢是构建人工甲基营养型微生物的最终目标。目前,人工甲基营养型微生物需要木糖或者核糖等共底物生长,作者推测人工甲基营养型微生物的甲醇利用障碍可能是前体循环物质Ru5P/Xu5P不足[84,87-88]。因此,调控磷酸戊糖途径的非氧化部分有可能强化甲醇利用。研究表明,该途径关键酶(Rpe,Fba,GlpX,Pfk 和Tkt)能够通过糖异生途径和PPP 途径增加前体供给[87-88]。特别是,景天庚酮糖二磷酸酶(由GlpX编码),既能够催化1, 6-二磷酸果糖生成6-磷酸果糖的糖异生过程,又能够催化景天庚酮糖二磷酸与景天庚酮糖-7 磷酸之间的转化过程,在增加前体供给方面至关重要[84]。除此之外,弱化糖酵解途径也是增加前体供给的有效策略[87]。
(3)甲醛诱导型启动子。构建实时响应甲醛浓度的甲醛同化途径,避免甲醛积累,有望降低甲醛毒性并且提高其同化效率。大肠杆菌中存在内源甲醛响应启动子Pfrm,其在正常条件下与抑制子FrmR结合不会启动下游基因表达。而在甲醛存在条件下,FrmR优先与甲醛结合,从而解除启动子Pfrm抑制,启动下游基因表达。将这一Pfrm-FrmR系统应用于甲醇代谢途径构建,能够有效提高甲醇的利用效率[89],该策略为甲基营养型微生物构建及动态调控提供了参考。
4 机遇与挑战
在化工领域,甲醇转化合成化工产品产业已经十分成熟,特别是近年来发展甲醇制烯烃充分证明了甲醇作为原材料的应用价值[3]。而甲醇的生物转化有望高选择性合成结构更加复杂的含氧化合物,将能拓展生物炼制原料以及甲醇转化的产物谱,成为化工路线和生物路线的有机链接。
目前,国内外学术界和产业界均越来越重视甲醇生物转化研究[7]。从合成生物学角度,天然甲基营养微生物细胞工厂和人工甲基营养微生物细胞工厂两种研究策略和思路相辅相成、互为补充,共同提升甲醇生物转化效率(图4)。一方面,以天然甲基营养型微生物为对象,构建下游生物合成途径(由上至下)。该过程为构建人工甲基营养型提供元件和反应机制,但同时面临着代谢途径机理不清晰、遗传操作工具匮乏等瓶颈;另一方面,以模式微生物为研究对象,构建上游甲醇同化途径(由下至上)。模式生物相关代谢途径研究深入,遗传操作成熟,能够用于评价甲基营养型微生物的甲醇代谢相关模块,从机理研究角度全面解析甲醇代谢特性。但是,无论哪种研究模式均面临着甲醇利用效率、底物与产物耐受等关键科学问题。
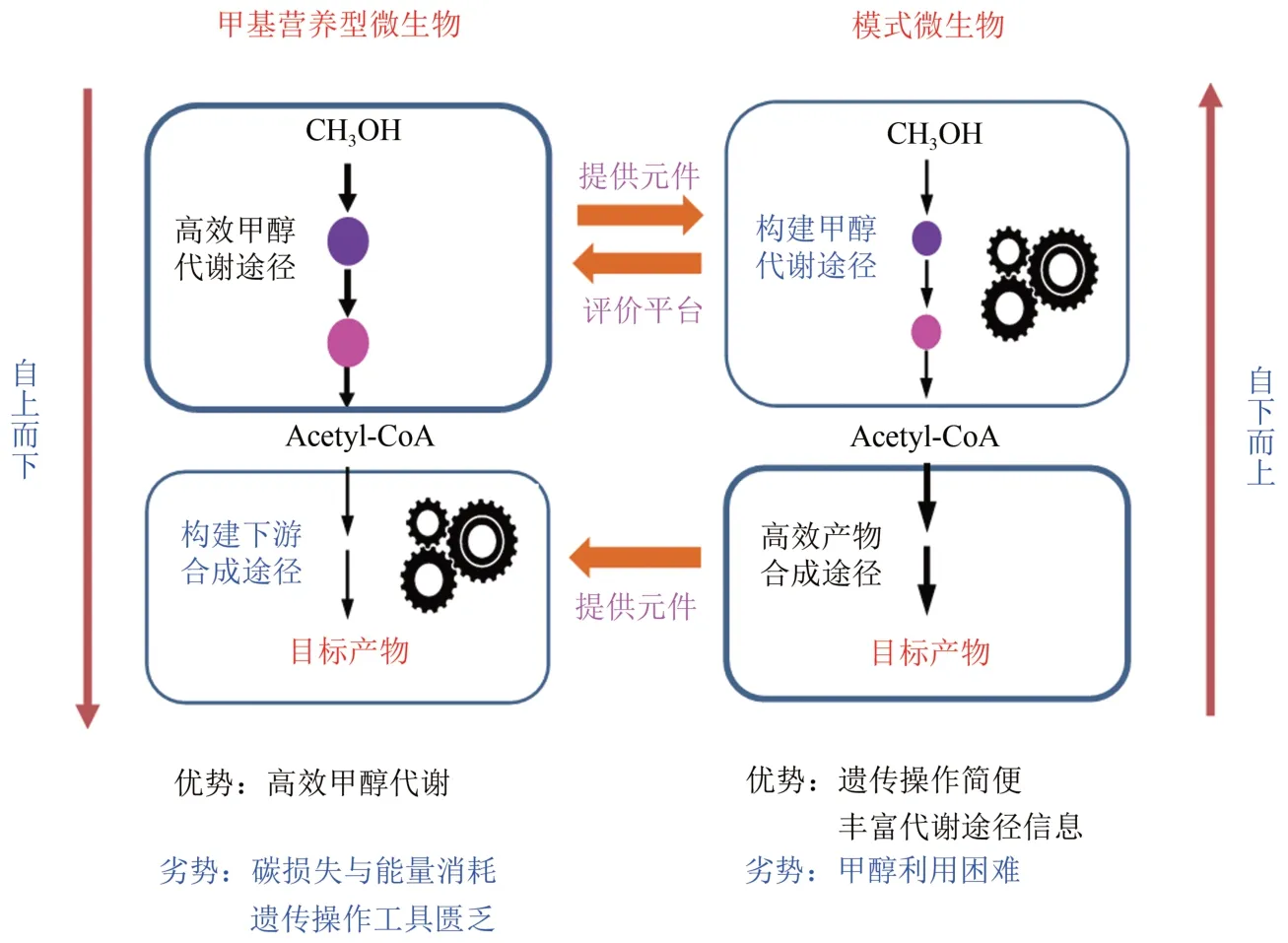
图4 天然/人工甲基营养型微生物合成生物学研究策略Fig.4 Strategy of synthetic biology for studying native/artificial methylotrophic microbes
首先,甲醇利用效率问题。天然甲基营养型微生物有待进一步提高甲醇利用效率,特别是甲醇同化后到产物合成的衔接;而人工甲基营养型微生物目前还不能以甲醇为唯一碳源和能源进行生长与代谢。这一问题,可以采用上述策略尝试解决,包括共利用底物、强化前体供给以及动态调控等。同时,实验室适应性进化是一种有效策略[42,45]。
其次,底物和产物耐受问题。甲醇和甲醛对细胞有较强毒害作用,工业化生产高生产强度要求提高细胞对底物耐受能力。真核酵母对甲醇底物耐受能力要强于原核细菌[77],这可能主要归功于真核细胞区室化隔离作用。甲醇酵母的甲醇代谢过程主要在过氧化物酶体中进行,在一定程度上降低了底物毒害作用。而且,真核酵母区室化特性对提高产物耐受能力也至关重要,将有毒产物靶向线粒体、过氧化物酶体等细胞器能够显著提高产物耐受能力,从而提高产量[90]。
最后,实验室适应性进化。实验室适应性进化结合反向代谢工程是一种提高微生物特定表型的有效策略[91-92],在促进甲醇利用[42]与增加底物和产物耐受[45]等方面发挥了重要作用。进化过程最关键的因素是“突变优势”[91],而由甲醇或者产物造成的生长缺陷是最佳的筛选压力。
总之,随着甲醇合成与转化产业的不断发展,以天然/人工甲基营养型微生物进行的甲醇生物转化过程必将成为一种全新的生物合成体系,成为可再生资源生产与利用的重要组成部分。

