枯草芽孢杆菌底盘细胞的设计、构建与应用
林璐,吕雪芹,刘延峰,堵国成,陈坚,刘龙
(1 江南大学糖化学与生物技术教育部重点实验室 江苏 无锡 214122; 2 江南大学工业生物技术教育部重点实验室 江苏 无锡 214122)
合成生物学是在基因工程的基础上整合了电子学、计算机学、数学等多门学科的内容,主要通过DNA 合成、代谢途径的组装和基因回路的设计等方面来构建新的代谢途径,或者从头合成全新的微生物基因组[1]。代谢工程旨在优化和重编程细胞代谢网络来增强目标产物的合成或赋予细胞合成新的生物化学品,侧重先整体分析,后局部分析,再到代谢节点进行遗传改造[2]。近年来,基于合成生物学方法和代谢工程技术构建的微生物底盘细胞已经被广泛应用于生产各种天然高附加值化学品、优质清洁能源和生物材料[3]。
作为一种典型的革兰氏阳性细菌和模式工业微生物,枯草芽孢杆菌(Bacillus subtilis)具有非致病性、强大的胞外分泌蛋白能力以及无明显的密码子偏爱性等优点,并且是一种GRAS(generally recognized as safe)级食品安全宿主菌,在功能营养品、精细化学品和酶制剂的生产中具有广泛应用[4]。然而,相较于大肠杆菌(Escherichia coli),B. subtilis底盘细胞的开发还存在较明显的滞后[5]。因此,设计和构建性能优良的B. subtilis底盘细胞具有重要的科学意义与应用价值。本文作者针对近年来B.subtilis底盘细胞的设计和构建策略进行了系统的总结和讨论(表1),并通过五个案例详细介绍了B. subtilis底盘细胞的实际应用,最后对B.subtilis底盘细胞的发展趋势进行了展望。
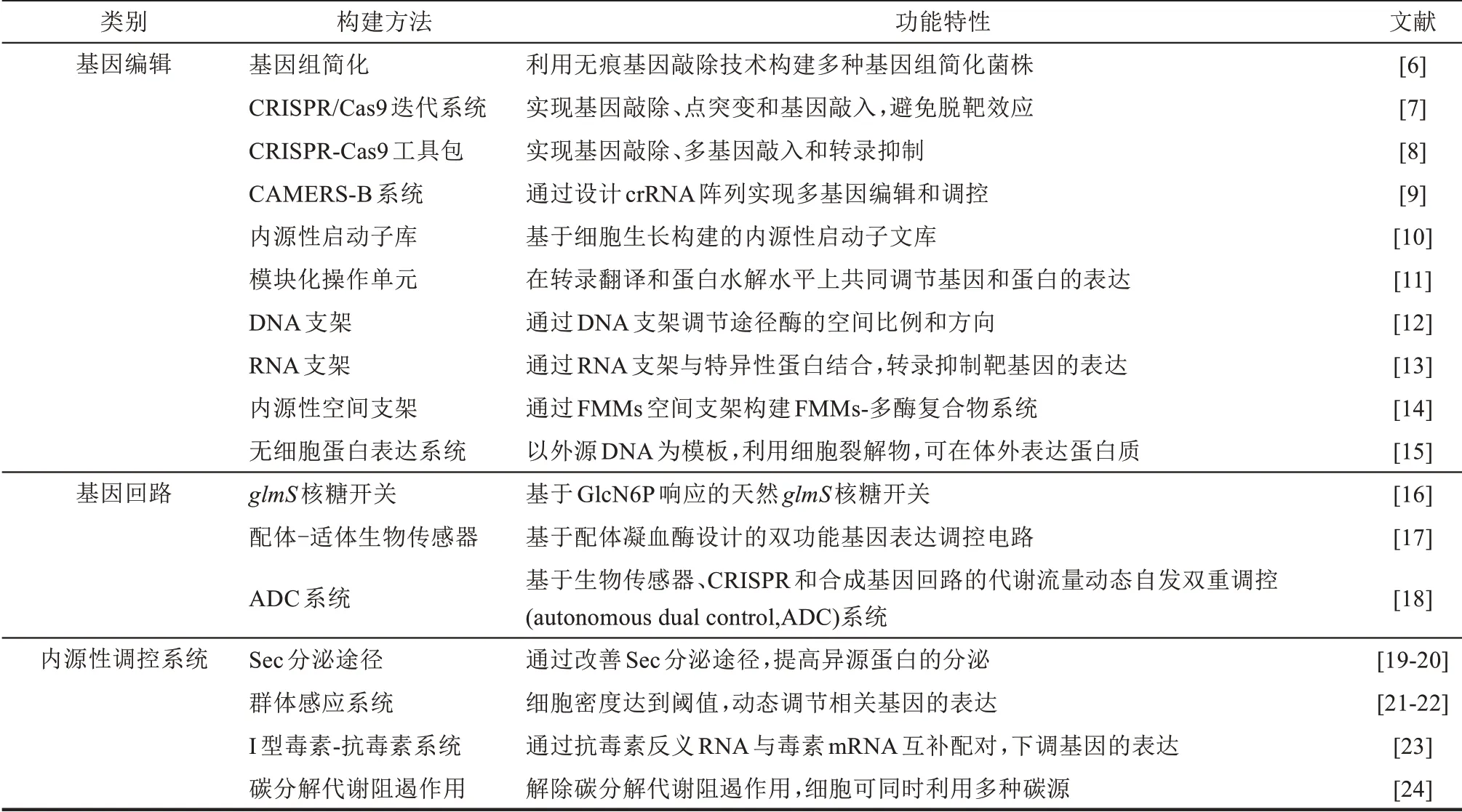
表1 B.subtilis底盘细胞的构建方法Tab.1 Methods for the construction of chassis cell in B.subtilis
1 基于基因编辑的B. subtilis底盘细胞
1.1 基因组简化技术
近年来,最小基因组的研究加深了人们对B.subtilis细胞功能及生命进化规律的认识。然而,最小基因组的底盘细胞通常只能维持细胞的基本代谢,并不一定具有生长快、抗逆性强等有利性状[25]。因此,需要针对性地简化B. subtilis基因组,去除非必需代谢途径的干扰,以降低基因组的复杂度,提高B.subtilis对底物和能量的利用效率以及细胞遗传稳定性和生理表型的可控制性,使其作为生产天然代谢产物或表达异源蛋白的理想宿主细胞。在过去的十多年里,研究人员利用同源重组技术敲除B.subtilis基因组的非必需基因,自上而下获得了一系列B.subtilis基因组简化菌株。Westers等[26]通过删除B.subtilis基因组上5 个噬菌体区域(SPβ、PBSX、pro1、pro6、skin)和pks操纵子区域,获得了一个缺少7.7%基因组的B.subtilisΔ6 突变株,相比野生型B. subtilis168,B.subtilisΔ6 的细胞表型没有明显的变化。Takuya等[27]也通过基因敲除的方法,从亲本菌株MGB469 中删除了11 个长度在11~195 kb 的可分配区域,获得了一株缺失874 kb(20%)基因序列的基因组简化菌株B. subtilisMGB874。与亲本菌株相比,MGB874 在LB 培养基中与亲本菌株具有相似的生长速率。但在碳源利用方面,MGB874菌株具有较高的麦芽糖利用率。有趣的是,将用于表达纤维素酶和蛋白酶的质粒(pHYS237 和pHP237-K16)转化到MGB874 菌株后,两种酶的活性分别比亲本菌株高出1.7 倍和2.5 倍。研究人员进一步通过转录组学分析发现,MGB874菌株基因表达的转录调控在指数生长过程中受到干扰,进入稳定生长阶段后出现重组。尽管尚不清楚这种重组现象是多重基因缺失引起的转录调控协同作用,还是转录调控中的几个重要转录因子导致,但MGB874 菌株进入稳定期后基因表达调控出现重组,从而可以提高胞外纤维素酶和蛋白酶的活性,有助于开发用于生产其它工业酶的B. subtilis底盘细胞。而基于转录组学的分析,即通过基因功能信息和比较基因组学方法引入合理的基因缺失,以期产生可预测的细胞,可为B.subtilis底盘细胞的开发提供新思路。
最近,李扬[6]利用无痕删除技术逐步删除了B.subtilis168 基因组上的4 个噬菌体区域(pro1~6、spβ、skin、PBSX)、2 个操纵子区域(pps、pks)以及基因组上的部分非必需基因(ycxBsipU、 yisB-yitD、 pdp-rocR、 yrkS-yraK、 yybPyyaJ、ydeK-ydjC、lytH-yurT、sboA-ywhH),获得了一系列精简程度不同的基因组简化菌株。在此基础上,以代表性基因组简化菌株作为底盘,分别引入特定目标产物的途径修饰,可以获得生产不同代谢产物的B.subtilis底盘细胞。比如,引入acoA、bdhA基因缺失突变,与同等修饰的对照菌株相比,基因组简化菌株产乙偶姻的产量和得率均有所提高;在简化菌株BSK756、BSK814 和出发菌株BSF1 中,敲除purA基因,过表达prs、purF和guaB基因,菌株BSK814G2 的鸟苷产量达到115.2 mg/L,是对照菌株的4.4 倍;以简化菌株BSK756 为对象,引入胸苷合成相关基因修饰,敲除tdk基因,过表达prs、ushA、thyA、dut和ndk基因,菌株BSK756T3 的胸苷产量达到151.2 mg/L,相比野生型菌株增加了5.2 倍;在简化菌株BSR563 的基础上,过表达purF基因和pur核黄素操纵子,获得了BSR563R5 菌株,与对照菌株BSR0R5 相比,核黄素的产量增加了77%。因此,在基因组简化菌株的基础上,引入特定产物的途径修饰,可以构建用于生产天然代谢产物的B.subtilis底盘细胞。
1.2 CRISPR基因编辑技术
通过传统Cre/loxP等同源重组产生的基因组缺失片段依赖于抗性基因的插入,并且在去除靶基因后,基因组上会留下一段外源DNA 痕迹,这在一定程度上影响了B.subtilis在食品发酵方面的应用。基于间隔短回文重复序列(clustered regularly interspaced short palindromic repeat sequences,CRISPR)的基因编辑工具是目前最受欢迎的一种基因编辑技术,利用CRISPR 技术可以对微生物进行多基因的精确编辑和调控。CRISPR 基因编辑系统是通过引导RNA(sgRNA)引导Cas 蛋白(如Cas9、Cpf1等)定位到靶基因位点,随后Cas蛋白在基因组的特定位点对DNA 进行切割,造成DNA双链断裂(double strand break,DSB),在同源性定向修复(homology-directed repair,HDR)过程中通过同源臂将特定修饰的片段引入基因组,从而实现基因的敲除、插入或突变,这种方法克服了传统同源重组的不足,可以在E. coli和B.subtilis等模式菌株产生无外源DNA 痕迹的突变体[28]。
利用CRISPR 编辑技术,研究人员通过设计多种sgRNA 同时定位到多达6 个不同的靶基因位点进行基因编辑,编辑效率从2%到90%不等[29]。此外,将核酸缺陷型蛋白(dCas蛋白)与CRISPR蛋白的功能结构域融合可以实现对靶基因的转录激活和抑制作用[30]。因此,CRISPR这项编辑技术为设计和构建B.subtilis底盘细胞提供了一个有效的技术前提,可以对B.subtilis基因组上的任意基因进行编辑或调控。
1.2.1 CRISPR/Cas基因编辑系统
尽管应用CRISPR/Cas9 系统可以敲除B.subtilis的基因组大片段,但CRISPR 系统的脱靶效应使得敲除基因片段的效率很低。为提高基因敲除的效率,So 等[7]通过将靶基因ppsA和ppsE的sgRNA 设计在一起, 可以使pps操纵子(ppsABCDE)的N 端和C 端都产生DSB,导致CRISPR/Cas9介导的基因组大片段敲除的效率提升至16.7%,相比通过反选择标记系统[31]导致pps操纵子缺失的效率(6.4%)更高。为进一步提高pps操纵子的敲除效率,研究人员构建了由包含Cas 蛋白(SpCas9)和靶向基因sgRNA 的质粒pHCas9 以及包含供体DNA 模板的质粒pBOA 构成的迭代系统,将pHCas9 和pBOA 转入B. subtilis168 中可以产生稳定的SpCas9/sgRNA 核酸内切酶复合物,它能在适当的选择压力下长时间孵育,导致“反复”靶向敲除区域,使DSB 发生在靶标区域上,直到产生所需的基因缺失片段为止,最终使pps操纵子的敲除效率提高至80%。此外,应用这种迭代系统还可以使单基因敲除效率高达100%,使点突变效率达到68%,以及使基因敲入效率达到97%。这项研究通过pHCas9 和pBOA 两个质粒构建的迭代系统,有助于高效编辑B.subtilis基因组上的各种基因。
1.2.2 CRISPRa/CRISPRi基因调控系统
目前已有各种RNA 修饰的基因调控工具,如顺式核糖开关[32]、反义RNA(asRNAs)[33]或其他非编码RNA(sRNAs)[34]用于募集蛋白的结构域,以调节基因的表达,但是这些工具存在一定的局限性。比如,顺式核糖开关需要对靶基因的上游序列进行修饰;合成asRNAs 需要筛选大量的内源性调控RNA,这种筛选过程需要耗费大量时间,从而限制了其在代谢工程和遗传筛选中的应用。而在CRISPRa/CRISPRi 系统中(图1),缺陷型核酸酶(dCas 蛋白)不切割DNA,而是与转录阻遏域融合,形成的RNA-蛋白质复合物被引导到靶基因的转录起始位点(TSS)以抑制其转录[35];或与支架RNA(scRNA)结合,scRNA 是一种修饰的gRNA,既编码靶序列又编码RNA 发夹,它可以募集转录激活因子或与转录激活域融合,使RNA-蛋白质复合物在TSS 位点激活靶基因的转录[36]。
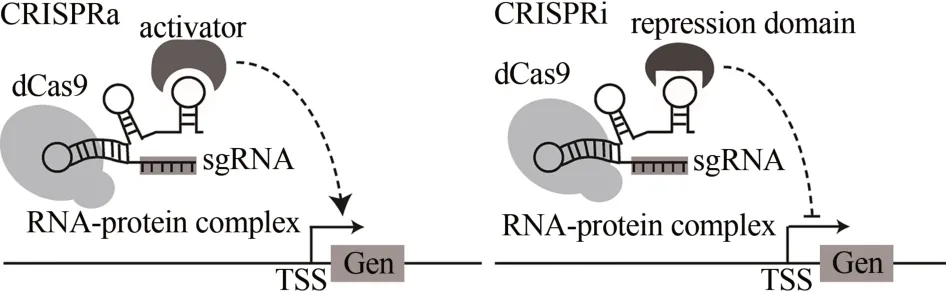
图1 CRISPRa/CRISPRi系统转录激活和抑制的示意图Fig.1 Transcriptional activation and inhibition by the CRISPRa/CRISPRi system
(1)CRISPR-Cas9 工具包随着CRISPR 技术的不断发展,CRISPR/Cas9系统已被用于多基因的编辑和调控中。最近,Westbrook 等[8]开发了用于B. subtilis基因编辑的CRISPR-Cas9 工具包,可实现靶向单基因敲除、多基因敲入、连续基因组编辑和基因转录抑制。首先,研究人员展示了基于反选择标记的新型gRNA转录和传递系统的高编辑效率,该程序具有连续基因组编辑的能力,包括用于基因敲除和特异性突变的基因敲入。随后,研究人员通过Biobrick 组装方法构建了一个多gRNA 传递载体,能同时编辑基因组靶标amyE和ugtP;最后,研究人员将gCas传递载体与dCas9一起用于转录干扰,将异丙基-β-D-硫代半乳糖吡喃糖苷(IPTG)诱导的lacZ基因整合至ugtP基因座,通过木糖诱导表达dCas9后,实现了lacZ的转录抑制。这项研究设计的CRISPR-Cas9 工具包为B.subtilis多基因编辑提供了一种技术工具,可以应用到B.subtilis的代谢调控中。
(2)CAMERS-B 系统 CRISPR/Cas 系统除利用Cas9 蛋白外,还可以利用Cpf1 蛋白进行基因调控。Cpf1 蛋白可以将前体CRISPR RNA(precrRNA)加工成成熟的crRNA,并且不需要反式激活crRNA(tracrRNA),因此,可以通过设计crRNA 阵列实现多基因编辑和调控[37]。最近,Wu等[9]通过设计crRNA 阵列在B.subtilis中构建了一种基于CRISPR/Cpf1 的多基因编辑和转录调控系统(CAMERS-B),不仅可以实现B.subtilis中双基因敲除、多点突变或单基因插入,还可以对多个基因进行转录抑制和激活。首先,研究人员创建了一种 SOMACA (synthetic oligos mediated assembly of crRNA aArray)方法来组装crRNA,将crRNA 阵列和同源修复模板构建到pcrF11 质粒中。同时,将来源于Francisella novicidaU112 的Cpf1和来源于Natronobacterium gregoryi的Argonaute 蛋白(NgAgo)突变体一起引入到B.subtilis和E.coli的穿梭质粒pHT01 上,构建了可用于多基因编辑的pHT-XCR6 质粒。最后,通过B. subtilis非必需的蛋白酶基因(aprE、epr、nprE、bpr、mpr和nprB)验证了该系统的多重基因编辑效果,可以实现B.subtilis中双基因敲除、多点突变和单基因插入。为同时实现转录抑制和激活功能,研究人员进一步将包括B. subtilis的I类转录激活因子(AbrB、ComA、MalR、ManR、RemA 和Spo0A)、B. subtilisRNA 聚合酶亚基(RpoE 和RpoZ)、E.coli来源的转录因子SoxS 以及B. subtilis噬菌体phi29 的P4 蛋白在内的10 种激活蛋白,分别融合到dCpf1的C端,并使用组成型启动子P43来表达荧光蛋白sYFP2、mKate2 和mTagBFP2,以测试上述融合蛋白的多基因调控能力。结果发现,dCpf1 融合RemA 的激活强度最高,随后,利用设计的crRNA 阵列,进一步证实了dCpf1-RemA 融合蛋白具有同时抑制和激活B. subtilis多个基因的能力。最后,将该CAMERS-B 系统用于调控N-乙酰氨基葡糖(N-acetylglucosamine,GlcNAc)和乙偶姻的合成途径。在GlcNAc 合成途径中,将编码6-磷酸氨基葡萄糖乙酰转移酶的基因GNA1整合到B.subtilis168 基因组中,并使用强启动子Pveg替换编码GlcN-6-磷酸合酶的基因glmS的启动子和核酶区域,获得了WGN2 菌株。在此基础上,利用CAMERS-B 系统进一步敲除GlcNAc的分解代谢基因(nagA、nagB、nagP和gamA)以及合成乳酸和乙酸的基因(ldh和pta),GlcNAc 的产量增加了1.51 倍,达到2195 mg/L。另外,在乙偶姻合成途径中,选择分解乙偶姻代谢途径的基因(bdhA和acoA)以及合成副产物乳酸和乙酸的基因(ldh和pta)作为转录抑制的靶标,选择乙偶姻合成途径中的途径基因alsSD及其转录激活因子的基因alsR作为转录激活的靶标。通过构建针对bdhA、acoA、ldh、pta和alsR的crRNA 阵列,实现了CAMERSB 系统在乙偶姻合成相关途径中的转录抑制和激活,从而使乙偶姻的产量提高了44.8%,达到25.8g/L。因此,CAMERS-B 系统不仅具有用于改造B. subtilis生产多种营养化学品的潜力,还为B.subtilis的基因组编辑和代谢工程改造提供了一种有效的工具。
1.3 基因调控元件与基因回路的设计
1.3.1 基本调节元件
在合成生物学中往往需要不同的调节元件作用于基因的转录和翻译阶段,以调控基因或蛋白的表达。因此,启动子、核糖体结合位点(RBS)、SD 序列和终止子等基本调节元件的优化是调节相关基因和蛋白表达的基础。其中,启动子是决定转录和表达的重要遗传物质,可以对B.subtilis上的基因进行不同程度的调节(表2)。例如,Song等[10]通过对B.subtilis内源性启动子的挖掘可以筛选出具有抗逆性的菌株,能在环境胁迫条件下(渗透压、高盐或高温)维持细胞生长和产物表达。研究人员具体是通过筛选B.subtilis中热激蛋白、细胞膜蛋白和对有毒金属具有抗性的蛋白的启动子,以绿色荧光蛋白GFP 为报告蛋白,经过热休克、高盐或乙醇处理后,考察不同启动子在环境胁迫条件下相较于P43启动子的强度。结果表明,大多菌株在高渗透压下培养时显示出增强的荧光活性,并且强启动子PtrnQ表达的胞质蛋白β-半乳糖苷酶和α-淀粉酶的活性相比P43表达这两种酶的活性都有显著增强。另外,除优化基本调节元件外,还可以组合优化不同的调节元件,使它们在转录翻译或蛋白水解水平上共同调节基因的表达。比如,Guiziou 等[11]利用组成型启动子、RBS和SsrA 蛋白质降解标签文库,构建了一个模块化的表达操作单元,使GFP 的表达水平展现了约14 000 倍的动态范围,GFP 浓度从0.05 μmol/L 到700 μmol/L跨越五个数量级。因此,利用这个表达操作单元,可以不同程度地调节B.subtilis代谢途径上相关基因的表达。

表2 B.subtilis表达系统常用的启动子Tab.2 Common promoters for the B.subtilis expression system
1.3.2 空间支架
(1)核酸支架核酸分子作为遗传信息的载体具有很多优势,比如,通过锌指蛋白(zincfinger protein, ZFP) 或类转录激活因子(transcription activator-like effectors,TALEs)的核酸结合结构域,可以提供DNA/RNA-蛋白质的相互作用,核酸分子短链可折叠形成各种结构或组装成二聚体或多聚体,从而形成各种特定可编程的三维空间结构。因此,利用核酸分子自我组装形成的生物支架,具有很好的功能扩展性,比如,可以用于制作纳米生物材料,或用作向人体递送抗病药物的“桥梁”[55]。在合成生物学中,基于核酸分子构建的DNA 支架[56]和RNA 支架[57]被广泛用于酶的空间组装以调节途径酶的比例和方向,提高酶的催化效率;或用于募集特异性蛋白,调控合成途径上相关基因的表达。
DNA 支架用于途径酶的空间组装是一种具有潜力的翻译后策略,通过调节酶的化学计量数,可以控制合成途径中相关途径酶的代谢通量[58]。例如, Liu 等[12]利用DNA 支架对B. subtilisGlcNAc 合成途径的两种关键途径酶的基因glmS和gna1在空间上按照1∶2 的比例进行组装优化后,能有效增强这两种途径酶的协同催化作用,使GlcNAc 的产量提高至4.55 g/L。这可能是由于DNA 支架促进了途径酶在空间上的相互作用,控制了中间代谢物的有效浓度,最终增加了目标代谢产物的积累。
RNA 支架是一种人工合成的非编码RNA 分子,通过碱基配对规则进行合理设计,可以折叠形成具有不同特征的适体结构域,以募集通路酶或特异性蛋白来调控微生物的合成代谢[59]。比如,在CRISPRa-CRISPRi 基因编辑系统中,就是通过设计合适的RNA 支架,使支架上的适体域募集相应的转录因子,形成的RNA-蛋白质复合物被引导到转录起始位点以激活或抑制靶基因的转录[60]。此外,由于来源于E. coli的MicC sRNA 支架形成的二级结构可以有效阻断mRNA 翻译,同时MicC sRNA 支架可以通过结合Hfq 蛋白增加抑制效率[61]。基于此,Liu 等[13]将RNA 支架成功应用于B.subtilisGlcNAc 合成途径酶的调控上,通过设计anti-pfksRNA和anti-glmMsRNA与Hfq共表达,能有效抑制GlcNAc 合成竞争途径中糖酵解和肽聚糖合成模块的活性,单位细胞GlcNAc 产率达到2.0 g/g(以干细胞重计)。因此,将核酸支架用于B.subtilis中来调节途径酶的比例或通过与特异蛋白结合用于调控合成途径相关基因的表达方面,具有很大的操作空间。
(2)基于功能膜微域的内源性空间支架由于现有的空间支架都是通过外源设计引入的[13,62],容易造成细胞代谢负担或者引起代谢过程不稳定,因此,如果利用细胞自身结构类物质,设计和构建代谢负担小、生产过程稳定的三维空间支架来进行途径酶的空间组装,可以避免细胞代谢负担。在B. subtilis中, 功能膜微域(functional membrane microdomains,FMMs)的存在使质膜发生区域化,且FMMs 可以作为蛋白和酶的聚集平台[63]。最近,Lv等[64]发现FMMs具有较好的时空稳定性,可以用作组装途径酶的内源性空间支架。基于此,研究人员以B.subtilis 合成GlcNAc 为例,通过脚手架蛋白及其特异性结构域-SPFH(stomatin-prohibitin-flotillin-HflC/K) domain 将GlcNAc合成所需的途径酶(GNA1,GlmS,Pgi和YqaB)依次锚定在FMMs 空间支架上获取FMMs-多酶复合物系统,发现该系统可以显著提高GlcNAc 的产量[14]。进一步结合代谢模型和动力学分析发现,GlcNAc 产量提高的主要原因是FMMs-多酶复合物系统的存在可以形成一条较完整的底物通道,进而增加显著酶的催化效率。此外,研究人员还发现FMMs-多酶复合物系统不仅可以显著提高产物的产量,而且随着SPFH domain表达量的增加,发酵后期细胞的裂解情况得到了明显的缓解,很可能是因为SPFH domain的过表达有利于FMMs结构的稳定,而FMMs的稳定则可以增强细胞对微环境的适应性。
1.3.3 基因回路
基因回路是通过设计或改造生物调控元件,使细胞感应中间代谢物或信号分子的变化,从而自动控制代谢途径上相关基因的表达[65-66]。近年来,基于适配体的生物传感器被广泛用于动态调节产物代谢途径上相关基因的表达[67-68]。例如,Niu 等[16]通过改造天然氨基葡萄糖-6-磷酸(GlcN6P)响应的glmS核糖开关及其突变体,可以动态控制GlcNAc 合成竞争途径中糖酵解和肽聚糖合成模块的代谢通量,提高了B. subtilis中GlcNAc的产量。首先,研究人员引入trp终止子以有效释放glmS核糖开关的反馈抑制作用。然后,设计了glmS核糖开关和及其突变体,可对代谢靶标实现不同程度的反馈抑制和激活。最后,利用GlcN6P 作为配体,将生物传感器glmS核糖开关整合至6-磷酸果糖激酶基因pfk和磷酸葡糖胺变位酶基因glmM的5'-端,可以分别动态抑制糖酵解和肽聚糖合成和途径的活性;同时,将glmS核糖开关突变体M5(glmS核酶切割位点AG→GG)整合至葡萄糖-6-磷酸异构酶基因pgi的5'-端,可以动态增强GlcNAc 合成途径的活性,最终使GlcNAc在B. subtilis中的产量从9.24 g/L 提高至18.45g/L。总之,通过多个靶点动态控制与配体GlcN6P 响应相关基因的表达,可以在GlcNAc 合成途径、肽聚糖合成途径和糖酵解途径之间实现代谢平衡,并且在没有副产物的情况下提高GlcNAc的产量。
值得注意的是,现有的适配体生物传感器大多只作用于非互补DNA 元件,以致不能在生长细胞中复制。Deng 等[17]以2'-的岩藻糖基乳糖(2'-FL)为目标产物,基于配体凝血酶结合的适配体在B.subtilis中开发了一种体内双功能基因表达调控回路,用于动态调控2'-FL 的合成。首先,研究人员证明了配体分子凝血酶与适体的结合可以诱导完全互补的双链DNA 的解旋。然后,构建了双功能基因表达调控回路,包括用于上调基因的凝血酶结合DNA 适体调控元件(TDC)以及用于下调基因的凝血酶结合RNA 适体调控元件(TRC),可以使报告基因eGFP的表达范围控制在0.084~48.1 倍。最后,利用该调控系统,可以动态上调2'-FL 合成途径中关键基因fkp和futC的表达,并下调基因purR的表达,导致2'-FL 的产量从24.7mg/L增加到674mg/L。
然而,同时实现代谢模块的动态调节和自发上调和下调基因仍然面临巨大挑战。最近,Wu等[18]在B.subtilis中设计并构建了一个基于生物传感器、CRISPR 和合成基因回路的代谢流量动态自发双重调控(autonomous dual control,ADC)系统,并成功将其应用于GlcNAc 合成相关代谢网络的优化调控中。首先,利用B.subtilis中与氨基葡萄糖分解代谢相关的转录因子GamR 的调控机制,设计了可以响应胞内6-磷酸氨基葡萄糖(GlcN6P)的生物传感器。随后通过将该生物传感器与基于CRISPRi的逻辑“非”门进行耦合,构建一种可同时对不同代谢模块进行动态自发上调与下调的ADC 系统,并使用流式细胞仪对该系统进行了功能验证。然后利用该系统构建了一个反馈调节回路,来同时动态激活GlcNAc 合成途径和动态抑制其主要的3个竞争途径(糖酵解途径、磷酸戊糖途径和肽聚糖合成途径)。在该反馈回路的调控作用下,当胞内的GlcN6P出现积累时,会促进GlcN6P流向GlcNAc 合成途径;同时会对上述竞争途径产生弱化作用,从而进一步增加流向GlcN6P 的代谢流。通过组装不同强度的激活模块与抑制模块,最终实现了GlcNAc 合成的动态平衡与最优调控,GlcNAc 的摇瓶产量由18.3 g/L 提高到了28.0 g/L;最后,在15 L 发酵罐上对该反馈回路的稳定性进行了验证,通过补料分批发酵GlcNAc 产量达到了131.6 g/L。这种自我调节方法不需要任何外部控制水平,例如使用诱导分子或改变发酵环境条件,而且提出的可编程基因回路可以扩展至其他微生物细胞和代谢途径的工程化。
1.4 无细胞蛋白表达系统
无细胞蛋白表达系统(cell-free protein synthesis,CFPS),是一种相对胞内表达系统而言的开放表达系统。它是以外源mRNA 或DNA 为模板,利用原核或真核细胞抽提物的酶系,添加氨基酸、RNA 聚合酶和能量物质等来表达蛋白质的体外翻译系统[69](图2)。利用无细胞蛋白表达系统,可以提高蛋白合成的效率,还可以通过掺入非天然氨基酸,在体外表达非天然蛋白质[70]。尽管无细胞系统通过制备方法的优化得到了一些改进[71],但这些研究大部分集中在E. coli无细胞系统的改进上,而针对B.subtilis无细胞系统的报道较少。作为一种重要的GRAS模式生物,B.subtilis无细胞系统的开发可能更适用于广泛的微生物学、合成生物学和工业生物技术应用。比如,B.subtilis调控元件的无细胞系统在与体内研究结合时可发挥协同优势,经过多轮无细胞表征的工作流程可导致设计周期的快速迭代,从而有助于在体内进行最终的设计[72]。
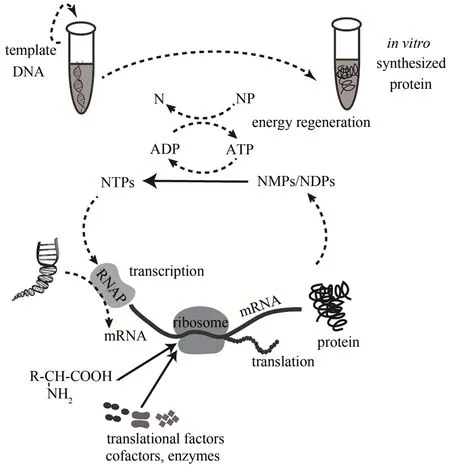
图2 无细胞蛋白表达系统Fig.2 Cell-free protein expression system
由于B. subtilis168 表达的异源蛋白质容易被其自身分泌的内源性蛋白酶降解,因此利用B.subtilis168 无细胞系统表达异源蛋白的能力有限,只能产生低产量的报告蛋白GFP(小于0.3μg/mL)。因此,研究人员选择蛋白酶缺陷菌株B. subtilisWB800N 作为出发菌株[73],通过工程化启动子文库表征的遗传调控元件来优化B. subtilisWB800N无细胞系统,对58 种不同类型启动子构建的无细胞GFPmut3b 体系进行初步筛选,在体外利用B.subtilisWB800N 细胞提取物一起表达GFPmut3b,通过GFPmut3b 的表征确定了几种不同强度启动子的B. subtilisWB800N 无细胞体系[15]。改良的B.subtilisWB800N 无细胞系统能够进行持续数小时的无细胞转录翻译反应,并产生多达0.8 µ mol/L GFPmut3b,是B. subtilis168 无细胞转录翻译系统(0.011µmol/L GFPmut3b) 的72 倍。最后将B.subtilisWB800N 无细胞系统应用在诱导型表达系统中,以肾素荧光素酶为报告蛋白,证明了B.subtilisWB800N 无细胞转录翻译系统对异源蛋白的生产和表征具有潜在的适用性。除启动子的转录强弱外,影响B. subtilisWB800N 无细胞系统表达异源蛋白的效率可能还包括其他因素,例如,在无细胞系统表达蛋白质过程中,产生的乳酸、乙酸或无机磷酸盐会导致体系的pH 值发生变化,这也可能对无细胞体系有害。而这些限制因素可以通过使用其他能源得以缓解,比如,麦芽糖是一种能在E.coli无细胞表达系统中消耗抑制性无机磷酸盐的碳源物质[74]。通过这些潜在抑制因素的研究可以进一步提高B.subtilis无细胞表达系统的效率,从而快速、大量生产具有高营养价值的功能性蛋白。
2 基于内源性调控系统构建的B.subtilis底盘细胞
2.1 Sec 分泌途径
B. subtilis因其具有良好的分泌能力可以作为工业酶的生产宿主,然而B.subtilis容易分泌大量蛋白酶,造成异源蛋白的降解,这主要归因于B.subtilis中Sec分泌途径存在的几个瓶颈:转位酶的靶向性差、分子伴侣的缺乏以及异源蛋白的不正确折叠[75]。在B.subtilis中,主要有四种组分(信号识别粒子、转位酶、信号肽酶和分子伴侣)参与Sec 分泌途径。Chen 等[19]通过对这四种分泌组分涉及的23 个基因或操纵子进行过表达,发现了影响异源蛋白分泌的关键因素是PrsA 脂蛋白和DnaK 分子伴侣的缺乏。PrsA 脂蛋白可以促进蛋白质的有效折叠,而DnaK 分子伴侣参与异源蛋白的折叠,可以使聚集最小化以稳定前蛋白的易位构象。随后研究人员将PrsA和DnaK两种蛋白一起共表达,发现报告蛋白α-淀粉酶AmyL 和AmyS 的分泌量分别提高了9 倍和12 倍,酶活分别提高了1.6倍和1.7 倍,进一步说明了这四种分泌组分对异源蛋白表达的重要性。因此,改造后的B.subtilis可作为异源蛋白表达的优势宿主。此外,通过Sec分泌途径改造的B. subtilis还可以用于疫苗的开发,特别是抗原与孢子外壳蛋白融合的B. subtilis孢子[20]。
2.2 群体感应系统
B. subtilis作为一种土壤微生物,具有在复杂且不断变化的环境中生存的能力,细胞通过复杂的信号转导系统来响应各种各样的胞外刺激。群体感应(quorum sensing,QS)是微生物间通过化学信号分子进行信息传递的一种形式,当细菌随菌体生长所分泌的信息分子达到一定的浓度阈值后,菌群检测到信号分子并通过调节相关基因的表达对菌群数量的变化作出回应[76-77]。B. subtilis通过群体感应效应可以控制感受态和孢子的形成(图3),从而促进细胞群体之间相互协调,以更好地适应胞外环境变化[78-79]。
在B. subtilis中,感受态的形成受到两种感受态因子(ComX 和CFS)的调节,当细胞达到一定的数目,感受态因子的浓度积累到一定临界值时诱导感受态的形成[80]。由comQ编码的ComQ 蛋白经修饰处理后,产生具有活性的信号分子ComX并分泌到胞外,使信号感应蛋白ComP 发生自磷酸化,随后该酶将相应的应答调节蛋白ComA 磷酸化,磷酸化的ComA 和srf操纵子结合,激活该操纵子的转录产生ComS 蛋白,ComS 与ClpC、ComK、MecA 蛋白一起参与接下来的信号传导,细胞进入感受态状态。CSF 发挥作用的方式与ComQ 有一些不同,由phr编码的CSF 前体在跨膜转运后形成成熟的CSF,当胞外的CSF浓度达到一定浓度时,通过Spo0K 转运至胞内,通过抑制RapC 的活性从而促进ComA 的磷酸化,促进感受态的形成[81]。基于上述原理,Guan 等[21]利用参与信号传导的srf操纵子的启动子PsrfA,构建了一种不需要添加诱导剂的细胞密度依赖型B.subtilis表达系统,可以实现菌体的高密度生长及异源蛋白氨肽酶和纳豆激酶的高效表达。而芽孢的形成主要受到组氨酸激酶KinA-E 和转录因子Spo0A 的调节:Spo0A 受到群体响应信号分子Phr-Rap 的调节,经过组氨酸激酶KinA-E 和两个磷酸转移蛋白Spo0F 和Spo0B 的作用,Spo0A 被磷酸化,调控相关靶基因的表达,进而促进芽孢的形成。Rap60不仅可抑制Spo0A 磷酸化水平,也可以抑制KinA 的活性,而Rap60则可以被响应细胞密度的信号分子Phr60 所抑制[82]。基于该原理,Cui 等[22]在B.subtilis中开发了一种Phr60-Rap60-Spo0A 双功能群体响应调控系统,细胞浓度增加可同时激活和抑制多个基因模块系统的表达,并将该系统动态控制B. subtilis168 中七烯甲萘醌的合成途径,验证了该系统的有效性。
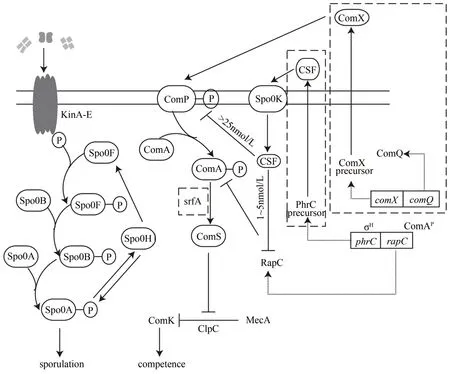
图3 B.subtilis中感受态和芽孢的形成过程Fig.3 Processes of competence and spore forming in B.subtilis
2.3 I型毒素/抗毒素调控系统
I型毒素-抗毒素系统是一种在转录后调节B.subtilis基因表达的调控系统[83]。I型毒素大多数属于噬菌体区域编码的蛋白,少数属于YhzE 蛋白家族。根据I型毒素氨基酸序列的比对结果,可以分为4 种毒素家族:TxpA/BsrG、BsrH/BsrE、YonT和YheZ。抗毒素是一种反义RNA,抗毒素反义RNA 与靶向毒素mRNA 的3’端互补,形成的毒素/抗毒素mRNA 复合物可以改变毒素mRNA 的稳定性,从而抑制毒素的表达。在B.subtilis中主要有5 种I型毒素-抗毒素系统:TxpA/RatA、BsrG/SR4、 BsrH/as-BsrH、 BsrE/as-BsrE 和 YonT/as-YonT。其中,BsrG/SR4 是一种新型的I型毒素-抗毒素系统[84],位于基因组的SPβ噬菌体区域。bsrG基因编码的BsrG 蛋白是一种使B.subtilis细胞裂解的短肽,而sr4基因转录生成的Sr4 是一种非编码调控RNA,它能结合bsrG基因转录生成的mRNA,从而形成Sr4/bsrGmRNA复合物。在该复合物中,bsrGmRNA和Sr4结合形成双链区,进而被RNase Ⅲ酶识别并切割,同时在其他RNase的作用下,bsrGmRNA 的半衰期显著降低,使bsrGmRNA 的RBS 区域会形成局部的双链,从而使bsrG的翻译受到影响,最终导致BsrG 的表达被削弱。基于上述原理,Yang等[23]利用bsrG-sr4毒素-抗毒素系统,构建了高效的转录后基因表达调控系统(modulationviathe sRNA-dependent operation system, MS-DOS), 利用MS-DOS 系统对B.subtilis中靶基因的抑制效率最高可达89.1%。
2.4 碳代谢分解阻遏作用
葡萄糖作为一种细胞生长所需的速效碳源,许多细菌会优先利用葡萄糖作为碳源,当葡萄糖供应耗尽时才使用其他辅助碳源,从而导致培养基中次级碳源的利用率较低,这种现象称为碳分解代谢物阻遏(carbon catabolite repression,CCR)[85]。由于工业生产发酵中往往以廉价原料为碳源,比如木质纤维素生物质,而CCR 作用是木质纤维素生物质发酵的主要限制,因此,解除CCR 作用对菌体同时利用多种碳源至关重要。在B. subtilis中,CCR 作用是由一种全局转录调节因子CcpA 发生磷酸化引发的,其活性是由磷酸化辅因子HPr通过代谢物控制的激酶HPr 催化激活的。HPr 在HPrK 的催化下自磷酸化,CcpA 与磷酸化的HPr 结合形成三元复合物,从而抑制分解其它碳源相关基因的表达,使菌体优先消耗葡萄糖[86](图4)。因此,要解除CCR 作用,关键是需要抑制CcpA 和HPrK两种酶的活性。Reu 等[24]通过敲除ccpA基因获得的突变株可以有效利用木质纤维素,并且突变株与B. subtilis168 有相同的生长速率,ccpA基因的敲除不影响细胞的生长。此外,有研究报道同时敲除ccpA和hprK基因,也能有效缓解CCR 作用,提高葡萄糖的消耗量,使B.subtilis突变株在含有过量葡萄糖的培养基中正常生长,从而促进核黄素的合成[87]。
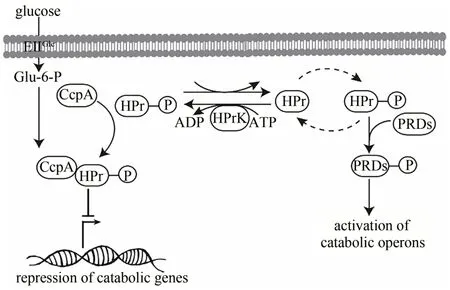
图4 B.subtilis中碳分解代谢阻遏作用Fig.4 Mechanism of carbon catabolite repression in B.subtilis
3 B. subtilis底盘细胞的应用
目前,利用B. subtilis底盘细胞已生产出多种天然生物化学品和工业酶(表3),如七烯甲萘醌[22]、核黄素[88]、鲨肌醇[89]、软骨素[90]、L-天冬酰胺酶[91]、β-环糊精糖基转移酶[100]、N-乙酰氨基葡萄糖[9,16,18,102]等。以四种生物产品(N-乙酰氨基葡萄糖、七烯甲萘醌、核黄素、透明质酸)和β-环糊精糖基转移酶等工业酶为例,来简要介绍B.subtilis底盘细胞的设计与应用(图5)。
3.1 N-乙酰氨基葡萄糖
N-乙酰氨基葡萄糖(N-acetylglucosamine,GlcNAc)是氨基葡萄糖的乙酰化衍生物,被广泛应用于维持骨关节健康以及治疗骨关节疾病。近年来,研究人员通过CRISPR 基因编辑[9]、空间支架[13-15]、核糖开关[17-18]和生物传感器[19]等工具从多方面改善优化了GlcNAc 的合成途径,显著提高了B. subtilis中GlcNAc 的合成效率。例如,Liu等[103]首先将GlcN-6-P 合成酶(GlmS)和GlcN-6-P 乙酰化酶(Gna1)引入B. subtilis中成功构建了GlcNAc合成途径。随后,研究人员利用DNA支架增强了GlcNAc 代谢合成中两种途径酶的协同催化作用[13],利用RNA 支架抑制了GlcNAc 合成竞争途径中糖酵解和肽聚糖合成模块的活性[14]。最后,为进一步提高GlcNAc 的产量,研究人员结合动力学模拟以及动态代谢组学发现了GlcNAc-6-P 与胞内GlcNAc 之间存在无效循环,这可能是GlcNAc合成途径的限速步骤。通过敲除重组菌BSGN中葡萄糖激酶编码基因glcK阻断了无效循环,导致GlcNAc的生产率增加了2.3倍[104]。
此外,通过设计新的代谢途径也可以提高B.subtilis的生产效率。Gu 等[102]通过重新设计中心碳和氧化还原代谢途径,有效提高了B.subtilis中GlcNAc 的产量。首先,研究人员删除GlcNAc 合成途径中编码丙酮酸激酶的基因pyk和编码2-脱氢-3-脱氧庚糖酸醛缩酶的基因kdgA,分别阻止烯醇式丙酮酸磷酸(PEP)途径和戊糖磷酸途径中丙酮酸的合成,推进糖酵解的碳通量通过碳重排进入GlcNAc 合成途径。随后,删除编码磷酸烯醇丙酮酸羧激酶的基因pckA,以减轻由PEP积累引起的反馈抑制;使用强启动子P43替换编码丙酮酸羧化酶的基因pycA的天然启动子,删除由苹果酸脱氢酶催化生成丙酮酸途径中的基因melA、malS、ywkA和ytsJ,异源引入编码丙酮酸羧化酶的基因bacpycA,从而将丙酮酸拉回TCA循环,以减少丙酮酸的碳溢出。然后,引入一个P43启动子控制的glmS基因,以促进GlcNAc 的合成。最后,研究人员引入4 种独立于NAD(P)合成反应的酶(丙酮酸铁氧还蛋白氧化还原酶、甘油三磷酸铁氧还蛋白脱氢酶、固氮酶铁蛋白NifH和苹果酸醌脱氢酶)来平衡氧化还原电位,重新建立了氧化还原代谢途径。通过对上述碳和氧化还原代谢途径的重新设计,碳通量可以定向流入GlcNAc合成的3种前体中(果糖-6-磷酸酯、乙酰辅酶A和谷氨酰胺),同时阻止副产物丙酮酸的碳溢出,从而提高的GlcNAc摇瓶产量至24.5 g/L。
表3 B.subtilis底盘细胞生产的典型生物化学品和工业酶Tab.3 Typical bio-chemicals and industrial enzymes produced by B.subtilis chassis cell
3.2 七烯甲萘醌
七烯甲萘醌(menaquinone-7,MK-7)是一种重要的脂溶性维生素,在凝血和预防骨质疏松症方面发挥关键作用。Cui 等[22]根据B. subtilis中芽孢形成的原理,利用级联信号分子Phr60 和Rap60设计并构建了群体响应调控系统:在细胞生长过程中,随着细胞密度增加,Phr60 不断积累,抑制Rap60,从而使得Spo0A 磷酸化启动,且Spo0A-P进一步结合至启动子上执行调控功能。首先对B.subtilis中受碳饥饿和群体响应系统共同调控的转录因子Spo0A 进行改造,通过敲除组氨酸激酶KinB、芽孢产生基因spoiiA-spoiiE以及信号分子PhrA-B,使转录因子Spo0A 仅受群体响应信号分子Phr60-Rap60 的级联调控;进一步通过调节启动子上Spo0A-P结合位点的序列、个数与位置,构建具有不同强度的启动子文库,获得了最佳激活型启动子PspoiiA和最佳抑制型启动子PabrB,以实现基因的上调和下调。通过以上研究,成功构建了具有双重调控功能的Phr60-Rap60-Spo0A 群体响应系统。最后,利用该系统对B.subtilis中MK-7复杂代谢网络中的关键合成基因模块和竞争基因模块进行系统优化和全局调控,使摇瓶中MK-7 的产量从9 mg/L 提高到360 mg/L,提高了40 倍。为进一步提高MK-7产量,研究人员针对B.subtilis静置培养时形成的生物膜能够有效增加MK-7 产量的这一现象,通过比较转录组学、蛋白质飞行质谱等技术揭示了细胞膜和电子转移是促进MK-7 合成的重要因素[105]。通过KEGG 分析了影响生物膜形成的差异基因,并对促进生物膜形成的11 种差异基因在前期构建的工程菌BS20 中进行过表达后,MK-7的产量均有显著提高,特别是过表达一种参与信号转导的基因BSU02000 时,MK-7 的产量从9.02 μg/mg 增加至42.5 μg/mg。此外,研究人员通过蛋白质飞行质谱,发现甲萘醌-细胞色素还原酶QcrA-C 对MK-7 的合成具有明显作用。因此,研究人员在工程菌BS20 中使用启动子P43同时过表达BSU02000 基因和编码QcrA-C 的基因,在摇瓶中MK-7 产量达到了410 mg/L。总之,研究人员通过群体响应的动态调控和比较转录组来调控MK-7 的合成,为构建B.subtilis底盘细胞以生产类似生物产品提供了有效策略。
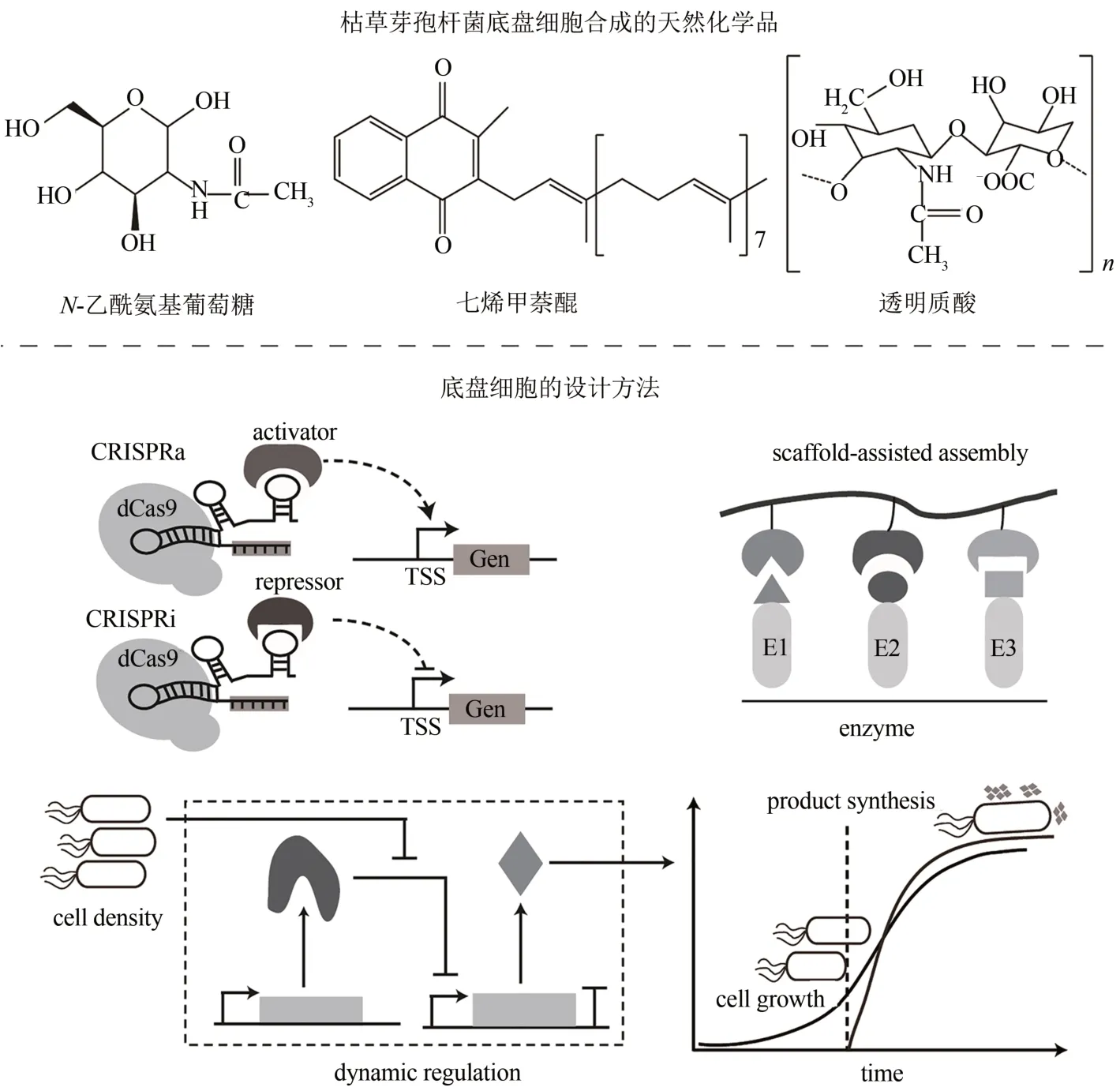
图5 B.subtilis底盘细胞的构建示意图Fig.5 Construction of chassis cell in B.subtilis
3.3 核黄素
核黄素(riboflavin,RF)是维持人和动物机体正常物质代谢所必需的营养物质,在生物体内以黄素腺嘌呤二核甘酸和黄素单核甘酸的形式存在,广泛应用于食品、饲料和制药行业。近年来,研究人员通过增加RF 前体供应、调节中心碳代谢、以及分析细菌转录组等方面,不断改善了RF在B. subtilis中的生物合成[106]。嘌呤核苷酸是RF合成途径中的一个重要前体。Shi 等[107]对嘌呤合成途径中的关键基因(purF、purM、purN、purH、purD)进行过表达后,将B.subtilisPK-P 菌株合成核黄素的产量提高了25%。此外,通过敲除编码嘌呤操纵子阻遏物的基因purR后,合成嘌呤的相关基因的相对转录水平上调了约380倍,并进一步通过定点诱变引入编码酰胺基转移酶的基因purF后,获得的purF-VQW突变菌株合成核黄素的产量比对照菌株增加了3 倍[108]。Wang 等[88]对来源于谷氨酸棒状杆菌(Corynebacterium glutamicum)中编码6-磷酸葡萄糖脱氢酶的基因zwf和编码6-磷酸葡萄糖酸脱氢酶的基因gnd进行定点诱变,以消除B.subtilis细胞内代谢物的变构抑制作用,在摇瓶培养中共表达突变的zwf和gnd脱氢酶,可以使B. subtilis合成核黄素的产量提高31%,并发现工程菌株在戊糖磷酸途径中检测到的代谢物浓度较高。因此,推断增强戊糖磷酸途径可以有助于核黄素的生物合成。
此外,通过细菌转录组的分析可以确定RF 代谢合成中新的调控靶标。Shi 等[109]对生产核黄素的B.subtilisRH33和野生型B.subtilis168菌株进行了转录组分析,并结合核苷酸测序和细胞内代谢物浓度的测量,确定了RF 合成途径中的两个关键途径酶可以用来改善核黄素的生产。转录组的数据表明,pur操纵子和编码全局调控因子PurR的基因在B. subtilisRH33 中均被下调。PurR 的活性受到嘌呤合成前体磷酸核糖焦磷酸(PRPP)的调节,而低浓度的PRPP 前体供应是限制B. subtilisRH33合成核黄素的主要原因。因此,研究人员对B.subtilisRH33 中合成PRPP 前体的两个关键酶基因prs和ywlF共表达,可以有效提高核黄素的产量,在5L 分批补料发酵中的产量达到15 g/L。在这项研究中,基于系统生物学的转录组学分析有助于确立新的合成代谢靶标,以便进一步改善B.subtilis中核黄素的产量。
3.4 透明质酸
透明质酸(hyaluronic acid,HA)是由两个双糖单位D-葡萄糖醛酸及N-乙酰葡糖胺组成的高分子量酸性黏多糖,广泛应用于生物制药、化妆品和食品工业领域[110]。Yang 等[23]通过异源引入透明质酸合酶基因hasA,实现了透明质酸在B.subtilis中的表达,并通过构建MS-DOS 调控系统对透明质酸合成竞争途径关键基因zwf、pfkA和galE的表达进行下调,能够提高透明质酸产量。首先,研究人员分析了B.subtilis内源启动子的表达强度与生长时期的关系,获得了不同生长时期表达的不同强度的启动子,包括对数期表达的启动子、稳定期表达的启动子和生长持续表达的组成型启动子。随后通过改造I型毒素-抗毒素系统bsrG/sr4,在B. subtilis中构建了依赖于Sr4 的MSDOS转录后基因表达调控系统,并对Sr4进行不同长度的截短,分析突变体对靶基因GFP 表达的抑制效率,证明了调控RNA Sr4的核心区域是位于其3'端的33 bp 序列。最后,利用MS-DOS 转录后基因表达调控工具对HA 合成途径的竞争途径(磷酸戊糖途径、糖酵解途径和细胞壁多糖合成途径)进行调控,分别对催化葡萄糖-6-磷酸流向磷酸戊糖途径的基因zwf、催化果糖-6-磷酸流向糖酵解途径的基因pfkA、催化UDP-葡萄糖流向细胞壁多糖合成途径的基因galE,以及催化UDP-N-乙酰氨基葡萄糖胺流向细胞壁多糖合成途径的基因murAA、murAB和mnaA的表达进行下调。由于有些被调控的代谢途径涉及细胞的基本代谢过程,过度的抑制反而可能会导致HA 产量的降低。因此,选择3种不同强度(弱、中、强)的组成型启动子PhemA、Pasd和PcitZ来启动Sr4 的转录抑制,对上述基因的表达进行不同程度地下调。结果表明:当分别对zwf、pfkA和galE基因的表达下调时,HA 的产量均具有不同程度的提升,最高产量达到1.52g/L,与对照相比提高了60.0%。因此,下调zwf、pfkA和galE三个基因的表达强度能够减弱磷酸戊糖途径、糖酵解途径和细胞壁合成途径对HA 合成途径的竞争,从而促进HA产量的提升。
3.5 典型工业酶
B.subtilis底盘细胞不仅可以用于代谢合成各种天然化学品,同时是生产工业酶的重要细胞平台[111]。例如,B.subtilisATCC 6051a 是一种用于工业化生产重组蛋白的菌株,与B.subtilis168 相比,ATCC 6051a 菌株的转化性能较差,并且在发酵过程中容易产生大量泡沫和高抗性的孢子。为提高ATCC 6051a 菌株作为工业表达宿主的适用性,Zhang 等[100]通过CRISPR-Cas9 系统,构建了包含靶标特异性的sgRNA、Cas9和同源修复模板的多合一敲除质粒,可以敲除ATCC 6051a 中与孢子形成相关的5 个基因(srfC、spoIIAC、nprE、aprE、amyE),最终获得的突变株ATCC 6051a BS5在发酵过程中对孢子的形成具有较大的抵抗力,并且胞外分泌的最高β-环糊精糖基转移酶(β-CGTase)活性达到277.8 U/mL,是对照菌ATCC 6051a 的2.5 倍。此外,通过改善B.subtilis的遗传调控系统,比如,过表达Sec分泌途径中的脂蛋白和分子伴侣等组分可以有效提高α-淀粉酶在B.subtilis中的表达量[20];或是利用感受态形成过程中的群体感应效应,构建的一种基于srfA启动子核心区域改造的B.subtilis自诱导表达系统,可以用于高效生产异源蛋白氨肽酶和纳豆激酶[22]。因此,利用CRISPR基因编辑技术和B.subtilis的自身遗传调控机制,也能构建优良的B.subtilis底盘细胞用于生产各种工业酶。
4 展望
B. subtilis作为一种重要的工业生产菌株,通过代谢工程改造已开发出不同类型的底盘细胞,广泛用于天然生物化学品的合成和工业酶的表达。然而,B. subtilis底盘细胞的设计仍然面临一些挑战。首先,尽管基于RNA-蛋白质复合物开发并依赖于碱基对引导的CRISPR 基因编辑技术已广泛用于转录调控,与计算蛋白质设计相比,核酸设计,特别是混合RNA 和蛋白质或核蛋白的复合物的设计仍然特别薄弱。为进一步扩展核酸设计,可以从设计有效折叠途径的角度将RNA 折叠动力学结合到设计算法中,以及通过整合RNA 和蛋白质设计的框架来预测并且设计解决核酸、核蛋白复合物的结构与功能关系。核酸设计的扩展有助于设计与生物传感器相关的RNA 配体结合结构域,可以用于改善酶和核糖体内的RNA 催化位点,或用于RNA 指导的CRISPR 基因编辑系统中RNA-蛋白质复合物的改进。其次,尽管已开发出生物传感器、核糖开关等调控元件用于动态调节代谢合成途径上相关基因的表达,然而响应这些调控元件的中间代谢物通常是合成途径上某一特定的生物大分子,从而限制了调控元件的使用范围。因此,如何设计响应生物小分子的调控元件使细胞可以动态控制多条代谢途径上基因的表达,或如何扩大某一特定生物分子的响应浓度范围使细胞不同程度的激活或抑制基因的表达,是目前设计生物传感器面临的主要问题。这可以通过高通量筛选基于转录因子的生物传感器来响应生物小分子的浓度变化,或基于Capture-SELEX技术更有效地筛选出性能优良的核酸适体,以便更广泛的应用到B. subtilis底盘细胞的设计和构建中。最后,通过开发特定的tRNA/氨酰tRNA 合成酶系统、核糖体和基因组重编码的生物,不仅可以扩展B. subtilis遗传密码系统的蛋白质表达规模,还可以为B.subtilis重编码多种非天然氨基酸奠定基础。

