植物合成生物学研究进展
张博,马永硕,尚轶,黄三文
(1 云南师范大学马铃薯科学研究院,云南省马铃薯生物学重点实验室,云南 昆明650500; 2 中国农业科学院农业基因组研究所,农业部基因组分析重点实验室,广东省岭南现代农业实验室,广东 深圳518120; 3 麻省理工学院化学工程系,马萨诸塞州剑桥市,02139)
迄今,生命科学历经了三次革命,第一次是“DNA 双螺旋结构的解析”,将科学研究由传统的生理研究转向分子生物学和遗传学等层面[1];第二次是随着人类基因组测序成功和多组学的蓬勃发展,催生或衍生出了系统生物学[1];第三次是生命科学、计算机科学、化学、物理学和工程学等学科的整合发展形成了合成生物学这一崭新领域并迅速开展“会聚”研究的生命科学革命[2]。
合成生物学主要是“以分子生物学和分子遗传学等传统生物学为基础,结合多种组学和系统生物学的手段,采用基因合成、编辑、网络调控等新技术并利用工程学和计算机指导设计新的生命体或者改造现有生命体的一门综合学科”[3]。这门学科的兴起使得生物学从传统的认识生命和研究生命上升到改造生命的高度,对探索生命本质具有重要的科学意义。在计算机的设计指导下,从头合成或者改造已有的细胞组件,对其进行组装和组合,进而生成特定功能或价值的生命体的这项崭新研究,必将推动生命科学和生物技术的颠覆性发展,为经济和社会的发展带来深刻的变革。
1 合成生物学
合成生物学的定义是“在人工设计的指导下,采用正向工程学‘自下而上’的原理,利用‘自上而下’的系统生物学,并整合分子生物学、信息技术和工程学等融合分析,对现有的、天然存在的生物系统有目的地进行重新设计和改造,或者通过人工的方法,创造出自然界不存在的活性生物分子、系统、细胞,甚至是‘人造生命’”[3-6]。它从微生物系统开始,现如今已发展到了包括植物系统的真核生物中[7-10]。合成生物学家利用无生命的基础原件从头合成脊髓灰质炎病毒基因组的cDNA[11],使用全化学方法合成组装了ΦX174 噬菌体[12]和蕈状支原体[13]等简单原核生物的基因组。随着人类基因组计划的研究深入,科学家还提出了合成酵母全染色体的Sc2.0 合成计划[14]和人类基因组合成计划[15],这些计划将合成生物学的对象从病毒和原核生物转向真核生物,如酵母和动植物等。微生物的合成生物学的应用前景广阔,主要体现在满足环境改善[16-18]和工业化生产[19-22]等需要,然而,使用微生物底盘进行生产过程需要消耗大量糖类(如葡萄糖)[23]。此外,微生物往往难以异源合成植物来源的参与代谢及调控途径的酶(如细胞色素P-450 酶)。而植物可以利用大气中的CO2作为碳源,进行所需化合物的合成,且与宿主植物具有结构与功能类似的细胞器、辅酶和辅酶因子,因此无需优化即可从宿主植物转移相应的代谢通路用来生产和应用[24]。这些优点为植物合成代谢工程提供了可持续发展的可能性。合成生物学的终极目标是可以像工程师一样理解、设计、构建和创造生物[25],虽然现阶段在植物细胞体系中要实现这一目标还很遥远,但研究人员还是取得了很多新的进展(图1)。
2 植物合成生物学的内涵
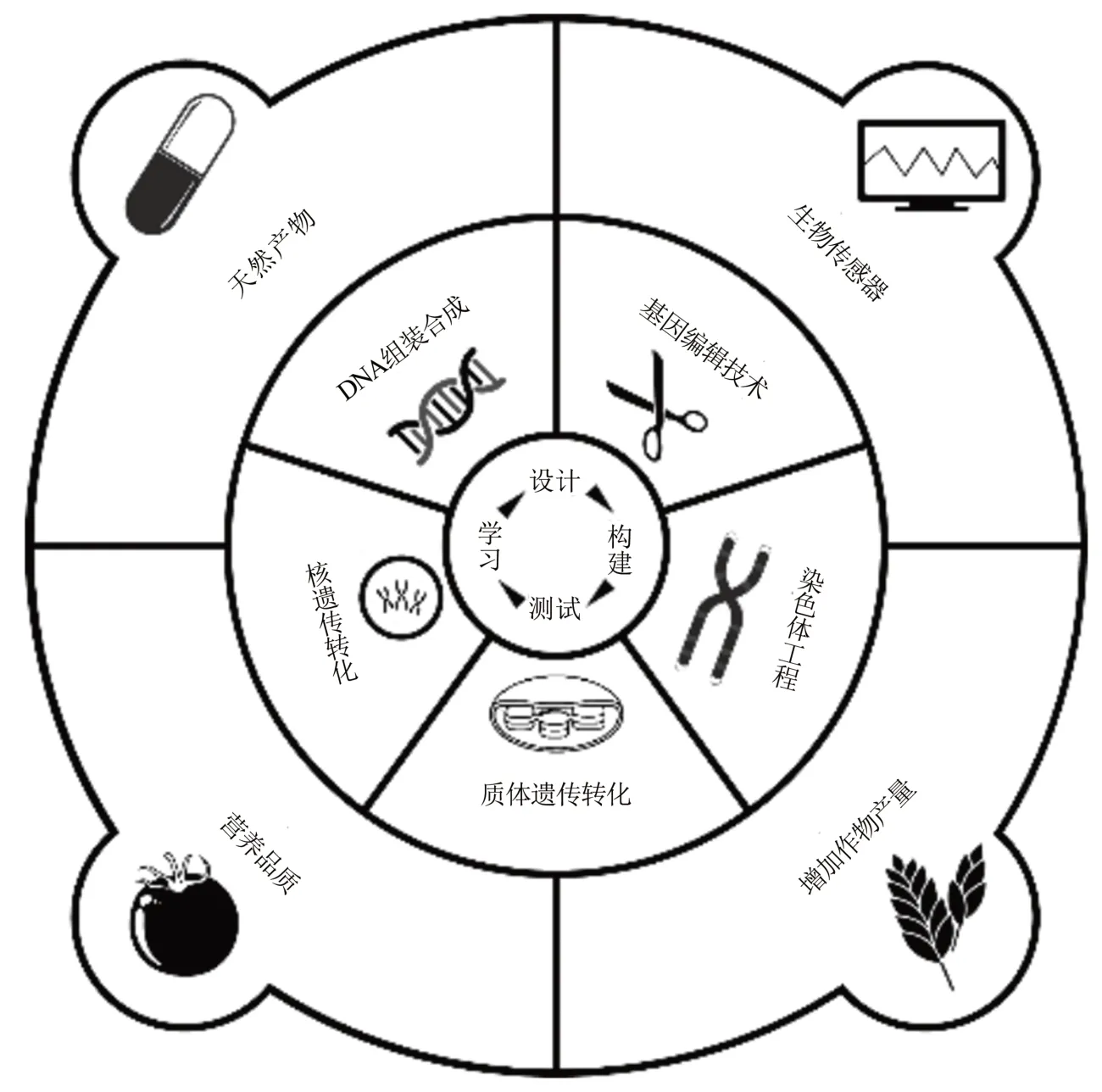
图1 植物合成生物学技术路线和应用进展Fig.1 Roadmap for plant synthetic biology and its applications
植物合成生物学是在植物基因工程和转基因技术的基础上发展起来的,三者间有部分研究内容是重叠的[26-27]。除了依赖基因工程原有的基因重组技术和植物组织培养技术操纵启动子重组与外源基因表达之外,植物合成生物学更强调借助计算机、数学、化学、物理学等多种交叉学科和工程化的思维,从系统层面实现对植物体系的从头设计与改造[28-29]。此外,传统的基因工程和转基因技术往往只能转化少量的外源基因,而植物合成生物学则倾向于利用核基因组和质体遗传,转化多基因叠加系统甚至是整个遗传通路[30]。新的染色体工程技术人工合成微小染色体(minichromosome)技术也可以确保多个基因的联合遗传[31]。这些新兴技术的广泛应用为植物合成生物学发展奠定了实践基础。
合成生物学的三大基石是合成元件、遗传线路和合成模块[29]。在植物中,生物合成元件主要分为三类:①催化元件(如氧化还原酶、转移酶、水解酶、裂解酶、异构酶和连接酶等);②转运元件(从胞外向胞内内转运和运输的相关蛋白,如膜电化学梯度的转运蛋白、离子通道蛋白等);③调控元件,(如启动子、核糖体结合位点、终止子、转座子、核酸开关、核酸调节子和CRISPR/Cas9 系统等)[29,32-34]。合成元件可以组装成复杂程度不同的合成基因线路,如可以通过模拟各种逻辑推理关系和数字元件的逻辑基因线路,以及构成具有特定生物功能的遗传基因线路[28-29,34],这些线路又能以新的形式组合成模块,主要包括:①合成乙酰辅酶A、丙二酸单酰CoA、莽草酸和氨基酸等初级代谢产物的初级合成模块;②合成苯烷类、萜类、糖、脂肪酸、含氮和硫等次生代谢产物的基本骨架合成模块;③对多种代谢产物进行修饰(如甲基化、酰基化、糖基化和磷酸化等)的修饰模块[28-29,35]。最后这些元件、线路和模块都将运输到植物底盘的细胞中进行不同的亚区室化表达[36](图2),最终实现对现有植物体系的改造和优化。
3 植物合成生物学技术进展
植物工程学中的“标准化、去耦合化和精简化”等思想[37]会被运用到元件、遗传线路和模块系统的创建过程中。因此,对DNA的合成和组装、基因编辑技术、核和质体遗传转化体系以及染色体工程等技术层面的探索显得尤为重要。
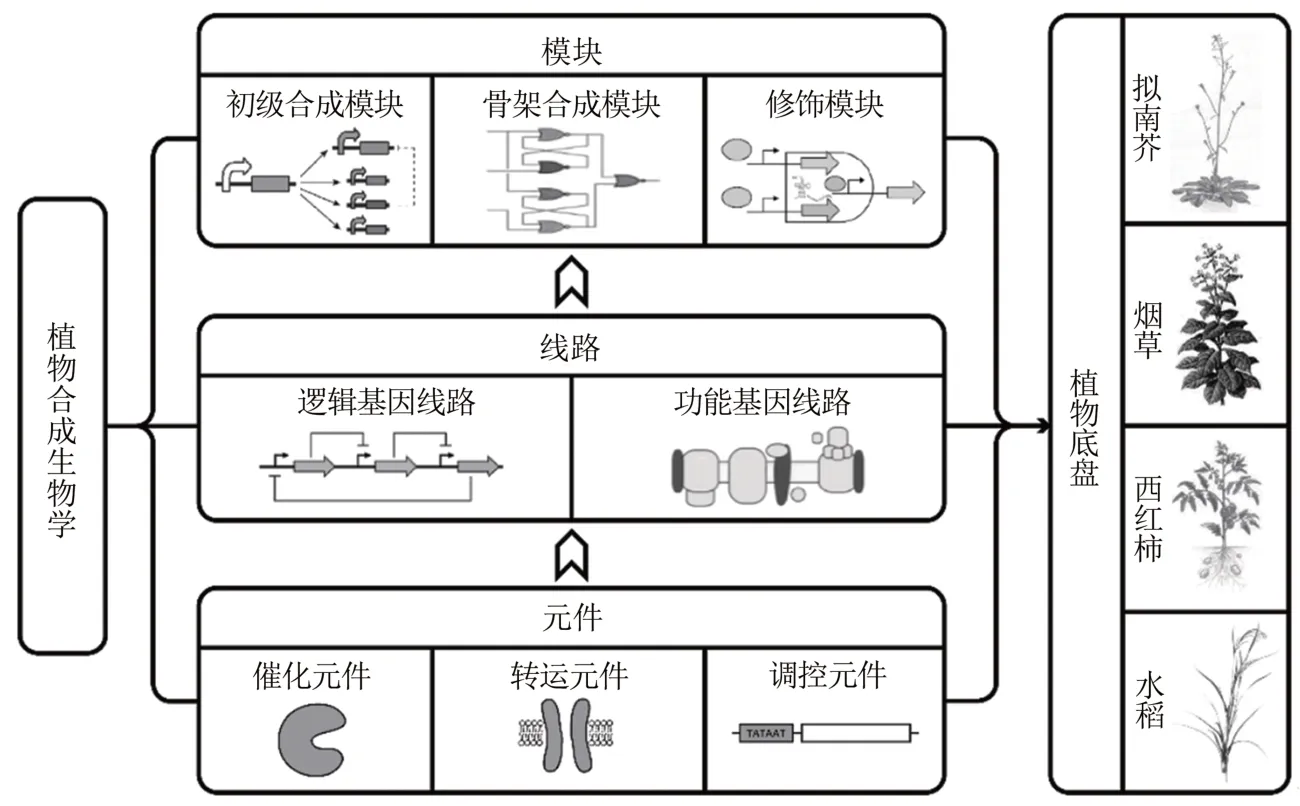
图2 植物合成生物学三大基石Fig.2 Three cornerstones for plant synthetic biology
3.1 DNA合成和组装
DNA是“生物体储存和传递遗传信息的载体”[38],如果需要对生物体进行特定的设计、改造和合成,则需要了解DNA的合成和组装。因此DNA合成和组装也是合成生物学中的关键技术。传统的PCR技术可以对已知DNA 序列进行合成,但如果要合成自然界中并不存在的DNA,则需要使用DNA 从头合成技术,即寡核苷酸合成。目前常用的基于柱基和微阵列的寡核苷酸合成技术是固相亚磷酰胺三酯法[39]。但随着寡核苷酸合成链的延长,合成产量会逐渐降低,效率下降。目前亚磷酰胺基寡核苷酸合成的上限约为200nt,并且会产生危险的副产物[40]。因此有科学家提出了末端脱氧核苷酸转移酶(TdT)的寡核苷酸合成策略[41]。该技术可反复延长寡核苷酸链,编写出新的DNA,这就为制造酶促寡核苷酸合成仪[42]奠定了基础。
合成的DNA 片段需要进一步进行组装。常见的体外组装方法主要分为三类:重叠定向组装(如In-Fusion[43]、Gibson 组装[13])、利用噬菌体整合的位点特异性重组(如Gateway 克隆[44])和基于限制性核酸内切酶的策略。基于Ⅱs 型限制性核酸内切酶的方法是最常用的DNA 标准化组装方法,如BioBrick[45]、Golden Gate[46]、MoClo[47]、GoldenBraid[48]、 Golden Mutagenesis[49]和基于Golden Gate 形成的multi-kingdom 模块化克隆系统[50]。体内组装方法分为两类:由λ-Red重组酶系统介导的同源重组方法[51]和Cre/loxP(如TGS Ⅱ系统)[52]、Flp/Frt[53]介导的位点特异性重组方法。其中TGS Ⅱ系统是基于Cre/loxP 重组酶介导的组装方法,因其操作简单、多基因组装效率高,已经被广泛用于植物中。该方法已经成功用于水稻胚乳中花青素、β-类胡萝卜素和虾青素的合成[54]。彭新湘等使用该系统叠加光呼吸的多个基因,开发出了一种提高光合效率和产量的新型水稻种质[55]。陈其军等还建立了MISSA[56]、MISSA 2.0[57]和MISSA 3.0 体内多轮位点特异性组装系统,促进了植物的多基因转化。
3.2 基因编辑技术
基因编辑是基因功能分析和作物改良的重要工具。与锌指核酸酶(ZFN)系统和转录激活因子样核酸酶(TALEN)系统相比,成簇规则间隔的短回文重复(CRISPR)/CRISPR 相关蛋白(Cas)系统更加简单、快捷和高效。目前,植物基因组编辑中最常用的是CRISPR/ Cas9 系统,其次是CRISPR/ Cas12a (Cpf1) 系统。 大部分的CRISPR/Cas9 系统是以单个基因为靶点,设计出一条gRNA 来完成敲除工作(如敲除OsNramp5 基因可以降低水稻镉的积累[58],敲除BADH2 可以提高稻米的香味[59])。而植物的生物合成和调控通路往往是由多个基因共同参与,如果想要了解和改造这些通路就需要进行多基因编辑。多基因编辑的主要方法是针对不同基因的靶点设计gRNA,采用Golden Gate 或Gibson 组装方法将多个gRNA序列装配到CRISPR/Cas9 双元表达载体中。例如基于pCAMBIA1300 骨架的pYLCRISPR/ Cas9 双元载体系统,能够高效编辑单子叶和双子叶植物中的多个基因[60];基于pGreen 或pCAMBIA 的载体系统针对多个基因进行定向突变,并在玉米和拟南芥中分别验证了其功能性[61]。多基因编辑技术还可以实现片段的删除[62],将tRNA 与gRNA 结合形成多顺反子基因,并使用内源tRNA 系统加工该合成基因,生成大量的gRNA,引导CRISPR/Cas9 载体进行多重基因组编辑和染色体片段缺失[63]。
通过非同源末端连接(NHEJ)修复方式可以将含有定点替换的DNA 片段与基因组中两个靶点之间的DNA 片段互换,进而实现基因的定点替换和定点插入,这一方法得到的突变体在水稻中可以稳定遗传到下一代[64]。除了定点替换和插入之外,现有的技术还可以在DNA 双链不断裂的情况下利用胞嘧啶脱氨酶或腺嘌呤脱氨酶对目标基因的特定位点进行精准的单碱基编辑。例如胞嘧啶单碱基编辑器[65]能将C/G 碱基对转化成T/A 碱基对;腺嘌呤单碱基编辑器ABE7-10可以将A/T碱基对转化成G/C 碱基对[66]。单碱基编辑系统A3APBE 已经成功在小麦、水稻及马铃薯中实现高效的C/T 单碱基编辑[67]。通过合用两类单碱基编辑器并针对靶基因的gRNA库,科学家提出了单碱基编辑技术介导的水稻内源靶标基因的定向进化技术(BEMGE)[68]和饱和靶向内源基因突变碱基编辑器STEME[69]。STEME 双碱基编辑器[69]能够在只有一个gRNA 引导下诱导靶位点C>T 和A>G 的同时突变。使用这些技术能在植物中实现基因的定向进化,也为短时间创制大量突变类型的育种筛选材料提供可能。
敲除植物体某些基因可能会导致植物不育甚至死亡,需要对其基因表达量进行调控。利用基因编辑技术对基因启动子的上游开放阅读框(uORF)[70]或顺式调控元件[71]进行编辑或删除,进而间接改变基因的表达水平。例如:对生菜的维生素C 的GDP-L-半乳糖磷酸化酶(GGP)上游启动子的uORF 区域进行编辑,导致生菜中维生素C含量显著提高[72]。
3.3 核基因组遗传转化
植物的遗传转化是一项重大科学突破,从根本上改变了农业和植物生物学。目前常用的遗传转化手段主要有农杆菌介导法、基因枪法、花粉管通道遗传转化法、显微注射法和最新的纳米颗粒转化法。其中农杆菌介导的遗传转化方法已成为双子叶植物和单子叶植物(如水稻)中最常用的基因传递技术。而纳米材料构建的基因载体具有穿透性强、装载量大、有对外源基因的保护作用以及较短的遗传转化周期等特点[73]。部分纳米材料如碳纳米管[74]、二氧化硅(SiO2)纳米粒子[75]等可以装载外源基因,结合基因枪技术可穿过植物细胞壁,获得转基因植株。而磁性纳米颗粒(如Fe3O4磁性纳米颗粒)载体则可以与花粉管通道法结合,成为花粉磁转染法[76]。在适合的磁场条件下,磁性纳米颗粒载体传递到花粉中,利用磁转染花粉授粉,再在子房受精产生转基因种子,这种方法可以有效地转化某些难以使用常规方法进行遗传转化的植物。
由于上述方法都需要将CRISPR 重组体或人工合成的基因整合到植物基因组中才能发挥其作用[77]。因此,研究人员又开发出一种不依赖于植物细胞遗传转化体系:核糖核蛋白转化法。该方法先将CRISPR/Cas9 蛋白和gRNA 在体外组装成核糖核蛋白复合体(RNP)[78-79],然后将该复合体转化到莴苣和小麦的原生质体中,获得不含转基因片段的突变植株[79]。 此外,上述遗传转化技术都需要进行植物组织培养,效率往往较低,还易导致基因组发生不可预测的变化[80]。最新研究发现在植物中同时表达WUSCHEL(WUS)、SHOT MERISTEMLESS(STM)、MONOPTEROS(MP)等主要发育调控因子和基因编辑元件,可从头诱导分生组织获得稳定遗传的转基因和基因编辑植物[81]。
值得一提的是农杆菌介导的基因瞬时表达渗透技术,因其操作简单(仅需无针注射器与根癌农杆菌悬浮液浸润叶片)、转化效率高(同时实现多基因表达)和检测周期短(几小时或几天就可以产生蛋白)等特点被广泛应用于利用植物底盘生产天然产物。例如:利用瞬时表达技术在烟草中生产萜类化合物[82]。
3.4 质体遗传转化
质体是植物细胞合成代谢中最主要的内共生细胞器,是由植物细胞内的前质体分化而来的,分为叶绿体、有色体和白色体,具有原核生物基因组的特点。在质体中发生的主要反应有光合作用,淀粉、氨基酸、脂肪酸、色素以及氮、硫代谢[83]。与核基因组转化相比,叶绿体转化具有无可比拟的优势:①通过基因工程,可以将多基因串联,置于同一个操纵子中[84];②高效表达外源蛋白,如叶绿体转化烟草植株可产生高达70%的可溶性蛋白[85];③没有表观遗传效应,不会产生基因沉默和位置效应[86];④母系遗传特性很大程度上阻止外源基因通过花粉传播[86]。目前质体成功转化的物种有20 余种,其中体系稳定且高效表达的是烟草质体转化体系,以基因枪法为主,一般经过2~3轮筛选,使所有质体基因组均同质化。除了基因枪技术,人们还可以利用脂质交换膜渗透(LEEP)技术,借助纳米颗粒(包裹着壳聚糖的碳纳米管)将基因在无外力作用的情况下运输到植物细胞的叶绿体中。进入叶绿体后,在叶绿体弱酸性环境下,DNA 被释放,进而合成相应的蛋白[87]。因为植物细胞一般有几十个叶绿体,所以以叶绿体作为生物反应器可以高效地表达如抗体[88]和口服型疫苗[89]等外源蛋白,还可以创制抗病抗虫抗干旱等非生物胁迫的转基因植物材料[90]。有意思的是,有研究表明利用嫁接技术不仅可以实现整个质体基因组在同一物种的细胞间发生转移[91],还可以实现在两个种间不亲和的茄科植物中发生转移[92],这为打破种间隔离,产生新物种提供了更多可能性。
3.5 植物染色体工程
相对于传统的遗传转化和育种过程,染色体工程具有如下的优势:①使用染色体系统可以整合和表达多个外源基因。这些基因既可以是多个基因的简单堆叠,也可以是对复杂基因复合物的工程改造[93];②染色体特定位点重组技术能对目标位点进行定点整合,而不会产生因随机插入导致的基因表达水平改变、基因沉默、插入基因突变等情况[94],并能防止内源基因的功能被破坏[93];③在传统育种过程中,引入目标基因或染色体片段时往往也会引入连锁的带有不良性状的染色体片段,而简单的回交等育种方式无法消除这一负面影响。染色体工程中的人工染色体技术(PAC)可以避免传统育种过程中产生的连锁累赘。PAC 上的整个基因起着一个连锁基团的作用,可以在一次杂交中转移而无需从基因组中引入其他基因[93,95]。
人工染色体是染色体工程新的热点研究方向,它是由必需的顺式作用元件构成的人造线性或环状DNA分子,主要包含主复制序列(ARS)、着丝粒和端粒三个功能元件。它可以作为新的载体系统转移和叠加多个外源基因。构建人工染色体的方法有两种:一种是自下而上,对染色体的功能元件(如复制起点,着丝粒、端粒等)进行组装[96];另一种是自上而下,改造原有或已知的染色体,从中挑选微小染色体并在植物体内进行定点整合[97],如端粒介导的染色体截断技术,在拟南芥、水稻和玉米等[98-99]产生了微小染色体,这是目前更常见的合成和构建微小染色体的方法。将单倍体育种技术(如CENH3 的从头合成[100])与PAC 结合会加速植物新品种的选育[101],为它们提供良好的特性,如抗旱、抗虫等[101]。此外,改造的植物也可以作为大规模生产特定蛋白质或代谢物的工厂[102]。
4 植物合成生物学的研究应用
随着植物合成生物学的迅猛发展,研究人员可以通过设计和改造植物来满足人们更多的需求。如合成多样化的生物传感器来监测细胞内的活动,定向改造作物提高产量和丰富营养品质,合成植物天然产物或蛋白质。这些工程学应用使植物合成生物学逐步走向成熟。
4.1 合成生物传感器
植物每时每刻都在不停地调动体内营养物质、代谢物和信号分子来维持代谢活动。要理解植物内部细胞是如何调动这些资源从而实现体内动态代谢生命活动,需要一类蛋白质或RNA 元件来识别特定的生物活性分子或其体内发生的某些生物学过程,并将其转换成可输出、可检测甚至可计量的信号。这类生物元件被称为生物传感器[103]。
生物传感器分为直接生物传感器和间接生物传感器[103]。目前钙指示剂是最先进、应用最广泛的直接生物传感器。无论是生物发光、化学荧光还是荧光蛋白和钙结合后荧光强度发生变化,都可以通过测量光强来衡量细胞内钙信号变化[104]。检测植物体内激素信号的启动子-报告基因系统则属于间接生物传感器,如生长素的DR5v2 和DR 5启动子[105]、细胞分裂素的TCS 启动子[106]、乙烯的EBS 启动子[107]和脱落酸的UAS 启动子[108],它们能驱动GUS 或荧光蛋白基团来转录响应相关激素变化过程。内源激素信号还可以通过荧光共振能量转移(FRET)生物传感器进行检测[109]。例如:在ABACUS 和ABAleon 两个生物传感器[110]中,ABA 响应会改变受体和磷酸酶相互作用的铰链区域的构象,从而改变供体和受体荧光前体之间的相互作用,促使荧光共振能量转移。最近一些研究还开发了可检测植物营养物质变化的生物传感器。例如:cpFLIPPi 可以检测根表皮细胞在磷饥饿和补充反应中胞浆的磷浓度变化[111];高亲和力FRET 的Zn2+生物传感器通过检测两个金属结合域ATOX1 和WD4 与Zn2+结合后的能量转移来检测Zn2+的浓度[103]。光敏色素信号还可以作为温度传感器,监测植物的光合温度信号变化[112]。植物前哨生物传感器可以经过特定修饰检测信号并对害虫、病原体和非生物胁迫等环境因素做出应对反应。如三硝基甲苯(TNT)全植物生物传感器可以快速激活脱绿基因的电子通路,使叶绿素降解相关的基因上调表达[113]。
4.2 提高农作物产量
对于农作物来说,第一要务就是要提高产量。而产量的提升可以从提高光合作用效率、促进植物与根际微生物间的有益相互作用、促进养分的获取减少肥料使用、增强抵御非生物胁迫的能力及提高水的利用效率等方面入手。合成生物学的出现,为研发提高农作物产量的方法提供了新的思路。
4.2.1 提高光合作用效率
光合作用是植物生长和生物量生产的主要动力。增加植物生物量和提高作物产量最主要的手段是提高植物对光能的利用效率。提高光合作用效率主要有以下几个策略。
(1)优化光合作用的光反应。光合作用的电子转移反应(也称为光反应)提供了CO2同化所必需的ATP 和NADPH。通过过表达电子传递链的成分可以促进电子运输进而导致更高的CO2同化效率,如细胞色素b6f 复合物及其相关蛋白PsbS 和Rieske FeS 亚基的调控[114]。减少因叶片过量光吸收而导致的非光化学猝灭过程(NPQ)中的能量损失,可以加快烟草从光保护中恢复,从而显著提高了烟草的生长速度[115]。
(2) C3 植物中引入蓝藻CO2浓缩机制(CCMs)。蓝藻有不同于C3 植物的二氧化碳浓缩机制(CCM),通过累积细胞质内的无机碳酸氢盐()作为主要碳源,后经碳酸酐酶催化形成CO2促进Rubisco 羧化,从而实现高效率碳固定。蓝藻中已经鉴定出几种可以促进植物CO2运输和光合碳同化的基因,如在拟南芥、烟草和大豆中的Ictb (无机碳转运蛋白B) 可以通过积累[116],进而增强光合碳同化作用。过表达Ictb 和FBP/Sbpase(果糖1,6-二磷酸酶/景天庚酮糖1,7-二磷酸酶)不仅增强了水稻的光合作用也提高了水稻籽粒的产量[117]。还有研究表明,在C3植物中从头构建简化的α-羧酶体可以使植物产生部分固碳能力,这对在植物中引入CCM 具有重要意义[118-119]。
(3)设计和改造碳固定通路和光呼吸旁路。研究人员通过对来自9 种生物体中的17 种酶进行组合,将甲基琥珀酰辅酶A 脱氢酶(Mcd)改造成氧化酶(Mco),最终在体外人工构建出一条名为CETCH 的碳固定通路,其固定CO2的速度为传统的卡尔文循环的10倍以上[120]。由于光呼吸涉及多种生理功能,如光合作用代谢、光保护、H2O2信号传导、硝酸盐吸收、C1 代谢和适应生物/非生物胁迫等[121],单纯抑制光呼吸作用可能会影响其正常生长。因此,需要设置光呼吸旁路,使植物在乙醇酸完全氧化成二氧化碳的过程中,不产生还原当量,从而提高生长速度和增加生物量。目前,已在烟草叶绿体中人工合成出3条光呼吸旁路:①大肠杆菌乙醇酸氧化途径的五种基因;②植物的乙醇酸氧化酶、苹果酸合酶以及来自大肠杆菌的过氧化氢酶;③植物苹果酸合成酶和绿藻乙醇酸脱氢酶[122]。设置这些光呼吸旁路途径使转基因烟草的生长量比野生型烟草提高了约40%[55]。旁路工程使植物显示出更高的光合作用和生物量产量,并减少了光呼吸作用。
4.2.2 减少氮、磷肥的使用
豆科植物和根瘤菌的共生固氮机制是生物固氮的重要途径。目前主要有两种策略在谷物根中重现固氮共生机制:①将豆科植物-根瘤菌的固氮通路转移到谷物中,建立起谷物和根际微生物的联系;②改善谷物根中已存在的信号通路实现共生固氮。在豆科共生固氮过程中,几种根瘤菌在豆科结节中合成了一类根状茎化合物(rhizopines),这类化合物由scyllo-inosamine 1(SIA)和3-O-methyl-scyllo-inosamine 2(3-O-MSI)两种物质组成,并且受核心正调节基因nifA的调控[123]。通过建立苜蓿和大麦的转基因植物和根际微生物两者间由SIA介导的跨界信号通路,可激活非豆类作物根系微生物群落的特定组分从而实现非豆类作物的固氮的可能性[124]。除了根状茎中的rhizopines,根部释放出的类黄酮也可以刺激根瘤菌产生信号分子结瘤因子(NOD)[125],其诱导的信号通路与单子叶植物之间保守的共生信号(SYM)通路是类似的。通过改造单子叶植物现有SYM 途径,使其被NOD 因子激活,进而导致谷物菌根与固氮根瘤菌产生联系进行固氮[126]。此外,通过固氮基因nif(vnf/anf)或结瘤固氮通路来直接调控谷物底盘[127],如水稻[96]、小麦[128]、玉米和大麦[129]等的氮利用效率,减少氮肥使用。
磷是植物生长的必要关键元素之一。由于磷元素在土壤中易被固定,植物难以吸收,磷肥的有效利用率低[130-131]。在长期进化过程中,植物形成了一系列抵抗低磷胁迫的适应机制[132]。提高植物对磷的吸收能力的常见策略如下。①增加根系分泌物(主要是有机酸和酸性磷酸酶)的合成和分泌,其中植酸酶基因和紫色酸性磷酸酶基因的超量表达可以促进植物对根际有机磷的溶解,提高对磷元素的吸收[133-134];过表达苹果酸脱氢酶(malate dehydrogenase, MDH)和柠檬酸合成酶(citrate synthase, CS)[135]基因,可以调控植物有机酸的合成,进而促进对难溶性无机磷的活化作用,提高作物对磷肥的利用。②形成植物和根际微生物的共生体系[136]。当植物在低磷环境下,根际微生物可促使植物开启低磷胁迫适应机制PSR(phosphate starvation responses),增强从土壤中吸收磷的效率。研究表明PHR1 核心转录因子可以调控PSR。构建一个不依赖磷积累的可控磷胁迫响应开关,即在非低磷胁迫条件下,根际微生物也会大量吸收土壤中的磷素,进而提高植物对磷的利用效率[137]。
4.2.3 抵御非生物胁迫
脱落酸(ABA)是一种倍半萜类植物激素,在调节植物发育、生长及应对非生物胁迫反应中都起关键作用。然而脱落酸的化学性不稳定、合成成本极高,不易利用。因而,通过改造脱落酸受体或合成脱落酸结构功能类似物,有助于更好地利用脱落酸抗旱,同时避免脱落酸对作物带来的脱叶伤害,在农业生产上有着广阔的应用前景。
研究表明,脱落酸受体蛋白(PYR1/PYL/RCAR),能够识别和启动ABA 信号转导[138-139]。利用蛋白质工程开发出新的脱落酸受体,即PYR1的六突突变体(PYR1MANDI),使其可以特异性识别双炔酰菌胺(mandipropamaid,一种农业常用灭菌剂),启动ABA信号通路,既有效提高了植物抗旱性,又避免了脱落酸的脱叶作用,不影响植物的正常生长发育[140-141]。目前还发现了几种脱落酸功能类似物。Pyrabactin[142]是第一个人工合成的脱落酸类似物,可以与PYL 受体的部分亚基特异性结合,作为种子抑制剂而发挥作用。AM1(ABA mimicking)[143],也称为Quinabactin[144],不仅可以抑制植物种子发芽,而且在增强抗旱性方面具有广谱性,但是它的受体亲和性比脱落酸更弱,因此抗旱性较弱,并不适合大面积使用和推广。基于AM1 的主链结构又人工衍生出新型化合物AMF4(在AM1 的4-甲基苯基环的邻位和间位添加了四个氟原子)[145]。与AM1 相比,AMF4 可与PYL 受体形成更多的氢键,导致其与受体的亲和性较脱落酸高出一个数量级。因此喷洒AMF4可以使植物表现出更强的耐旱性。在植物中如果过表达PYL2基因,还可以进一步增强AMF4 的抗旱性。 最新发现的脱落酸类似物Opabactin(OP)[146],其受体亲和力相对于脱落酸提高了约7倍,在植物体内最高可提高10 倍,且在不同作物(如小麦、番茄、大麦、拟南芥)中均有活性,解决了之前磺酰胺分子的局限性,使其有望成为“超级激素”。这些脱落酸类似物的发现,为植物抵御非生物胁迫,尤其是应对干旱胁迫提供更多的保障。
4.3 增强作物营养品质
植物性营养素(黄酮类、花青素、类胡萝卜素等)和微量营养素(维生素和矿物质元素)对人体健康具有重要意义。缺失这些营养物质被称为“隐性饥饿”,严重会导致心血管疾病甚至是癌症发生,因此人们对于开发健康防护类的营养可食用主粮和蔬菜作物兴趣日益浓厚。
4.3.1 植物性营养素
花青素、β-胡萝卜素、玉米黄素、角黄素和虾青素是工业上常用的高价值类着色剂和饲料补充剂,它们也是有效的抗氧化剂。对于黄酮类、花青素和类胡萝卜素这些代谢通路研究相对清楚的化合物,有两种常见的方法提高营养素的水平。①通过特异性启动子过表达单个或多个关键酶基因和/或转录因子基因提高营养素含量。如:水稻胚乳作为黄酮类生物合成的“生产车间”,水稻种子或胚乳特异性启动子与大量合成相关的酶(OsPAL, OsCHS, AtF3H, AtFLS, GmIFS,
PcFNSI,GmFNSII,OsOMT)融合可高效产出黄酮类化合物,如黃烷酮、黄酮醇、异黄酮和黄酮[147]。花青素生物合成受多种转录调控因子控制,在番茄中用果实特异性启动子过表达SlAN2-like[148]、AtMYB12[149]和SlMYB75[150]等转录因子均获得了果皮和果肉中富含花青素的紫色番茄。而将多种植物或细菌的类胡萝卜素合成关键酶基因(PSY、CRT、LCY等)转化到水稻、玉米、小麦、高粱、大豆、番茄和马铃薯等作物中可以增加β-胡萝卜素、玉米黄素、角黄素和虾青素含量。其中,八氢番茄红素合成酶(PSY)是类胡萝卜素合成途经的第一个关键限速酶[151],是生物强化的理想候选基因。仅过表达PSY单基因已成功培育出多种生物强化作物,在水稻中引入水仙花PSY酶基因和细菌胡萝卜素去饱和酶基因(CRT)则生产出一代黄金大米[152]。胡萝卜素生物强化中另一个重要的基因是编码1-脱氧木酮糖-5-磷酸合酶(DXS)基因,在上游MEP 途径中发挥重要作用。将AtDXS转入水稻中导致水稻胚乳中的类胡萝卜素的含量显著提高[153]。②在营养缺乏的作物中重构生物合成途径。如:创制富含β-胡萝卜素的二代黄金大米、富含花青素的紫晶米和紫玉米、富含角黄素的角黄素米和富含虾青素的赤晶米等。利用高效的多基因载体系统TGSⅡ,在水稻胚乳中同时表达8个花青素合成及调控相关外源基因,获得高花青素含量的紫色胚乳水稻[154]。利用胚乳特异性启动子驱动双基因(sZmPSY1、sPaCrtI)、三基因(sZmPSY1、 sPaCrtI、 sCrBKT) 和四基因(sZmPSY1、sPaCrtI、sCrBKT、sHpBHY),分别获得了无选择标记的富含黄色β-胡萝卜素的二代黄金大米、角黄素大米和虾青素大米新种质[54]。利用玉米胚乳特异性双向启动子(PZmBD1)、2A 连接肽和4 个花青素合成基因(ZmBz1、ZmBz2、ZmC1、ZmR2)及7 个报告基因组成玉米多基因表达体系(MES),开发出胚和胚乳花青素富集的紫色玉米[155]。
4.3.2 微量营养素
微量营养素包括多种维生素(B族维生素、维生素C 和维生素E)、铁和锌等矿质元素[156]。大部分微量营养素是细菌、真菌和植物从头合成的,而人则主要依靠饮食来补充。植物作为饮食的重要组成部分,是这些营养素的主要来源。大多数主食作物(如小麦、水稻、玉米、马铃薯和木薯)微量营养素含量较低,需要改善其营养组成[156]。
在植物中实现生物强化的B族维生素是维生素B1(硫胺素)、维生素B6和维生素B9(叶酸),都是人体必不可少的水溶性维生素。过表达维生素B1部分合成基因,如THI1和THIC(4-甲基-5-C 噻羟乙基噻唑磷酸合酶和4-氨基-2-甲基-5-羟甲基嘧啶磷酸合酶),可以导致未抛光水稻种子中硫胺素含量增加了五倍[157-158]。单独过表达维生素B6合成的关键酶[磷酸吡哆醛合成酶(PDX1)和磷酸吡哆醛谷氨酰胺酶(PDX2)],维生素B6含量的增加并不显著[159-160],但在木薯中同时过表达拟南芥的PDX1.1和PDX2基因可以显著增加叶片和块根总的维生素B6含量,与非转基因相比叶片和块根分别提高了3.9~48.2 倍和1.9~5.8 倍[161]。目前也开发出多种叶酸强化作物,如水稻[162]、玉米[163]和马铃薯[164]。主要通过增加两种叶酸前体(喋呤和pABA)含量来增强叶酸生物合成。如:同时过表达GTPCHI和ADCS成功地将番茄[165]和水稻[162]中的总叶酸含量分别提高了25 倍和100 倍;在水稻同时过表达GTPCHI、ADCS、FPGS和FBP获得了比野生型水稻高150 倍的叶酸生物强化水稻[166];过表达GTPCHI,ADCS,HPPK/DHPS和FPGS使转基因马铃薯的成熟块茎中叶酸含量最多增加12 倍,并且长达9 个月的储藏时间内保持稳定[167]。
维生素C(抗坏血酸)的生物强化主要是通过过表达其生物合成基因或沉默其代谢基因来实现。其中维生素C含量增加比较多的例子是在番茄中过表达合成关键酶GGP(GDP 半乳糖磷酸化酶),致使果实中维生素C含量比对照提高了6.2倍[168]。与过表达合成基因不同,在番茄[169]、玉米[163]和马铃薯[164]中沉默代谢基因(单脱氢抗坏血酸还原酶MDHAR 和脱氢抗坏血酸还原酶DHAR)后维生素C的增加量较少。此外,GGP在翻译水平上也受到调节,敲除GGP 的上游开放阅读框(uORF)会破坏抗坏血酸的反馈抑制,从而增加拟南芥[170]、生菜[171]和番茄[172]的维生素C浓度。
维生素E是一种脂溶性维生素,其中α-生育酚的生物活性最高,约是γ-生育酚的10 倍。大豆、玉米、棕榈和芥子油中所含的γ-生育酚的占比是α-生育酚的10 倍,因此需要设计代谢工程将γ-生育酚转换成活性更高的α-生育酚。过表达γ-TMT(γ-生育酚甲基转移酶)可实现这一转化,导致α-生育酚在生育酚中的比例增加,如玉米中增加6.5 倍,约占总数的94%[173]。过表达多个维生素E生物合成基因会导致总维生素E含量大量增加。如大豆中特异性表达大麦的HGGT(香叶基香叶基转移酶)和大豆γ-TMT,生育三烯酚增加了8~10倍,大豆油的氧化稳定性也得到了提高[174]。
在人类赖以生存的矿物质营养素中,铁和锌在许多新陈代谢过程中都起着至关重要的作用。考虑到农作物中铁和锌积累的复杂机制,主要通过以下方法来提高作物中铁和锌的生物利用效率。①增加金属结合蛋白和相关酶的表达,如Fer(铁蛋白)[175]、NAS(烟碱胺合酶)[176]、NAAT(烟碱胺转氨酶)和脱氧葡糖酸合酶(DMAS)[177];②增强铁和锌从根部到食用部位的转运和运输,如IRT(铁调节金属转运蛋白)[178]、YSL(黄色条纹蛋白)[179]、ZIP(锌铁调控蛋白)[180];③减少抑制铁和锌吸收的抗营养素,如植酸[181]。其中比较成功的例子是将拟南芥IRT1和NAS1基因与小麦的FER基因在水稻胚乳中特异性协同表达使水稻胚乳中锌和铁的含量高达33.17μg/g (以干重计,下同)和10.46 μg/g[182];利用薯块特异性启动子表达拟南芥铁转运蛋白(IRT1)和铁蛋白(FER1)使转基因木薯中铁含量提高了7~18倍,锌含量提高了3~10倍[178]。需要注意的是因为金属元素的特性,增加锌和铁等有益元素同时有害元素(如镉)也容易大量积累[183],其中过表达OsHMA3[184]可将根部的镉运输到液泡中从而降低地上部分镉的积累量。
4.4 植物天然产物合成
植物一直以来都是药物、营养素、香料和调味料等的主要来源。由于目标代谢物丰度较低、结构复杂性、原始植物生长缓慢等,加大了研究和开发的难度。为了解决这些问题,科研人员开始使用异源宿主生产天然代谢产物。植物底盘具有类似结构和功能的细胞器、辅酶(如P-450 酶)、辅酶因子以及前体物质,更利于蛋白表达和表达后修饰。因此,植物底盘更适于重建复杂天然产物生物合成途径。模式植物本氏烟草因为其生长周期短和适合农杆菌介导的瞬时表达而被作为理想的研究对象[82]。通过在本氏烟草中重构了天然产物的通路,已成功合成多种天然活性物质,如长春花碱和长春新碱[185]、鬼臼毒素(依托泊苷的天然产物前体)[186]、甜菜碱[187]、红景天苷(红景天属酚类天然产物)[188]、青蒿素[189]、紫杉二烯和5α 杉羟基紫杉二烯。其中紫杉二烯和5α-羟基紫杉二烯(紫杉醇关键中间体)[190]是通过在烟草叶绿体中导入紫杉二烯合成酶(TS)、紫杉二烯-5 二-羟化酶(T5H) 及其细胞色素P-450 还原酶(CPR),同时过表达MEP(甲基赤藓糖醇磷酸)途径上的关键合成酶DXS(1-脱氧木酮糖-5-磷酸关键分支酶)以及GGPPS(香叶基香叶基焦磷酸合成酶)生产出来的,其产量分别为56.6μg/g(以总重计,下同)和1.3μg/g。此外,番茄果实因其富含多种代谢底物(糖和芳香族氨基酸)、中间体(4-香豆酰辅酶A 和乙酰基辅酶A)、代谢产物(苯基丙烷和萜类化合物),产量大和果实便于提取分离纯化目标化合物等特性成为了植物代谢工程最受欢迎的底盘植物[191]。目前,番茄果实通过代谢工程已可以产生高价值代谢物,如甜菜碱[192]和类胡萝卜素[193](角黄素、金盏花红素和虾青素)、迷迭香酸、生育酚、胆固醇及其衍生物(甾体皂甙,薯蓣皂苷元(用作激素药物)及其衍生物黄体酮、甾体生物碱(SA)香豆精苷和潜在的抗癌药维生素D3[194]。
萜类化合物是植物次生代谢产物中最大的一类,植物中药用萜类化合物的生物合成是一个相当复杂的过程,其中绝大多数都涉及细胞色素P-450 酶(CYP450)[195]。植物中大约有1%的基因编码P-450 酶,是植物天然产物结构多样的重要驱动因素之一。与参与植物初生代谢途径的酶相比,P-450 酶参与次生代谢反应效率偏低,部分P-450酶底物的专一性差,因此改造P-450 酶对于植物天然产物合成生物学的研究有着重要意义。作者所在实验室之前开发了一套基于蛋白结构与组学数据改造植物P-450 酶功能的方法[196],为植物天然产物代谢工程和合成生物学研究提供了新的思路。
5 植物合成生物学存在的问题
与单细胞微生物相比,多细胞植物生长周期更长、基因组更大、细胞器更多、代谢与调控机制更复杂,这些都加大了利用植物体系来开展合成生物学研究的难度。虽然在微生物中合成元件、线路和模块化设计都已有很多成功的例子[197],但因为植物体系本身的复杂性导致人工定制可利用的生物元件偏少,多使用植物天然元件,如顺式调控元件、启动子和终止子等[28-29],在组装方面难以实现标准化和工程化。此外,由于植物需要随时应对不断变化的外界环境,如何精准控制合成线路和模块中基因表达和转录调控提高对环境的适配性也将是植物合成生物学研究的难点和重点。植物合成生物学常用到的转基因技术具有一定的局限性[198],如周期长,转化效率受物种限制,基因编辑技术则可能会造成无法预估的脱靶问题,导致一定的安全风险问题[198-199]。在作物中,染色体工程中诱发微小染色体的方法缺乏通用性,而且染色体截断技术还不够稳定,多基因转化体系仍需要继续完善[200]。
合成生物学也和大多数科学技术一样被视为双刃剑,尤其是制造“生命”的伦理问题,挑战了传统的生命观念、自然发展的规律、进化论和尊重生命的伦理法则[201]。目前,世界各国围绕植物转基因技术的争议一直存在如获得世界粮食大奖的黄金大米至今未商业化[202],可以预见消费者接受和社会认可转基因作物还需要一个缓慢的过程。未来植物合成生物学将广泛应用于农业和环境等领域,尤其需要谨慎使用和关注改造的植物体系,人工合成植物对生态系统稳定性和生物多样性造成潜在的安全风险[203]。同时要进一步完善安全伦理监管机制,制定相应的安全伦理法规,加强科研人员和媒体、公众之间的交流等措施促进我国植物合成生物学健康发展。
6 植物合成生物学的未来发展趋势
虽然植物体系比微生物更加复杂,但植物合成生物学研究也具有其独特的优势。植物来源的天然产物生物合成、调控及转运元件、线路和模块能更好适应植物底盘。随着植物基因组、转录组、蛋白组、代谢组和表型组等组学大数据的快速发展,利用多种组学数据进行突变体库筛选、元件发掘以及模型预测加速了植物代谢网络和信号转导通路等数据发掘工作,已成为植物合成生物学研究必备研究策略,为未来植物合成生物学研究提供了新的契机。利用农杆菌介导的瞬时表达技术可在烟草中快速表达多个基因,其操作简单、周期短和转化效率高,适用集设计(多基因快速遗传转化体系)、测试(生产出重组蛋白)、优化(扩大规模大量生产)于一体的转化原则,有望成为生产植物生物活性物质和其他高价值化学物质的底盘植物。
随着全球气候变暖,极端天气频繁出现,大力发展新的科学技术保障世界粮食安全日趋紧迫。植物合成生物学研究将在未来提高农作物产量、增强作物营养品质等方面发挥着重要作用。其中,提高光合作用效率是未来农业增产的重要环节。未来有望通过优化光合作用酶(如Rubisco 和ATP合成酶)以及构建新的光呼吸旁路;将C4 植物的高光效途径转移到C3 植物宿主中;创建全新光合通路(如不用Rubisco)甚至人造叶绿体基粒等[204]生物膜堆叠系统来提高光能利用率提高农作物产量。此外,人工构建固氮酶以及工程菌提高根瘤菌和非豆科植物互作效率,从而减少氮肥用量同样是未来农业发展必然趋势,也必将依赖于植物合成生物技术的突破和快速发展。
致谢:本研究由国家重点研发计划“合成生物学”重点专项,合成植物天然产物的微生物细胞工厂构建及其应用示范(2018YFA0901800)和云南师范大学研究生科研创新基金项目(ysdyjs2019170)资助,同时这项工作也得到了云南省和深圳市政府的支持。

