靶向激活miR-148b-3p对缺血性脑卒中小鼠脑功能的影响及机制*
李 明,刘 勇,董 海,王 彪,阎登富,刘 磊,何仲春
成都医学院第一附属医院 神经内科 (成都 610500)
缺血性脑卒中又称脑梗死,是由各种原因引起的局部脑组织缺血缺氧性坏死,进而产生对应神经功能缺失的一种脑血管疾病,具有较高的致死率和致残率。目前临床上所采用的溶栓、抗血小板聚集、血管介入治疗等综合性措施明显改善了脑梗死患者梗死灶的血液供应,但血管再通后的缺血-再灌注性损伤也极大影响患者远期脑功能的恢复[1]。更重要的是,当前缺血性脑卒中在18~50岁成人中的发病率逐年增加,导致越来越多的劳动力缺失,极大地增加了社会负担[2]。因此,了解缺血性脑卒中发生的分子机制,积极开展新型有效的治疗手段,以促进脑梗死患者脑功能恢复和降低其致死率和致残率,在当前形势下显得极为重要。
微型RNA(microRNAs, miRs)是一类由21~25个核苷酸组成的短链RNA,主要通过与相应靶基因mRNA的3′段非翻译区(3′-UTR)相结合而抑制其功能性表达。研究[3-4]显示,缺血性脑卒中患者血液中miR-148b-3p、miR-151b、miR-27b-3p、miR-20a-5p等多种miRs的含量明显改变,miR-148b-3p被认为可作为缺血性脑卒中的生物学标记。核苷酸结合寡聚化结构域样受体蛋白3(nucleotide-binding oligomerization domain-like receptor protein 3, NLRP3)炎症小体激活是缺血性脑卒中发生的重要机制[5]。在IgA血管炎患者中,miR-148b-3p被证实是炎症反应的负调控因子[6]。miR-148b-3p是否通过调控NLRP3相关炎症反应而影响缺血性脑卒中,这一问题尚不清楚。本研究拟在小鼠大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)性脑卒中模型中,探讨靶向激活miR-148b-3p对缺血性脑卒中小鼠脑功能的调控作用,以及NLRP3炎症小体与miR-148b-3p调控脑卒中作用机制的关系,为miRs应用于缺血性脑卒中防治的基础与临床研究提供依据。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性C57BL/6小鼠(8~10周龄)50只,由成都医学院实验动物中心提供。实验前适应性喂养7 d。光照12 h/d,室内温度(21~22)℃,湿度40%~55%,自由进食进水。
1.1.2 主要药品及试剂 水合氯醛(批号:C8383)、NLRP3抑制剂MCC950(批号:5381200001)、氯化三苯基四氮唑(TTC,批号:T8877)购自美国Sigma-Aldrich公司;TrizolTMPlus RNA纯化试剂盒(批号:12183555)、SuperScript Ⅲ逆转录酶(批号:18080044)购自美国Invitrogen公司;miR-148b-3p引物、U6引物来自美国Invitrogen公司;miR-148b-3p agomiR和agomiR阴性对照品来自上海吉玛制药技术有限公司;RIPA裂解液(批号:P0013B)、BCA蛋白浓度测定试剂盒(批号:P0010S)购自上海碧云天公司;抗硫氧还蛋白互作蛋白(TXNIP,批号:NBP1-54578SS)购自美国Novus Biologicals公司;NLRP3(批号:sc-25778)购自美国Adipogen生命公司;GAPDH(批号:sc-365062)抗体、过氧化物酶连接的羊抗兔二抗IgG(批号:sc-2004)购自美国Santa Cruz公司。
1.2 动物模型制作
参照文献[7]方法制作MCAO性脑梗死模型:术前禁食6 h,采用10%水合氯醛按0.3 g/kg体重腹腔注射麻醉,仰卧位固定,消毒后,颈前正中切开,暴露左侧颈总动脉、颈内动脉及颈外动脉,游离颈内、颈外动脉分叉处,结扎颈总动脉近心端和颈外动脉根部,用动脉夹夹闭颈内动脉,在颈总动脉靠近动脉分叉处穿线备用,在备用线以下剪一小口,将头端钝化的2 cm 6-0号尼龙栓线从切口插入颈总动脉,继续插入拴线至颈内动脉上动脉夹处,松开动脉夹,继续推进尼龙拴线直至颅内,遇阻力而停止,此时栓线插入深度距动脉分叉处达1 cm左右,栓线头刚好到达并封闭大脑中动脉。然后,结扎颈总动脉处备用的结扎线,依次分层缝合切口,拴线另一端暂时保留在体外。术后切口消毒,监测其呼吸、体温、心率。栓塞90 min后,拔去拴线以实现再灌注;再灌注72 h后,处死动物,取材检测。
1.3 动物分组处理
将50只雄性C57BL/6小鼠按照随机数字表法分为假手术组(Sham组)、栓塞模型组(MCAO组)、NLRP3抑制剂组(MCC950组)、miR阴性对照转染组(NC agomiR组)、miR-148b-3p激动剂转染组(miR-148b-3p agomiR组),每组10只。假手术组的手术过程只进行至暴露颈内动脉。其他4组按照上述过程完成MCAO模型建立及随后的再灌注。手术后即刻,MCC950组腹腔注射50 mg/kg体重的MCC950,Sham组、MCAO组腹腔注射与MCC950组同等容积的磷酸缓冲盐溶液(phosphate buffer saline,PBS)。
miR阴性对照转染组、miR-148b-3p激动剂转染组在执行MCAO模型前60 min通过侧脑室注射给予agomiR阴性对照品或miR-148b-3p agomiR。侧脑室注射miR-148b-3p agomiR的方法参考文献[8]。小鼠经10%水合氯醛(0.3 g/kg体重)腹腔注射麻醉,俯卧位固定脑立体定位仪(瑞沃德,深圳)上,头部75%乙醇消毒,正中切开皮肤,暴露颅骨。找出并标记注射进针点(前囟0.58 mm,腹侧2.1 mm,左侧1.2 mm),在进针点处钻孔,植入套管,直至左侧脑室。将miR-148b-3p agomiR(30 pmol/g体重)或agomiR阴性对照品(30 pmol/g体重)与DOTAP脂质转染试剂按100 pmol∶1 μL比例混合为6 μL液体,在37 ℃下孵育15 min后,利用微量注射器将此混合液在20 min内注入左侧脑室,留针10 min,缓慢拔去微量注射器。缝合头部皮肤,将小鼠由立体定向仪移下,放入恒温恒湿的孵育箱中,37 ℃下保温60 min;再完成MCAO模型制作。
1.4 脑功能缺陷评分
再灌注72 h时按照Vemuganti等[9]方法,采用5分制评估小鼠脑功能缺陷程度:0分,无任何脑功能缺陷(正常);1分,不能正常伸展右前肢(轻度缺陷);2分,肢体向右侧转圈弯曲(中度缺陷);3分,行走时向右侧倾倒(重度缺陷);4分,不能自发行走(极重度缺陷);5分,意识障碍。
1.5 脑梗死灶体积测定
再灌注72 h后,小鼠在10%水合氯醛腹腔注射麻醉下断头处死,快速取脑组织,做冠状切片(每片厚度1.5 mm)。切片放置于2%氯化三苯基四氮唑(TTC)中37 ℃下孵育15 min,将染色后的脑片置于扫描仪中扫描,图片存储后采用Image pro plus软件对脑片中梗死体积进行分析。脑梗死体积百分数参照文献[10]计算。
1.6 RT-PCR分析
再灌注72 h后,小鼠断头处死,快速分离梗死区周围脑皮质组织,采用Trizol试剂盒提取总RNA,经SuperScript Ⅲ逆转录酶逆转录合成cDNA,采用以下引物序列进行扩增:miR-148b-3p引物序列5′-CTCACATGGTGTCGTGGAGTCGG CTTAACAGTTGAGTACCAAGTT-3′;内参U6引物序列5′-CGCTTCACGAATTTGCGTGTCAT-3′。扩增反应条件包括95 ℃ 10 min,40个循环的95 ℃15 s、60 °C 1 min。采用2-△△Ct法做相对半定量分析,以表达量比值miR-148b-3p/U6作为miR-148b-3p的相对表达量。
1.7 蛋白质印迹技术分析
再灌注72 h后,小鼠断头处死,快速分离梗死区周围脑皮质组织,采用RIPA裂解液提取总蛋白,BCA法定量。每泳道40 μg蛋白经8%SDS-聚丙烯酰胺凝胶电泳2 h,电转移至聚偏氟乙烯(PVDF)膜,5%脱脂奶粉液室温下阻断2 h,PVDF膜经抗TXNIP、NLRP3、GAPDH一抗于4 ℃孵育过夜,过氧化物酶连接的羊抗兔二抗IgG于室温孵育1 h。最后,加化学发光试剂显示目的蛋白条带。采用ImageJ软件检测蛋白条带光密度,并做统计分析。
1.8 荧光素酶实验
利用starBase V2.0在线数据库(http://starbase.sysu.edu.cn/)预测TXNIP mRNA上的miR-148b-3p调节靶点[11]。采用定点突变试剂盒(GeneTailor Site-Directed Mutagenesis System, Invitrogen公司)诱使TXNIP 3′-UTR的miR-148b-3p结合位点发生突变,产生突变型TXNIP 3′-UTR。将野生型TXNIP 3′-UTR或突变型TXNIP 3′-UTR克隆入pRL-CMV载体(美国Promega公司)。将小鼠神经瘤母细胞N2a细胞系以0.5×105个/孔密度接种于96孔板。让细胞共转染野生型TXNIP 3′-UTR或突变型TXNIP 3′-UTR的荧光素酶构建物和miR-148b-3p模拟物(上海吉玛制药技术有限公司)。转染48 h后,各孔加入双荧光素酶检测底物试剂(美国Promega公司),检测数据。
1.9 统计学方法
2 结果
2.1 小鼠缺血性脑卒中时miR-148b-3p/ TXNIP/NLRP3轴的表达变化
为验证miR-148b-3p/TXNIP/NLRP3轴在小鼠缺血性脑卒中的可能作用,本研究首先检测了缺血区脑组织中miR-148b-3p/TXNIP/NLRP3的表达量。MCAO组小鼠患侧大脑皮层表现出典型梗死灶,Sham组小鼠皮层则无明显异常。各组脑组织中TXNIP和NLRP3蛋白的代表性电泳条带如下(图1)。与Sham组相比,MCAO组脑组织中miR-148b-3p表达明显降低,TXNIP、NLRP3蛋白表达量则明显增多(表1)。

表1 各组小鼠缺血区脑组织miR-148b-3p、TXNIP、NLRP3表达比较
2.2 激活miR-148b-3p对缺血性脑卒中小鼠脑组织TXNIP/NLRP3轴表达的影响
为验证炎症反应与miR-148b-3p保护小鼠缺血性脑卒中的关系,本研究观察了miR-148b-3对缺血区脑组织TXNIP、NLRP3表达的影响。与Sham组相比,MCAO组小鼠脑组织TXNIP、NLRP3蛋白表达量均显著增大,提示患病小鼠脑组织炎症反应存在;与NC agomiR组相比,miR-148b-3p agomiR组脑组织TXNIP、NLRP3蛋白表达量均显著降低(表1)。
为进一步探讨miR-148b-3p与TXNIP的关系,采用starBase V2.0在线数据库预测到TXNIP mRNA上的miR-148b-3p调节靶点。采用荧光素酶实验验证miR-148b-3p对TXNIP mRNA的靶向调节作用。在转染野生型TXNIP 3′-UTR载体时,与空白对照(Wt-TXNIP+NC miR)组相比,miR-148b-3p模拟物明显降低了转染野生型TXNIP 3′-UTR载体下的荧光素酶活性。而在转染突变型TXNIP 3′-UTR载体时,miR-148b-3p模拟物并未改变转染突变型TXNIP 3′-UTR载体下的荧光素酶活性(表2)。
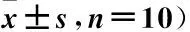
表2 各组N2a细胞荧光素酶活性比较(分,
2.3 激活miR-148b-3p/NLRP3轴对缺血性脑卒中小鼠脑功能评分及脑梗死灶体积的影响
miR-148b-3p激动剂(miR-148b-3p agomiR)用于小鼠缺血性脑卒中模型,以观察激活miR-148b-3对其脑功能缺陷评分及脑梗死灶体积的影响。与Sham组相比较,MCAO组小鼠脑功能缺陷评分和脑梗死灶体积均显著增大,提示患病小鼠脑部结构与功能显著受损;与NC agomiR组相比,miR-148b-3p激动剂(miR-148b-3p agomiR)转染组脑功能缺陷评分明显降低,脑梗死灶体积显著缩小。NLRP3抑制剂MCC950用于小鼠缺血性脑卒中模型,以验证NLRP3相关炎症反应在缺血性脑卒中发生中的作用。与MCAO组相比较,MCC950组小鼠脑功能缺陷评分明显降低,脑梗死灶体积明显缩小(表3)。
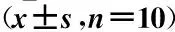
表3 各组小鼠脑功能缺陷评分及脑梗死灶体积百分数比较
3 讨论
研究[12]表明,miRs广泛表达于真核生物体内,尽管在进化上高度保守,但功能上miRs在细胞分化、机体发育及疾病发生发展过程可能发挥着巨大作用。在患有缺血性脑卒中的患者与动物体内,多种miRs的表达量发生了显著性改变[3,13]。一些miRs(miR-151b、miR-27b-3p等)的表达明显上调,而另一些miRs(miR-148b-3p等)则显著下调。下调的miR-148b-3p可视作缺血性脑卒中发生的生物学标记[3]。但miR-148b-3p在缺血性脑卒中发生机制中的作用并不清楚。为此,本研究在小鼠缺血性脑卒中疾病模型中观察了缺血区脑组织miR-148b-3p表达量的变化及其与小鼠缺血性脑卒中发生的关系。结果显示,在脑卒中小鼠的缺血区脑组织中miR-148b-3p表达量显著下调,而侧脑室给予miR-148b-3p激动剂预处理明显缩小了患病小鼠的脑梗死灶体积,改善了脑功能缺陷,提示内源性miR-148b-3p的表达下调可能与小鼠缺血性脑卒中发生相关,激活miR-148b-3p则对小鼠缺血性脑卒中及其脑功能缺陷有明显保护性作用。
研究[14]显示,氧化应激反应在缺血性脑卒中发生机制中起重要作用。氧自由基的产生,可促进TXNIP与内源性抗氧化物硫氧还蛋白分离,随后TXNIP通过与NLRP3结合而激活NLRP3炎症小体形成[15]。NLRP3炎症小体在结构上包括核心部分NLRP3、接头蛋白ASC和caspase-1前体。NLRP3炎症小体激活后可通过caspase-1激活而促进IL-1β等炎性因子前体的裂解、成熟和释放,诱导细胞损伤。尽管研究[16-17]显示,miR-148b-3p可调节神经胶质中施万细胞的的迁移活动和神经胶质瘤细胞的恶性生物学行为,但miR-148b-3p保护缺血性脑卒中小鼠脑损伤的具体信号机制并不清楚。本研究通过观察激活miR-148b-3p对脑卒中小鼠脑组织NLRP3及其上游分子TXNIP表达的影响,以探讨NLRP3炎症反应与miR-148b-3p保护小鼠缺血性脑卒中作用机制的关系。结果显示,缺血性脑卒中导致小鼠缺血区脑组织中NLRP3、TXNIP的蛋白表达上调,而侧脑室给予miR-148b-3p激动剂预处理在改善脑卒中小鼠脑功能损伤的同时还显著下调TXNIP、NLRP3的蛋白表达;应用NLRP3抑制剂MCC950也明显改善脑卒中小鼠的脑损伤;同时,采用荧光素酶实验验证miR-148b-3p对TXNIP mRNA的靶向调节作用,结果证实TXNIP应该是miR-148b-3p的一个直接调节靶。
综上所述,激活miR-148b-3p对小鼠缺血性脑卒中的保护性作用机制可能与其抑制促炎性TXNIP/NLRP3信号轴有关。

