血管紧张素Ⅱ联合PGA指数对酒精性肝病、食管胃底静脉曲张及出血的预测意义
徐艳丽 邓敏 吴一鸣

[摘要] 目的 探討血管紧张素Ⅱ(AngⅡ)联合PGA指数无创性评估酒精性肝病患者食管胃底静脉曲张程度及出血风险。 方法 选取2017年6月~2018年6月嘉兴市第一医院收治的82例酒精性肝病患者,用胃镜检查评估食管胃底静脉曲张的程度,并测定血AngⅡ水平,计算PGA指数。比较不同食管胃底静脉曲张程度患者的AngⅡ水平和PGA指数。随访6个月,对AngⅡ和PGA指数预测出血的诊断效能进行比较。 结果 胃镜下食管胃底静脉曲张0级组、1级组、2级组、3级组的AngⅡ分别为(2318.621±346.043)pg/mL、(2867.420±383.144)pg/mL、(3430.193±686.725) pg/mL、(4204.723±997.436) pg/mL,PGA指数分别为(2.858±0.210)、(3.848±0.265)、(5.446±0.585)、(7.944±0.891)。AngⅡ和PGA指数均与食管胃底静脉曲张的严重程度相关,AngⅡ的相关系数为0.701,P=0.001;PGA指数的相关系数为0.774,P=0.013。随访6个月出血组的AngⅡ为(3705.471±784.323) pg/mL,PGA指数为(6.591±2.094);未出血组的AngⅡ为(3185.862±914.118)pg/mL,PGA指数为(4.851±2.234)。出血组AngⅡ(敏感度0.765,特异度0.646)和PGA指数(敏感度0.882,特异度0.523)均明显高于未出血组,差异有统计学意义(P<0.05)。 结论 AngⅡ联合PGA指数能良好预测酒精性肝病患者食管胃底静脉曲张程度及出血风险,为临床医生及时判断病情、采取进一步措施提供指导意见。
[关键词] 血管紧张素Ⅱ;PGA指数;酒精性肝病;食管胃底静脉曲张;出血
[中图分类号] R575.5 [文献标识码] A [文章编号] 1673-9701(2020)16-0028-04
The predictive significance of angiotensin II combined with PGA index for esophagogastric varices and bleeding in alcoholic liver disease
XU Yanli1 DENG Min1 WU Yiming2
1.Department of Infection, Jiaxing City the First Hospital in Zhejiang Province, Jiaxing 314000, China; 2.Institute of Hepatology, Jiaxing City the First Hospital in Zhejiang Province, Jiaxing 314000, China
[Abstract] Objective To explore the noninvasive evaluation of angiotensin II (Ang II) combined with PGA index for the degree of esophagogastric varices and the risk of bleeding in patients with alcoholic liver disease. Methods A total of 82 patients with alcoholic liver disease admitted to Tiaxing City First Hospital from June 2017 to June 2018 were selected for gastroscopy to evaluate the degree of esophagogastric varices. The blood Ang II level was determined, and the PGA index was calculated. The Ang II level and PGA index of patients with different esophagogastric varices were compared. The patients were followed up to 6 months. The diagnostic efficacy of Ang II and PGA index in predicting bleeding was compared. Results The Ang II of gastroscopic esophagogastric varices degree 0 group, degree 1 group, degree 2 group and degree 3 group were (2318.621±346.043)pg/mL, (2876.420±383.144)pg/mL, (3340.193±686.725) pg/mL, and (4204.723±997.436)pg/mL, and the PGA indexes were (2.858±0.210), (3.848±0.265), (5.446±0.585), and (7.944±0.891) respectively. Both Ang II and PGA index were related to the severity of esophagogastric varices. The correlation coefficient of Ang II was 0.701, P=0.001. The correlation coefficient of PGA index was 0.774, P=0.013. After 6 months of follow-up, the Ang II and the PGA index was (3705.471±784.323) pg/mL and (6.591±2.094) in the bleeding group. The Ang II of the non-bleeding group was(3185.862±914.118) pg/mL, and the PGA index was (4.851±2.234). The Ang II (sensitivity 0.765, specificity 0.646) and PGA(sensitivity 0.882, specificity 0.523) indexes in the bleeding group were significantly higher than those in the non-bleeding group, and the difference was statistically significant(P<0.05). Conclusion Ang II combined with PGA index can well predict the degree of esophagogastric varices and bleeding risk in patients with alcoholic liver disease. It can provide guidance advice for clinical doctors to timely judge the condition and take further measure.
[Key words] Angiotensin II; PGA index; Alcoholic liver disease; Esophagogastric varices; Bleeding
我国目前有数量庞大的饮酒者,饮酒时间超过5年,或2周内大量饮酒均有导致酒精性肝病的风险[1]。对于该类人群如不及时干预,病情会由初起时的轻型酒精性肝病逐渐发展为酒精性脂肪肝、酒精性肝炎,最终进展为酒精性肝硬化,并引起肝功能衰竭及各种并发症,其中食管胃底静脉曲张破裂出血是最严重的并发症及死亡原因之一[2]。多项研究指出,肝硬化伴急性上消化道出血者,出血急性期病死率可高达30%[3]。因此,临床医生如能及时筛选出食管胃底静脉曲张程度重、出血风险大的患者,并采取相应的干预措施,对降低肝病患者出血率、改善预后、提高生存率具有重要意义。目前胃镜是诊断食管胃底静脉曲张的金标准[4],但该项操作作为侵入性检查,患者依从性差,且易造成医源性再出血。现有相关研究指出,肝硬化患者肾素-血管紧素(Renin-angiotension system,RAS)系统被激活,血管紧张素Ⅱ(AngⅡ)升高,且AngⅡ水平与肝硬化程度、门脉高压程度均呈正相关[5-7]。PGA指数,包括国际化标准比值(INR)、谷酰转肽酶(GGT)、载脂蛋白A1,也已被证实与酒精性肝病肝纤维化程度相关[8]。本研究旨在分析非侵入性检查AngⅡ水平及PGA指数对酒精性肝病患者食管胃底静脉曲张程度及出血风险的评估,为临床医生提供可靠依据,现报道如下。
1 资料与方法
1.1一般资料
选取2017年6月~2018年6月嘉兴市第一医院收治的82例酒精性肝病患者。纳入标准[9]:有长期饮酒史(一般超过5年,折合乙醇量男性≥40 g/d,女性≥20 g/d),或2周内有大量饮酒史,折合乙醇量>80 g/d;临床症状为非特异性;血清AST、ALT、谷氨酸转肽酶(GGT)、TBIL、PT、平均红细胞容积和缺糖转铁蛋白等指标升高;肝脏B型超声、CT、MRI或瞬时弹性成像检查有酒精性肝病典型表现;取得患者知情同意并签署知情同意书。排除标准[10]:高血压、糖尿病、慢性呼吸系统疾病、恶性肿瘤等基础疾病者;嗜肝病毒现症感染、药物和中毒性肝损伤、自身免疫性肝病者;长期使用血管紧张素转换酶抑制剂、血管紧张素受体阻滞剂、β受体阻滞剂和钙通道阻滞剂等药物的患者。82例患者全部为男性,年龄34~84岁,平均(58.00±14.81)岁。所有患者均行胃镜检查评估食管胃底静脉曲张的程度:无曲张13例,轻度曲张19例,中度曲张32例,重度曲张18例。随访6个月,出现食管胃底静脉曲张破裂出血(包括呕血、黑便、大便OB阳性)患者17例,未出血患者65例。本项目经嘉兴市第一医院伦理委员会审查通过。
1.2 方法
1.2.1 胃镜检查 根据胃镜下血管形态对食管胃底静脉曲张患者进行严重程度分级[11],分为0级、1级、2级、3级。见表1。
1.2.2 AngⅡ检测 血液样本取自各项临床观察指标的同期,应用EDTA抗凝管收集,随即3000 r/min离心10 min分离血浆,置-80℃冻存待检。采用酶联免疫吸附法(ELISA)检测,试剂购自美国RB公司。
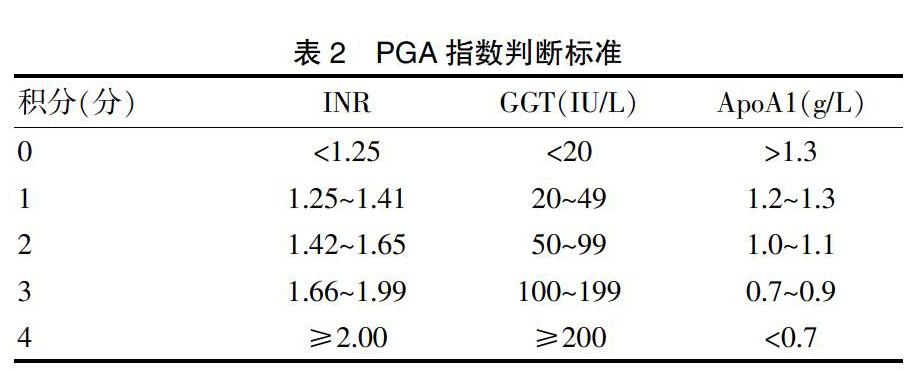
1.2.3 PGA指数测定 PGA指数诊断模型中,INR用希森美康CA7000凝血仪检测,GGT与ApoAl用贝克曼库尔特,AU542l用全自动生化仪检测。PGA指数判断标准见表2,每例患者根据三项指标的积分之和得出PGA指数,其值0~12[12]。
1.3 观察指标
观察食管胃底静脉曲张0级组、1级组、2级组、3级组患者的AngⅡ和PGA指数及6个月后出血组与未出血组患者AngⅡ和PGA指数及其预测出血的敏感度和特异度。
1.4 统计学处理
采用SPSS19.0统计学软件,计量资料以(x±s)的形式表示,方差齐性分析采用Levene检验,不同程度静脉曲张分组之间比较先行Kruskal Wallis秩和检验,再用Mann-Whitney U检验行各组间两两比较,相关性分析采用Spearman相关分析。应用ROC曲线分析AngⅡ和PGA指数诊断酒精性肝病食管胃底静脉曲张破裂出血的准确性,以胃镜结果为金标准,计算诊断二者的灵敏性、特异性,本研究以灵敏性和特异性之和最大时为最佳界限值。P<0.05表示差异有统计学意义。
2 结果
2.1 不同程度食管胃底静脉曲张分组的AngⅡ和PGA指数比较
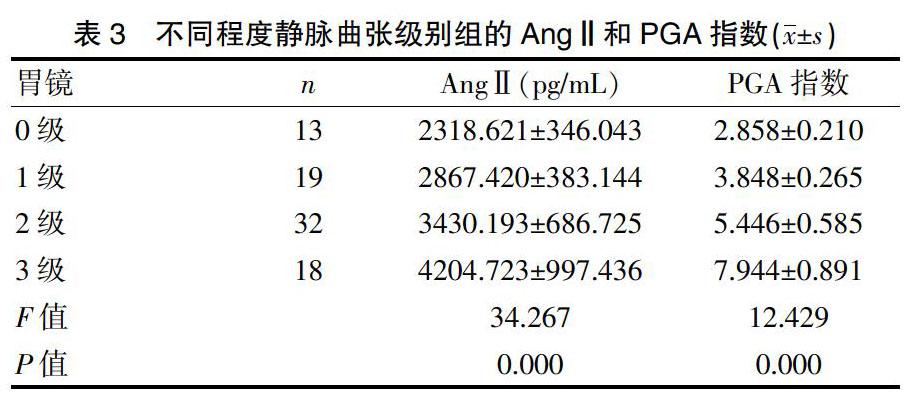
0级组、1级组、2级组、3级组的AngⅡ分别为(2318.621±346.043)pg/mL、(2867.420±383.144)pg/mL、(3430.193±686.725)pg/mL、(4204.723±997.436)pg/mL,PGA指数分别为(2.858±0.210)、(3.848±0.265)、(5.446±0.585)、(7.944±0.891)。食管胃底静脉曲张程度越重,AngⅡ和PGA指数均逐渐升高,且各级别组间差异均有统计学意义(P<0.05),见表3。AngⅡ和PGA指数均与食管胃底静脉曲张的严重程度相关,AngⅡ的相关系数为0.701(P=0.001),PGA指数的相关系数为0.774(P=0.013)。
2.2 出血组与未出血组的AngⅡ和PGA指数比较
出现食管胃底静脉曲张破裂出血的患者17例(包括呕血、黑便、大便OB阳性者),未出血患者65例。出血组的AngⅡ为(3705.471±784.323)pg/mL,PGA指數为(6.591±2.094);未出血组的AngⅡ为(3185.862±914.118)pg/mL,PGA指数为(4.851±2.234)。出血组AngⅡ和PGA指数均明显高于未出血组,差异有统计学意义(P<0.05)。见表4。
2.3 AngⅡ和PGA指数预测出血诊断效能比较
AngⅡ和PGA指数预测出血的ROC曲线下面积分别为0.709和0.734,最佳界值点分别为3203.00 pg/mL和4.50,敏感度分别为76.5%和88.2%,特异度分别为64.6%和52.3%。PGA指数预测出血的敏感度更高,AngⅡ预测出血的特异度更高。见表5、封三图1。
3 讨论
酒精性肝病(Alcoholic hepatitis)是由于长期大量饮酒导致的肝脏疾病,初期通常表现为脂肪肝,进而可发展成酒精性肝炎、肝纤维化和肝硬化,其主要临床特征是恶心、呕吐、黄疸,可有肝脏肿大和压痛,或并发肝功能衰竭和上消化道出血等。严重酗酒时可诱发广泛肝细胞坏死,甚至肝功能衰竭[13-14]。酒精性肝病是我国常见的肝脏疾病之一,目前在我国乙醇已成为仅次于肝炎病毒导致肝损害的第二大病因,严重危害人民健康。酒精性肝病治疗难度大,最终引起肝硬化及门静脉高压。食管胃底静脉曲张是门静脉高压的并发症之一,表现为侧支血管扩张,最常见于肝硬化,内镜下可见曲张静脉。欧美地区主要由酒精性肝病引起,而在世界范围内则以乙型和丙型肝炎病毒感染为肝硬化的主要原因[15-16]。一旦发生肝硬化,逐渐增加的肝静脉压力梯度和恶化的肝功能可能导致食管胃底静脉曲张形成,并可能发展至临界点,一旦破裂可引起致命性大出血。食管胃底静脉曲张破裂出血是肝硬化晚期的主要表现及死亡原因之一,常起病迅猛,病死率高,及时干预治疗可减少曲张静脉破裂出血的发生率,降低死亡率。曲张静脉的直径是其破裂出血最重要的预测因素,较大的精脉曲张直径每年增加15%的患者首次出血的风险最高。失代偿性肝硬化和内镜下的红痕征也是食管胃底静脉曲张破裂出血的重要预测因素[17]。胃镜虽然是诊断食管胃底静脉曲张及出血的金标准,但为侵入性操作,依从性差,反复操作难度大,因此寻找简便、非侵入性检测方法预测食管胃底静脉曲张程度及出血风险,成为临床研究的热点[18]。
目前,有多项研究证实RAS系统中的效应因子AngⅡ与肝纤维化、门脉高压严重程度有密切关系。AngⅡ能够刺激肝星状细胞增殖,并向肌成纤维细胞转化,能够促进细胞外基质合成,如无有效的治疗,将破坏肝脏的正常结构与功能,发展为肝硬化。研究发现AngⅡ水平在肝病患者中明显升高,且与肝硬化程度呈正相关[19]。相关研究发现PGA指数在诊断酒精性肝病、病毒性肝炎的肝纤维化程度上有较高的敏感性和准确性。研究显示:PGA≥3时,其肝纤维化诊断与病理组织学诊断符合率达86.25%,而PGA>6时,两者符合率达92.18%[20]。且PGA是临床常用的生化指标,各级医院能够开展,可广泛推广使用。
本研究发现,AngⅡ和PGA指数均与酒精性肝病患者食管胃底静脉曲张的严重程度相关,二者均能预测未来半年内食管胃底静脉曲张破裂出血的风险,检测方便,依从性高,可重复性大,为临床治疗策略的制定和治疗方法的选择提供可靠依据,且操作简便,易临床推广。但由于本项研究纳入病例偏少,还有待于进一步扩大研究证实。此外,AngⅡ和PGA指数是否能应用于其他肝病(如病毒性肝病、血吸虫肝病、自身免疫性肝病等),或预测其他并发症发生率,也有待进一步相关研究。
[参考文献]
[1] 中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会.酒精性肝病防治指南(2018年更新版)[J].中华肝脏病杂志,2018,26(3):188-194.
[2] Helmut KS,Ramon B,Helena C Pinto,et al.Alcoholic liver disease[J].Nature Reviews Disease Primers,2018,4(1):1-22.
[3] 屠军,陈金联,朱金水.Child-Pugh评分对肝硬化食管胃底静脉曲张出血患者预后风险因素的临床评估[J].临床消化病杂志,2016,28(1):39-41.
[4] 郭芸蕾,鲁晓岚,程妍,等.肝脾硬度联合门静脉宽度评估肝硬化食管胃底静脉曲张出血风险[J].中华肝脏病杂志,2016,24(1):56-61.
[5] Singal AK,Bataller R,Ahn J,et al.ACG clinical guideline:Alcoholic liver disease[J].The American Journal of Gastroenterology,2018,113(2):175-180.
[6] Goldberg D,Ditah IC,Saeian K,et al.Changes in the prevalence of hepatitis C virus infection,nonalcoholic steatohepatitis,and alcoholic liver disease among patients with cirrhosis or liver failure on the waitlist for liver transplantation[J].Gastroenterology,2017,152(5):1090-1099.
[7] 方戴瓊,李兰娟,郭静,等.血管紧张素Ⅱ水平与肝硬化严重程度的相关性[J].中华肝脏病杂志,2016,24(10):794-796.
[8] Osna NA,Donohue JTM,Kharbanda KK.Alcoholic liver disease:Pathogenesis and current management[J].Alcohol Research:Current Reviews,2017,38(2):147-150.
[9] 李琼,刘闪闪,徐丽红,等.肝、脾硬度预测食管胃底静脉曲张及出血风险[J].中国医学影像技术,2018,34(4):563-567.
[10] Stickel F,Datz C,Hampe J,et al.Pathophysiology and management of alcoholic liver disease:Update 2016[J].Gut and Liver,2017,11(2):173-180.
[11] Yang AM,Inamine T,Hochrath K,et al.Intestinal fungi contribute to development of alcoholic liver disease[J].The Journal of Clinical Investigation,2017,127(7):2829-2841.
[12] 杨志花,申凤俊,黄会芳.慢性乙型肝炎和肝硬化患者AngⅡ、Ang(1-7)及AngⅡ/Ang(1-7)比值的变化[J].中华临床医师杂志,2016,10(8):1062-1065.
[13] Dubinkina VB,Tyakht AV,Odintsova VY,et al.Links of gut microbiota composition with alcohol dependence syndrome and alcoholic liver disease[J].Microbiome,2017,5(1):141-150.
[14] Lackner C,Spindelboeck W,Haybaeck J,et al.Histological parameters and alcohol abstinence determine long-term prognosis in patients with alcoholic liver disease[J].Journal of Hepatology,2017,66(3):610-618.
[15] Llorente C,Jepsen P,Inamine T,et al.Gastric acid suppression promotes alcoholic liver disease by inducing overgrowth of intestinal enterococcus[J].Nature Communications,2017,8(1):1-15.
[16] 夏婷,张瑾,姚佳慧,等.氧化应激在酒精性肝病中作用机制的研究进展[J].中国药理学通报,2017,33(10):1353-1356.
[17] 杨冰冰,胡纯秋,胡永迪,等.維生素D缺乏与酒精性肝病的相关性研究[J].安徽医科大学学报,2019,54(8):1273-1276.
[18] 李苗苗.《2018年美国胃肠病学院酒精性肝病诊洽临床指南》椎荐意见[J].临床肝胆病杂志,2018,34(3):498-499.
[19] 张艳芳,黄晶.酒精性肝纤维化的血清标志物研究进展[J].临床肝胆病杂志,2018,34(3):623-626.
[20] 中华医学会肝病学分会脂肪肝和酒精性肝病学组,中国医师协会脂肪性肝病专家委员会.酒精性肝病防治指南(2018年更新版)[J].实用肝脏病杂志,2018,21(2):170-176.
(收稿日期:2019-9-10)

