我院125例住院患者使用丹参酮IIA磺酸钠注射液的安全性分析
石晓萍+李静+潘雯+吕迁洲

摘 要 目的:对丹参酮IIA磺酸钠注射液上市后的安全性进行评价,保障患者用药安全。 方法:收集并详细记录我院神经内科和内分泌科2015年9月—2016年3月使用丹参酮IIA磺酸钠注射液患者的用药情况以及安全性相关信息,采用描述性分析法总结分析发生不良事件的可能原因。结果:共收集了125例病例,未观察到严重不良事件发生,其中有7例患者发生了轻度不良事件,占5.6%。观察到的不良事件包括4例肝脏转氨酶水平异常升高,1例转氨酶水平异常升高伴粪隐血可疑阳性,1例转氨酶水平异常升高伴右前臂上臂瘀斑,1例出现左眼结膜出血,7例患者在使用丹参酮IIA磺酸钠注射液期间均联用其他可能导致该不良事件发生的药物如他汀类药物、抗栓药物等。结论:丹参酮IIA磺酸钠注射液总体安全性良好,但与他汀类药物和抗栓药物合用时仍需加强药学监护。
关键词 丹参酮IIA磺酸钠 安全性 他汀类药物 出血 不良事件
中图分类号:R286 文献标识码:C 文章编号:1006-1533(2016)19-0058-06
Safety analysis of sodium tanshinone IIA sulfonate injection in the treatment of 125 cases of inpatients*
SHI Xiaoping**, LI Jing, PAN Wen, LV Qianzhou***(Department of Pharmacy, Zhongshan Hospital, Fudan University, Shanghai 200032, China)
ABSTRACT Objective: To evaluate the safety of the marketed sodium tanshinone IIA sulfonate injection and to ensure the safety of medication. Methods: The information about the clinical applications and safety of sodium tanshinone IIA sulfonate injection used in department of neurology and endocrinology from September, 2015 to March, 2016 was collected and recorded in detail and the possible reasons of adverse events were analyzed by descriptive analysis. Results: One hundred and twentyfive cases of inpatients were collected, however, severe adverse events were not observed, among which mild adverse events occurred in 7 patients, accounting for 5.6%. There were 4 cases with the abnormal elevation of serum aminotransferase level, 1 case with the abnormal elevation of serum aminotransferase level and also with suspected positive fecal occult blood, 1 case with the abnormal elevation of serum aminotransferase level and also with right forearm ecchymosis, and 1 case with left eye conjunctival hemorrhage. These patients were administered with statins and antithrombotic drugs which may lead to such adverse events occurred when they underwent the treatment of sodium tanshinone IIA sulfonate injection. Conclusion: Overall, sodium tanshinone IIA sulfonate injection has a good safety, however, pharmaceutical care should be strengthened when it is used in combination with statins and antithrombotic drugs.
KEY WORDS sodium tanshinone IIA sulfonate; safety; statins; bleeding; adverse event
丹参酮IIA磺酸钠(sodium tanshinone IIA sulfonate,STS)是由唇形科植物丹参中分离的二萜醌类化合物丹参酮IIA经磺化后所得产物,水溶性好,生物利用度高,临床常用于冠心病、心绞痛、心肌梗死的辅助治疗,近年文献报道其对脑梗死、糖尿病周围神经病变、急性脑出血、椎基底动脉供血不足、肾功能衰竭等也具有一定疗效[1-5],故临床得以推广使用。但该药上市后在广泛人群中的用药安全性以及其在联合用药时的相互作用、配伍禁忌等方面仍有待进一步研究。为进一步促进临床合理用药,保障患者用药安全,本研究对STS在125例患者中的安全性进行分析评价。
1 研究方法
1.1 研究对象
2015年9月—2016年3月我院神经内科和内分泌科使用STS的住院患者。
1.2 研究内容
根据文献调研及临床病历研究,设计制定“STS应用安全性观察表”,记录内容包括:①患者基本信息(病历号、性别、年龄、临床诊断等);②用药情况(用药起止时间、用法用量、溶媒、联合用药等);③安全性评价指标(实验室指标:用药前后血常规、尿常规、粪隐血、肝肾功能等;临床不良事件或反应:用药后注射部位不良反应、药物过敏、可疑临床表现等)。
1.3 选择标准
入选标准:年龄18~85岁,男女不限;冠心病合并脑梗死、脑供血不足、糖尿病、末梢循环障碍疾病等。
排除标准:既往对丹参过敏者;合并严重肝肾功能损害(血浆丙氨酸氨基转移酶>正常上限3倍,血浆肌酐≥130 μmol/L);恶性肿瘤患者;妊娠者。
1.4 收集方法
通过筛选的研究对象纳入观察范围,每例患者逐项填写安全性观察表。如若患者发生不良事件,详细记录不良事件的临床表现、发生时间、严重程度、持续时间、采取措施和转归等,并进行随访追踪,直到得到妥善解决或病情稳定。
1.5 安全性评价
1.5.1 根据不良事件严重程度进行分级
轻度:患者可忍受,不影响治疗,不需要特别处理,对患者康复无影响;
中度:患者难以忍受,需要撤药或做特殊处理,对患者康复有影响;
重度:危及患者生命,致死或致残,需立即撤药或做紧急处理。
1.5.2 安全性评价四级标准
1级:安全,无任何不良反应;安全性指标检查无异常。
2级:比较安全,有轻度不良反应,不需做任何处理可继续给药,安全性指标检查无异常。
3级:有安全问题,有中等程度的不良反应,或安全性指标检查有轻度异常,做处理后可继续给药。
4级:因严重不良反应中止研究,或安全性指标检查明显异常。
2 研究结果
共收集到符合纳入标准的患者125例,有7例患者出现不良事件,占5.6%,其余患者观察期间未发生不良事件。
2.1 性别与年龄
125例患者中男性77例,占总人数的61.6%;女性48例,占总人数的38.4%;年龄分布在26~85岁,平均年龄为(63.81±10.92)岁,中位年龄为64岁。
2.2 用药情况
所有患者均为静脉滴注给药,STS每次给予40 mg,1次/d,使用0.9%氯化钠100 ml或250 ml为溶媒,使用时间最短2 d,最长17 d,平均用药时间7.37 d。
125例患者中,合并脑梗死43例,占34.4%;合并糖尿病66例,占52.8%,合并其他后循环障碍疾病16例,占12.8%。
使用STS期间,所有患者均联合使用了其他药物,涉及药物品种主要有心血管系统药物(抗血小板、降压、降脂药)、内分泌系统药物(降糖药)等。仅有2例患者静脉滴注STS与生物合成人胰岛素注射液进行了配伍,因说明书明确指出该药需单独使用,不宜与其他药物在注射器或输液瓶中混合,且有研究报道该药与优泌林R混合配伍时微粒超过了药典规定标准[6],故药师进行了用药干预,停止配伍使用改为STS单独静脉滴注。其余患者未见用药过程中存在明确的配伍禁忌。
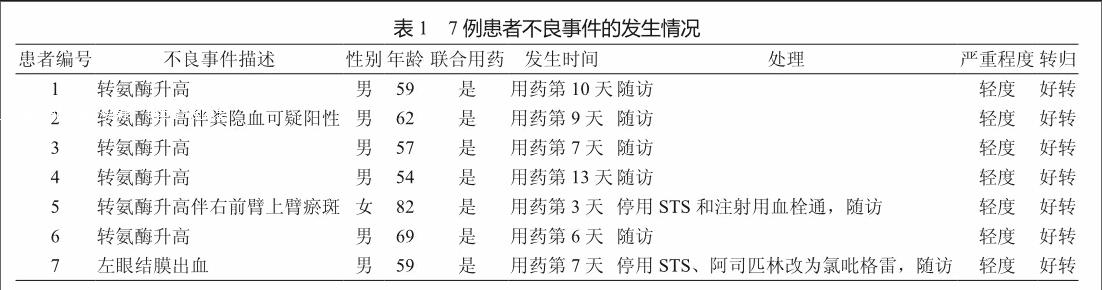
2.3 不良事件的发生情况及处理
125例患者用药期间未观察到STS可能引起的发热、过敏性休克、皮疹、恶心、腹痛、静脉炎等不良反应。其中7例患者发生不良事件,男性6例,女性1例;患者最小年龄54岁,最大年龄82岁,平均年龄为(63.14±9.55)岁,中位年龄为59岁。无食物药物过敏史。
发生不良事件的7例患者用药前肝脏转氨酶均正常,且无出血迹象,用药后 4例患者在用药第6~13天出现丙氨酸氨基转移酶(alanine amionotransferase,ALT)、天冬氨酸氨基转移酶(aspartate transaminase,AST)水平异常,用药后肝脏转氨酶水平超出正常数值上限,用药后ALT较用药前ALT升高约2~5倍;1例患者转氨酶水平异常升高伴粪隐血可疑阳性;1例患者转氨酶水平异常升高伴右前臂上臂瘀斑;1例患者用药第7天左眼结膜出血。
7例不良事件均为轻度事件,转氨酶水平异常及粪隐血可疑阳性患者为用药结束后复查实验室指标发现异常,瘀斑和结膜出血患者在不良事件发生后停止使用STS及相关可疑药物,7例患者未予特殊处理均好转(表1)。
7例发生不良事件的患者均为冠心病合并脑梗死,研究期间使用STS同时均联合使用了诸如改善微循环、脑保护剂、抗血小板、降脂等药物(表2)。
3 讨论
3.1 STS不良反应病例报告及相关文献资料
STS所致不良反应按累及器官或者系统可大致分为:全身性反应、皮肤及附件反应、心血管系统反应、神经系统反应、呼吸系统反应、局部反应、消化系统反应等,其中以全身性反应和皮肤及附件反应较为常见,临床表现多为寒战、发热、过敏性休克、皮疹、斑丘疹、皮炎等,心血管系统反应多表现为心悸、心慌、胸闷等,神经系统反应表现为头晕、头疼、两眼发黑等,偶见一例STS致咯血的呼吸系统不良反应报道[7],但未见引起肝脏转氨酶水平异常的报道。根据不良反应的统计结果显示,50岁以上人群中所占比例较高[8-9]。本研究中使用STS的患者没有出现文献报道的相关不良反应,这可能和样本量较小有关。在对丹参酮不良反应相关文献回顾性分析时发现,有些报道对患者的过敏史、其他药物的治疗史交代不详甚至没有交代,文献质量相对较低。
3.2 不良事件分析
3.2.1 性别与年龄
发生不良事件的7例患者中,男性6例,女性1例,男性比例明显高于女性,可能与收集病例男性所占比例较高有关,并无明显的性别差异。
年龄方面,患者最小年龄54岁,最大年龄82岁,平均年龄为(63.14±9.55)岁,中位年龄为59岁。结合文献资料以及本研究结果,不良事件(不良反应)在50岁以上人群中发生较多,可能与STS所治疾病的发病人群有关。该药常用于治疗冠心病、心绞痛、心肌梗死,近年也多用于脑梗死、糖尿病等疾病的辅助治疗,而心脑血管疾病的患病率随着年龄的增长呈上升趋势,造成用药人群年龄基数偏大,这对不良事件(不良反应)在高龄患者中发生较多有一定的影响。其次,老年人的生理情况不同于成人,肝、肾功能减退,药物血浆蛋白结合率偏低,清除率下降,使得药物半衰期有所延长,并且老年人对药物的敏感性增加,这些状况都会使不良反应的发生增加。
3.2.2 联合用药
3.2.2.1 肝脏转氨酶水平异常
发生肝脏转氨酶水平升高的6例患者均合并脑梗死,同时给予了抗凝、抗血小板、降脂、改善微循环、神经保护等常规治疗。4例患者ALT水平较用药前升幅较大(平均4.12倍),但未超过3倍正常上限(upper limits of normal,ULN),2例患者ALT>3 ULN,其中1例患者ALT>3 ULN且R>5,R=(ALT 实测值/ALT ULN)/(ALP 实测值/ALP ULN),符合国际医学组织理事会定义的肝细胞损伤型药物性肝损标准。STS主要通过肝脏进行代谢[10],药物及其代谢产物都可能直接对肝脏产生毒副作用,造成转氨酶水平异常升高。
另一方面,当同时或前后序贯使用两种或两种以上药物时,合并用药也可能引起该不良事件,并且可能因代谢环节产生作用的干扰,影响疗效甚至发生毒副作用。该6例患者用药期间均联合使用了他汀类药物,他汀类药物主要代谢部位在肝脏,一般耐受性良好,但可引起ALT、AST水平升高,与剂量相关。使用中低剂量的他汀类药物,转氨酶水平升高超过3 ULN的患者不到1%,且转氨酶水平升高呈一过性,维持原剂量治疗,70%的患者转氨酶水平可恢复正常[11]。本研究中的6例患者他汀类药物的日均用药剂量(阿托伐他汀20 mg、瑞舒伐他汀5~10 mg)均为中等强度,住院期间仅有1例患者发生不良事件后停用了瑞舒伐他汀,其他患者仍维持原剂量治疗。5例患者为首次使用他汀类药物,只有1例患者有一年多阿托伐他汀的用药史,未见转氨酶水平异常,但该患者入院后改用瑞舒伐他汀,在联合用药期间发生了转氨酶水平升高,较用药前升高约5倍。转氨酶水平异常也不排除STS与他汀类药物的联合作用。
丹参酮IIA主要被P450酶代谢,P450酶是体内参与药物代谢的重要酶系,可以被竞争、被诱导或抑制。用CYP3A4的典型底物咪达唑仑研究丹参酮IIA对CYP3A4的影响,结果显示丹参酮IIA不降低大鼠肝CYP3A4活性,但可减少小肠和肝脏中CYP3A4酶的表达[12-13],阿托伐他汀经CYP3A4进行代谢及生物转化,STS可能影响了阿托伐他汀代谢速率,使其血药浓度上升,从而引起转氨酶水平异常升高。毕惠嫦研究了丹参酮IIA对SD大鼠肝微粒体CYP450酶的影响,发现CYP2C19、CYP3A1、CYP2D6可能参与丹参酮IIA的代谢,同时丹参酮IIA对大鼠CYP1A2有很强的抑制作用[14],瑞舒伐他汀是P450代谢的弱底物,仅有少量主要经CYP2C9代谢,CYP2C19、CYP3A4和CYP2D6参与代谢的程度较低,但不排除其与STS合用时有潜在的药物相互作用发生导致血清转氨酶异常。此外,丁建刚[10]发现丹参酮IIA代谢过程中涉及的酶主要是CYP3A2、CYP2E1、CYP2C11、CYP2D1,这几种亚型的抑制剂和诱导剂都可能和丹参酮IIA发生相互作用,影响其代谢速率。可见,丹参酮IIA代谢涉及CYP酶的种类可能有很多,但目前对丹参酮IIA代谢研究仍旧有限,许多机制尚未明确,临床联合用药时还需密切观察,加强药学监护。因此,尽管2012年美国FDA发布了他汀类药物说明书修改的告示,推荐在服用他汀类药物前进行转氨酶检测,此后只有当临床需要时才检测转氨酶,但当STS与他汀类药物合用时,应仔细观察用药过程中患者的表现,适时进行转氨酶检测,关注治疗过程的安全性,避免出现较为严重的不良反应。
另外,对表2所列药品进行分析时,并不能排除因使用依达拉奉引起转氨酶水平异常升高。依达拉奉说明书写明其可引起肝功能异常,日本569例临床病例观察,ALT上升占8.23%,AST上升占7.71%,导致肝损的原因可能是依达拉奉给出电子后变成活性较弱的自由基,当达到一定浓度可致膜脂质过氧化,损害肝细胞[15]。但王蔚等[16]对依达拉奉应用安全性进行Meta分析,发现依达拉奉组转氨酶升高发生率与常规治疗组相同,没有统计学差异。
6例患者在用药期间无营养不良、酗酒、发烧、剧烈活动、体育锻炼等影响转氨酶水平的因素,因此该不良事件主要考虑可能与STS经过肝脏代谢且用药期间联合使用了他汀类药物及依达拉奉有关。
3.2.2.2 轻微出血事件
3例轻微出血事件患者均冠心病合并脑梗死,1例粪隐血可疑阳性、1例右前臂上臂皮下瘀斑以及1例左眼结膜出血,停止使用STS及相关可疑药物,未予特殊处理均好转。
机体维持正常的凝血功能除了依赖完整的血管壁结构和功能外,主要与血小板和凝血因子有关。当多种药物同时作用在血小板及凝血因子,使药物原有的效应增强,机体出血风险相对增大。由表2可见,发生轻微出血事件的患者在抗血小板药和STS联用的基础上加用了活血化瘀中成药。中国卒中指南推荐脑梗死患者应在发病后尽早给予阿司匹林(I级推荐,A级证据),不能耐受时可用氯吡格雷进行抗血小板治疗。STS能扩张小动脉,改善微循环,抗血小板聚集,降低血液黏度,与抗血小板药联用对脑梗死患者预后较好。疏血通具有活血化瘀、通经活络的功效,其有效成分水蛭和地龙均能使血液的凝血时间、凝血酶时间、凝血酶原时间延长,具有抗凝血作用,水蛭提取液还能降低血小板的聚集率;舒血宁其有效成分银杏叶可降低血小板黏附率延长凝血时间。在基础治疗上,两药均可进一步改善急性脑梗死患者神经功能缺损,提高临床疗效。但用药品种增多,药物发生相互作用的几率增大,阿司匹林和氯吡格雷作为抗血小板聚集药,它们和同样对血小板也有抗聚集作用的STS、疏血通、舒血宁合用时,产生协同效应,增加了出血风险。皮下瘀斑患者因病情需要同时还使用了那曲肝素钙[17],那曲肝素钙具有高强度抗凝血作用,抑制血小板活化和凝血酶生成。赵晓霞[18]对STS联合低分子肝素钙(该药现改名为那曲肝素钙)治疗不稳定型心绞痛的疗效观察时发现,观察组发生4例注射部位皮下瘀斑的不良事件,对照组无。
因此,排除饮食对粪隐血试验的干扰,患者未曾发生外伤,也不存在过度用眼、结膜炎症、血管性病变等影响因素,鉴于丹参酮IIA对凝血因子Xa和凝血因子IIA的抑制作用较弱[19],以往也几无出血不良反应报道,考虑本研究中这3例患者发生轻微出血可能与年纪偏大、同时使用STS、抗血小板药、抗凝药、活血化瘀中成药有关。故临床上若遇到类似患者时,建议加强药学监护,保障患者用药安全。
4 结语
随着人口老龄化趋势的发展,多种基础疾病共存或伴有复杂并发症的现象会越来越多,对患者进行联合用药必将成为较为普遍的治疗手段。STS已被证实在心血管方面具有抗心律失常、抗心肌肥厚、抗动脉硬化、缩小心梗面积、降低心肌耗氧量等作用,同时还能起到抗氧化、抑制肿瘤等作用,其作为中药单体注射剂与西药及其他中成药联用的情况日益增多,在促进疗效发挥的同时,其用药安全性问题也必将受到医务工作者以及患者的进一步重视。本研究中不良事件与STS直接相关性不强,不排除合并用药的影响,且为轻度事件,呈一过性,说明STS的总体安全性良好。但由于本研究为非随机对照的观察性研究且样本量有限,STS与其他药物联合使用安全性问题还有待进一步扩大样本量,多中心、前瞻性进行研究,以期更加客观准确的认识该药,促进临床合理应用。
参考文献
[1] 李春雷, 张峰. 丹参酮IIA磺酸钠注射液治疗脑梗死的疗效及对血清中Fibulin-5、vWF和P-选择素的影响[J]. 中国老年学杂志, 2015, 35(9): 2406-2408.
[2] 王华, 吴让兵, 高霞. 丹参酮IIA联合甲钴胺治疗糖尿病周围神经病变的疗效[J]. 中国老年学杂志, 2013, 33(7): 1512-1514.
[3] 程艳, 封丽芳, 郑玉明, 等. 丹参酮IIA磺酸钠治疗急性脑出血的安全性分析[J]. 中国医师进修杂志, 2014, 37(16): 17-18.
[4] 胡军. 丹参酮IIA磺酸钠治疗椎基底动脉供血不足36例临床观察[J]. 心脑血管病防治, 2008, 8(1): 62.
[5] 李澄湘. 丹参酮IIA磺酸钠在慢性肾功能不全患者中的应用[J]. 医学临床研究, 2007, 24(6): 1041-1042.
[6] 王楠, 宋小骏, 谢学建, 等. 丹参酮IIA注射剂与心血管药物及溶媒配伍可行性研究[J]. 南京医科大学学报(自然科学版), 2014, 34(5): 680-684.
[7] 高立群. 丹参酮IIA磺酸钠致咯血一例[J]. 华北国防医药, 2009, 21(5): 32.
[8] 舒东, 陈兴坚, 张荔. 丹参酮IIA磺酸钠注射液不良反应文献分析[J]. 中国实用医药, 2015, 10(9): 178-179.
[9] 王洪锐, 李东, 翁浩聪, 等. 丹参酮IIA磺酸钠注射液不良反应的流行病学特征研究[J]. 中国药业, 2014, 23(14): 43-45.
[10] 丁建刚. 丹参酮ⅡA多剂型的体内筛选和体外代谢研究[D]. 泰安: 泰山医学院, 2009.
[11] McKenney JM, Davidson MH, Jacobson TA, et al.Final conclusions and recommendations of the National Lipid Association Statin Safety Assessment Task Force[J].Am J Cardiol. 2006, 97(8A): 89C-94C.
[12] Yu C, Ye S, Sun H, et al.PXR-mediated transcriptional activation of CYP3A4 by cryptotanshinone and tanshinone IIA[J]. Chem Biol Interact, 2009, 177(1): 58-64.
[13] Qiu F, Wang G, Zhang R, et al.Effect of danshen extract on the activity of CYP3A4 in healthy volunteers[J]. Br J Clin Pharmacol, 2010, 69(6): 656-662.
[14] 毕惠嫦. 丹参酮ⅡA在大鼠体内的药代动力学及相关机制研究[D]. 广州: 中山大学, 2007.
[15] Nakamoto N, Tada S, Kameyama K, et al.A free radical scavenger, edaravone, attenuates steatosis and cell death via reducing inflammatory cytokine production in rat acute liver injury[J]. Free Radic Research, 2003, 37(8): 849-859.
[16] 王蔚, 印卫兵, 柏建岭, 等. 依达拉奉临床应用的安全性评价[J]. 中华神经科杂志, 2009, 42(7): 486-489.
[17] 李世林. 丹参酮IIA磺酸钠和低分子肝素钙治疗进展型脑梗死[J]. 医药论坛杂志, 2010, 31(6): 34.
[18] 赵晓霞. 丹参酮IIA磺酸钠联合低分子肝素钙治疗不稳定型心绞痛的疗效观察[J]. 医学理论与实践, 2012, 25(14): 1717-1718.
[19] 王琼. 泽兰和丹参中凝血因子Xa抑制成分的研究[D]. 南京: 南京中医药大学, 2013.

