高效液相色谱法测定乳清蛋白中的α-乳白蛋白和β-乳球蛋白及其改性降敏
赵倩如,朱丽英,赵权宇,江 凌
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 化学与分子工程学院,江苏 南京 211800;3.南京工业大学 食品与轻工学院,江苏 南京 211800)
近年来,过敏性疾病的发病率不断增加,食物过敏已成为一个重要的公共卫生问题。牛乳过敏(CMA)是一种最常出现的食物过敏反应[1],占所有确诊食物过敏病例的9%[2],婴儿牛乳过敏发病率从0.3%到7.5%不等[3]。牛乳过敏是由牛乳中的致敏蛋白引起的一种不良反应,主要由免疫球蛋白介导的免疫反应,可引起过敏性鼻炎、哮喘、湿疹、腹泻、胃肠出血等症状,甚至会导致过敏性休克,严重危及婴幼儿的生命[4]。牛乳中最具有营养价值的蛋白质是乳清蛋白,乳清蛋白中主要的致敏蛋白是α-乳白蛋白和β-乳球蛋白。
目前检测乳品中过敏原的方法主要有3种:高效液相色谱法(HPLC)、电泳法、免疫化学法。最常见的蛋白电泳方法是十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)[5-7]和毛细管电泳法[8]以及酶联免疫吸附(ELISA)法[9-10]通过抗原抗体特异性结合可以测定过敏原的免疫反应性(与免疫球蛋白结合的能力)。但以上方法在测定β-乳球蛋白时都具有一定的局限性,如电泳技术在定量方面有很大的不足;毛细管电泳重复性差,容易堵塞;ELISA方法对试剂的选择性高。牛乳中蛋白质种类很多,很难有效检测,以上技术局限性限制了这些方法在实践中的推广应用。反相高效液相色谱法是分析乳清蛋白成分的有效方法之一,与其他检测方法相比具有分辨率和回收率高、操作简便、重复性好等优势。反相高效液相色谱法可以高效实现大分子以及复杂物质快速分离,对乳品中α-乳白蛋白和β-乳球蛋白进行定性定量检测[11]。定量检测技术为开发市场中低过敏乳制品的质量提供了有效方法。另外,如何通过改性技术降低牛乳致敏性开发低致敏乳品[12]也成为研究的热点。
在食品加工过程中,主要采用的降敏方法有3种:物理[13]、化学[14]和生物学[15]方法。酶降解致敏蛋白[16-18]是最常见的一种方法,通过酶将大分子蛋白质水解成小分子肽以被吸收利用,可以降低过敏蛋白的致敏性。沈小琴等[19]研究发现胰蛋白酶、胃蛋白酶和碱性蛋白酶是最常用来水解牛乳中致敏蛋白的酶。
本研究中,笔者拟建立一种高效液相色谱技术定量检测乳清蛋白中主要致敏蛋白α-乳白蛋白和β-乳球蛋白的方法,同时评测该检测方法的可行性,选择胰蛋白酶作为酶解代表试剂处理乳清蛋白中的致敏蛋白,采用可视化优化方法预测最佳的酶解处理条件[20],以期为低致敏乳品的开发提供有效的检测方法和参考。
1 材料与方法
1.1 主要试剂
α-乳白蛋白标准品(纯度≥85%)、β-乳球蛋白标准品(纯度≥90%)、酪蛋白、分离乳清蛋白,上海源叶生物科技有限公司;三氟乙酸(色谱纯)、乙酸(分析纯),美国 TEDIA 公司;乙腈(色谱纯),上海凌峰化学试剂有限公司;胰蛋白酶,南京都莱生物技术有限公司;蒙牛牛奶、伊利婴儿配方奶粉,当地超市。样品及编号为1#,α-乳白蛋白标准品;2#,β-乳球蛋白标准品;3#,分离乳清蛋白;4#,蒙牛牛奶;5#,伊利婴儿配方奶粉。
1.2 主要仪器
DSHZ-300A型旋转式恒温水浴振荡器,太仓市实验设备厂;GA88-Ⅱ型超声破碎仪,无锡上佳生物科技有限公司;UltiMate 3000型戴安高效液相色谱仪色谱仪,Dionex公司;5804R型高速冷冻离心机,德国Eppendorf公司;GZX-9140型电热恒温鼓风干燥箱,上海博讯实业有限公司;GTL100型恒温金属浴,北京莱普特科学仪器有限公司。
1.3 主要溶液及配制
醋酸缓冲液。3.86 g冰醋酸和2.93 g无水醋酸钠加入蒸馏水定容至1 L。
标准品溶液。分别准确称量α-乳白蛋白标准品、β-乳球蛋白标准品4 mg,加入2 mL蒸馏水进行溶解,配制成2 mg/mL的标准储备液,吸取适量标准储备液,加入蒸馏水进行稀释,稀释成质量浓度为2、1、0.5、0.25、0.125 mg/mL的标准溶液。
样品溶液。准确称量样品,加入蒸馏水定容至100 mL,待测。牛奶按照文献[21]优化的方法进行处理,将新鲜的牛奶以5 000g转速低温冷冻离心20 min去脂肪,去脂肪上清液和醋酸缓冲液等体积混合,以8 000g离心10 min,取上清液待测。
1.4 检测条件
1.4.1 高效液相色谱条件
流动相A为0.1%三氟乙酸水溶液,流动相B为0.1%三氟乙酸乙腈溶液,流速为1.0 mL/min,紫外检测器检测波长为280 nm,检测温度为25℃,进样量为10 μL。梯度洗脱条件具体见表1。

表1 梯度洗脱条件
1.4.2 流动相及相关溶液前处理
1)流动相A、B以及洗脱液配制完成后需要在简易抽滤装置下进行去除杂质;
2)流动相在进行抽滤过后进行超声,20 ℃条件下超声30 min以去除气泡;
3)样品以及标品溶液在上样之前用0.22 μm的滤膜进行过滤处理。
1.4.3 方法学验证
1)样品中的蛋白含量X的计算见式(1)。
(1)
式中:X为试样中的蛋白含量,以100 g样品计算;C为蛋白的质量浓度,mg/mL;V为试样的实际稀释液总体积,mL;m为样品质量,g。
2)利用外推法求得样品分析方法的检出限,分别取3种低浓度样品平行测定3次,求出每种浓度的相对标准偏差,用线性回归法做出拟合曲线,拟合曲线相交于y轴的点,为S0,则3S0为样品分析方法的检出限。
3)分别进行样品分析方法的精密度、稳定性以及样品回收率的探究,每组实验重复测定3次,取数据的平均值作为检测结果。
1.5 胰蛋白酶降解
1.5.1 样品预处理
将样品4#(市售的牛乳)进行脱脂,将脱脂牛乳加热至85 ℃,维持10 min以使得蛋白充分变性,调节恒温混匀仪至水解温度,以600 r/min的转速进行充分混合水解,水解结束后加热至120 ℃使酶失活。改变酶解温度、时间、酶量,多次进行实验。
1.5.2 智能可视化软件优化
采用可视化优化方法对酶解工艺条件进行分析处理,预测出最佳的酶解工艺条件。首先确定酶解条件的区间,酶解条件作为多维空间中的向量,再利用映射模型将多维空间中的简单数据映射到二维平面,在该平面中自动生成目标函数或轮廓的轮廓。根据轮廓的分布直观地定位优化的操作方向或区域,最后在该区域中找到接近最优的点,可以用反演映射方法映射回原始的多维空间,预测出最优酶解条件[22]。
2 结果与讨论
2.1 高效液相色谱法测定方法相关结果
相比于C4柱,选用常见且分离效果更佳的C8柱对α-乳白蛋白和β-乳球蛋白进行分离,以280 nm为检测波长,目标物出峰时间短,分离效果好。图1为1 mg/mL的α-乳白蛋白和2 mg/mLβ-乳球蛋白标准色谱图。由图1可知,这两种蛋白的分离峰形尖锐、分离度较好。其中,α-乳白蛋白在12.1 min出峰,β-乳球蛋白在14.5 min出峰,β-乳球蛋白出现双峰。根据Brownlow等[23]报道,β-乳球蛋白随着pH变化会发生构象改变,通常它是以二聚体的形式存在,当pH低于3.5或高于7.5时,二聚体解离且构象发生变化,形成膨胀的单体。

图1 α-乳白蛋白标样和β-乳球蛋白标样谱图
2.2 方法学验证
2.2.1 线性关系
根据配制的一系列标准品浓度,分别绘制α-乳白蛋白和β-乳球蛋白的标准曲线,对所得曲线进行线性回归分析,具体的线性方程和数据结果如表2所示。

表2 蛋白线性方程及检出限
由表2可知,对于2种致敏蛋白,所构建的标准曲线在0.125~2.000 mg/mL的质量浓度范围内呈线性关系,其相关系数均大于0.99,说明线性关系良好。这种外标法可以快速定量分析样品中α-乳白蛋白和β-乳球蛋白浓度。
2.2.2 定量限(LOQ)和检出限(LOD)
定量限结果发现,产生所需精密度和准确度的定量α-乳白蛋白和β-乳球蛋白分别为0.062 5和0.080 0 mg/mL。换算成样品(以每100 g试样计算)中的含量α-乳白蛋白为0.03 g,β-乳球蛋白为0.02 g。α-乳白蛋白定量限达到食品安全地方标准(DBS 32/011—2016)为0.03 g,β-乳球蛋白定量限略高于团体标准(T/TDSTIA 007—2019)为0.018 g。
仪器检出限结果显示α-乳白蛋白为0.090 0 mg/mL和β-乳球蛋白为0.100 0 mg/mL。结果发现α-乳白蛋白和β-乳球蛋白检出限分别为0.078 0和0.090 0 mg/mL。
2.2.3 精密度
精密度是保证准确度的先决条件。为了进行此次精密度探究,利用α-乳白蛋白和β-乳球蛋白3种不同浓度的标准溶液进行评估,结果见表3。由表3可知,相对标准偏差(RSD)均小于5%,说明该方法对蛋白质具有测量的再现性。
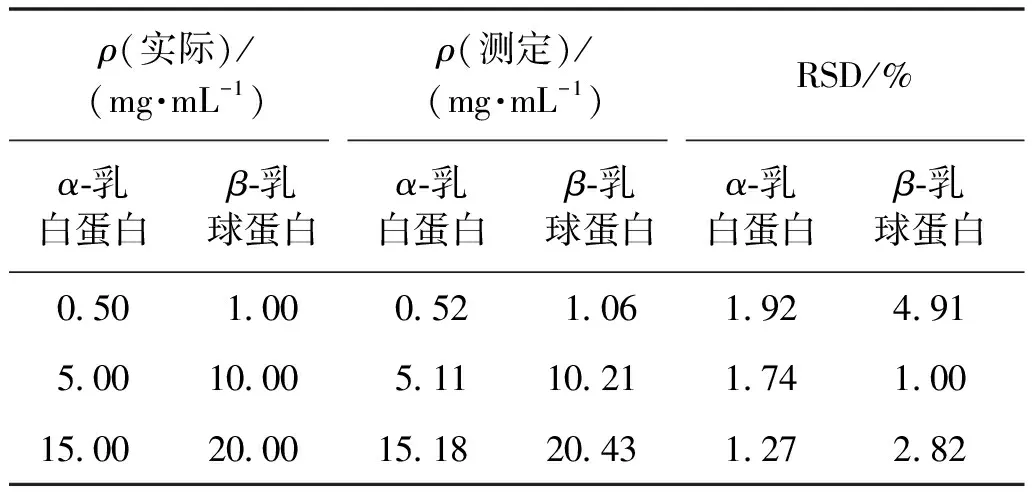
表3 蛋白质检测精密度数据
2.2.4 特异性
以样品3#为代表进行特异性探究,分别对未处理和经过处理的样品溶液进行分析检测,结果见图2。由图2可知,经过处理后的2种蛋白的色谱峰峰形尖锐,分离效果好,说明该分析方法对α-乳白蛋白和β-乳球蛋白具有特异性。

图2 不同条件下的色谱图
2.2.5 稳定性研究
将配制好的5种样品的新鲜溶液和经过48 h冷藏后的储备溶液平行测定3次,研究分析方法的稳定性,结果如表4所示。由表4可知,经过48 h后的冷藏储备液并没有明显的降解,相对标准偏差(RSD)均小于5%,说明该方法能在48 h内实现蛋白含量的稳定定量测定。
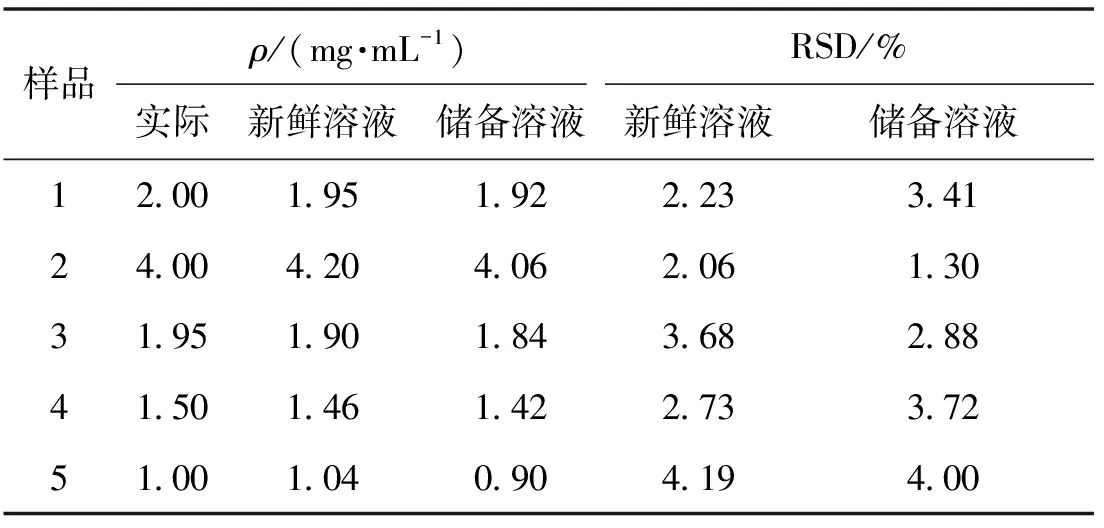
表4 稳定性实验结果
2.2.6 回收率实验结果
分别取样品4#和样品5#各1 mL,每份样品中等体积加入标准品混合溶液(0.2 mg/mL的α-乳白蛋白溶液和0.4 mg/mL的β-乳球蛋白等体积混合),如前所述进行蛋白含量分析,每组实验平行测定3次,结果如表5所示。由表5可知,相对标准偏差(RSD)小于5%,回收率在92%~96%,表明该方法可以实现样品较高的回收率。

表5 加样回收率测定结果
2.2.7 不同样品中致敏蛋白含量测定
利用该色谱分析方法分别对样品3#、4#和5#进行了2种致敏蛋白的含量测定,具体结果如表6所示。由表6可知,该方法能够实现不同乳品中致敏蛋白含量的检测。值得注意的是样品5#(婴儿配方奶粉)中α-乳白蛋白和β-乳球蛋白的含量较低,说明婴儿配方奶粉中的致敏蛋白含量已经受到控制,不同乳制品中致敏蛋白含量也有所差异,牛乳比婴幼儿配方奶粉中β-乳球蛋白含量要高,会更容易出现过敏现象。

表6 样品测定结果
2.3 胰蛋白酶水解
相比于一些物理化学降解方法,酶降解是一个温和有效的过程,研究表明胰蛋白酶可以有效地降解致敏蛋白,首先设计单因素变量法考察酶降解影响因素(温度、酶量、水解时间),每组实验平行测定3次,取数据的平均值作为测定结果,其次进行正交试验,最后利用可视化方法预测出最佳的酶解条件。
2.3.1 单因素变量实验结果
2.3.1.1 温度对酶解效果的影响
选取样品4#作为水解底物,将牛乳按照之前所述进行处理,分成15份作为水解底物,水解底物为1 mL脱脂牛乳。另外,脱脂牛乳保留1份作为原液进行测定。将胰蛋白酶配制成1 g/L的酶溶液,按照高酶量6 000 U/g胰蛋白酶加入到样品溶液中,按照之前所述方法进行水解,水解时间设为30 min,温度梯度设置为25、35、40、45和50 ℃,最后测得水解底物中剩余致敏蛋白浓度。具体结果表7所示。由表7可知,胰蛋白酶在一定的酶量和酶解时间下,在40 ℃水解条件下最佳,温度过高或者过低水解效果均不佳。因此,在40 ℃左右分别取2个温度作为酶解温度的最佳区间(35、40和45 ℃),作为温度因素的3个水平。

表7 不同温度下的酶解结果
2.3.1.2 酶量对酶解效果的影响
根据温度实验的结果,在40 ℃条件下按照各酶量加到样品溶液中水解,30 min后测定水解底物中剩余致敏蛋白浓度,具体结果如表8所示。由表8可知,在一定水解温度和水解时间条件下,酶量与水解效果成正比,但是当超过6 000 U/g胰蛋白酶时,水解效果下降不再明显。为了保证牛乳中营养成分的同时降低致敏蛋白的含量,本研究以接近母乳中蛋白含量为标准,使用1 000、1 500和2 000 U/g胰蛋白酶为酶量的3个水平。
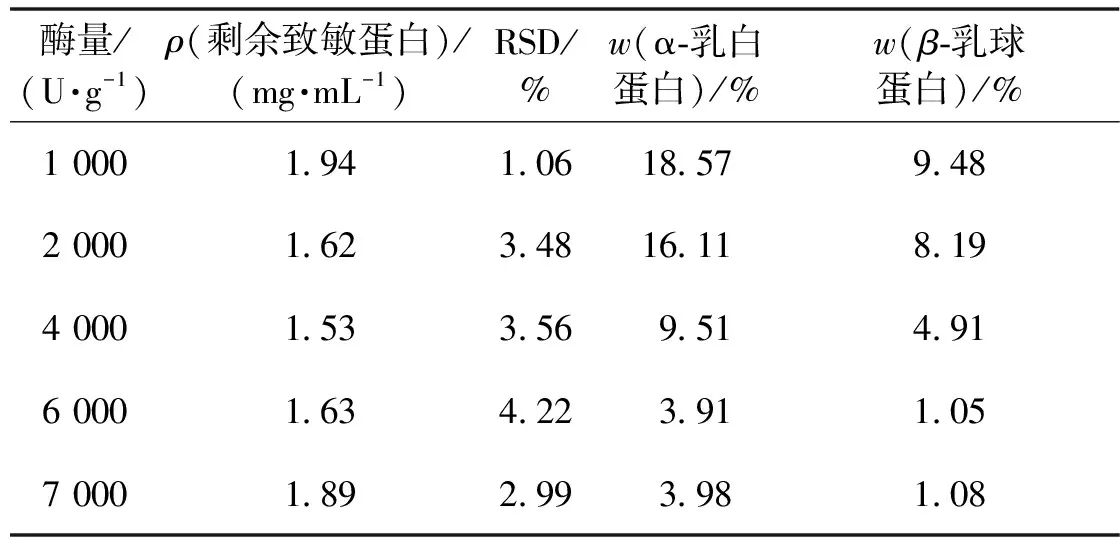
表8 不同酶量下的酶解结果
2.3.1.3 水解时间对酶解效果的影响
根据温度、酶量实验的结果,在温度40 ℃、1 000 U/g胰蛋白酶的条件下进行水解,水解时间为10、20、30、40和50 min,最后测得水解底物中剩余致敏蛋白浓度,具体结果如表9所示。由表9可知,随着时间不断延长,降解效率越来越高,同样为了保证乳制品中乳清蛋白的营养不被完全破坏,保持低浓度的β-乳球蛋白,选择水解时间为20、30和40 min作为时间因素的3个水平。
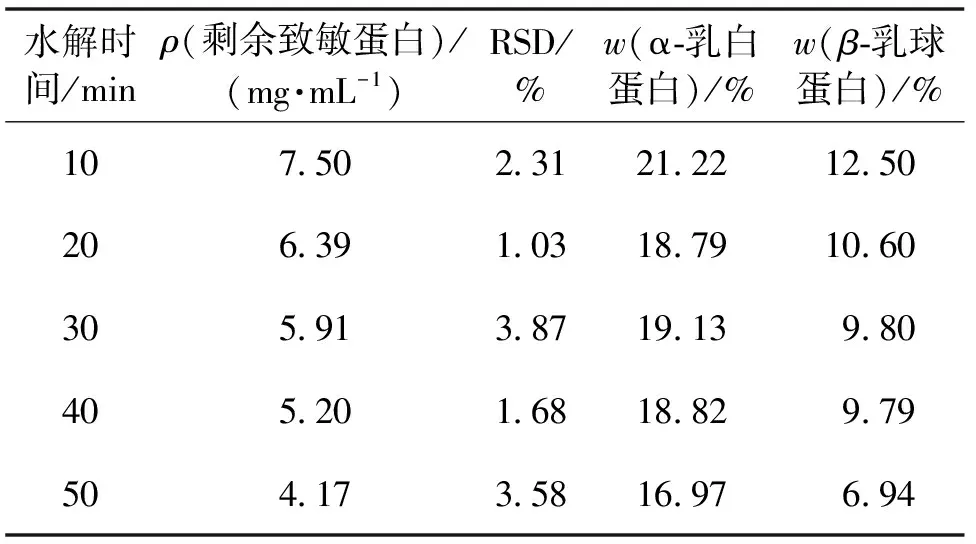
表9 不同时间下的酶解结果
2.3.2 多因素变量实验
设计正交试验,根据单因素变量的实验结果,分别挑选温度、酶量、水解时间最优区间进行正交试验,结果以剩余蛋白浓度为标准,具体结果见表10和表11。

表10 正交试验结果

表11 极差分析
由表10~11结果确定了正交试验最优处理条件:温度40 ℃、1 500 U/g胰蛋白酶、水解时间40 min。
2.3.3 可视化方法优化


表12 可视化优化方法的优化结果

图3 胰蛋白酶降解工艺降维映射平面图
可视化误差分析如表13所示。由表13可知,可视化优化方法可用于预测最优化酶解条件。

表13 可视化优化方法误差分析
2.3.4 最优酶降解条件
根据正交试验和可视化方法得到的酶解最优条件进行实验,每组进行3次行平行测定,结果如表14所示。预测胰蛋白酶水解的最佳条件为温度45 ℃、2 000 U/g胰蛋白酶、水解30 min。由表14可知,在此条件下水解率已达到较高值,且致敏蛋白在蛋白质中比例接近母乳(23%)说明营养没有被破坏,此条件可作为胰蛋白酶水解的最佳条件。

表14 最佳条件酶解
3 结论
利用反相高效液相色谱法采用Sepax-C8色谱柱对乳清蛋白中α-乳白蛋白和β-乳球蛋白含量进行检测分析,并且评测了该方法的可行性,在该方法下样品中的α-乳白蛋白和β-乳球蛋白出峰时间短,分离效果好。同时进行了精密度、稳定性和回收率实验,结果RSD均小于5%,也证实了方法的可行性。利用胰蛋白酶降解致敏蛋白,采用智能可视化优化方法预测最优酶解条件,结果表明在45 ℃下加入2 000 U/g胰蛋白酶水解30 min后,2种致敏蛋白含量占总蛋白的22.7%,大大降低了乳品中的致敏蛋白含量。本次研究可为乳制品的质量评价及生产低致敏乳品提供依据。

