碘对大鼠钠碘转运体基因启动子区甲基化的影响
董小婉, 陈婷婷,吴 翌,金秀兰,汪靓婧,周换丽,王佑民
碘摄入量的多少与甲状腺疾病的呈U关系,U字型的底端是最适宜人类的最佳碘剂量,无论碘的摄入量是过低还是过高,都会增加甲状腺疾病的患病风险。由碘摄入量不足引起的碘缺乏病,通过推行全民食盐碘化已得到极大改善,但同时人群中碘营养水平处于碘超足量和过量的个体数量在增多。近年来甲状腺疾病的发病率不断上升,临床专家和公卫专家意见不一致,临床认为甲状腺疾病的增多与碘盐有很大关系,摄入过多的碘致使甲状腺疾病增多,但是目前有关其作用机制的研究还比较缺乏[1]。钠/碘共同转运体(Na+/I-symporter,NIS)是一种跨膜糖蛋白,主要表达于甲状腺滤泡细胞基底膜上,是甲状腺细胞摄取碘的分子基础。如果NIS蛋白的表达缺失或功能异常,就会造成甲状腺摄取、聚集和利用碘功能的异常[2]。故该研究构建不同碘营养水平的大鼠动物模型,分析不同碘营养水平对大鼠甲状腺NIS基因启动子区甲基化的影响,探讨碘是否通过该途径影响NIS的表达而参与甲状腺疾病发生。
1 材料与方法
1.1 标本来源选用35~42 d, 体质量150~170 g的SPF级雌性SD大鼠40只,购自安徽医科大学实验动物中心,实验动物质量合格证号:NO.340000200001326, 按随机数字表法分为5组:低碘组(LI组)、适碘组(NI组)、5倍高碘组(5HI组)、10倍高碘组(10HI组)、20倍高碘组(20HI组)。大鼠饲养条件:温度(22±2) ℃,湿度45%~70%,昼夜交替各12 h。均给予低碘饲料(平均碘含量小于50 μg/kg);LI组饮用去离子水(碘含量为0 μg/L), NI组、5HI组、10HI组及20HI组均饮用加碘化钾的去离子水。按大鼠每日进食20 g, 进水20 ml估计每只大鼠每日的总摄碘量为:LI组<1.00 μg;NI组6.15 μg;5HI组30.75 μg;10HI组61.50 μg;20HI组123.00 μg。饲养3个月后处死。
1.2 方法
1.2.1标本制备 使用代谢笼收集每只大鼠24 h尿标本, 水合氯醛0.3 ml/100 g体质量,腹腔注射麻醉,下腔静脉取血,2 000 r/min离心10 min,分离血清于-80 ℃保存待测游离三碘甲状原氨酸 (free triiodothyronine,FT3)、 游离甲状腺素(free thyroxine,FT4)、促甲状腺激素(thyroid stimulating hormone,TSH);剥离甲状腺,称重后于液氮保存。
1.2.2尿碘和激素测定 尿碘采用电感耦合等离子体质谱法(inductively coupled plasma mass spectrometry,ICP-MS)测定,尿碘与给碘剂量呈正相关提示造模成功。血清 FT3、FT4、TSH由安徽医科大学第一附属医院内分泌实验室釆用化学发光技术的竞争免疫法(美国西门子公司试剂盒)测定,应用德国西门子医学诊断有限公司化学免疫分析仪(型号: ADVIA centaur XP)。
1.2.3免疫组化检测NIS蛋白表达 每组随机选取2只大鼠甲状腺石蜡切片脱蜡水化,柠檬酸缓冲液微波抗原修复,3% H2O2室温孵育10 min,磷酸盐缓冲液(PBS)清洗,滴加大鼠NIS抗体,工作浓度为1 ∶400,4 ℃冰箱过夜,滴加二抗聚合物,37 ℃孵育30 min,缓冲液清洗,DAB显色,苏木精复染,脱水,透明,树脂封片,阴性对照用缓冲液替代一抗。 400倍光镜下每张切片随机取5个视野,使用Image Pro Plus图像分析软件分析累积光密度值。
1.2.4硫化测序PCR(bisulfite sequencing PCR,BSP)法检测甲基化 每组随机选取3只大鼠,使用天根生化科技(北京)有限公司的组织DNA提取试剂盒, 按照说明书的步骤提取甲状腺组织DNA。按DNA亚硫酸氢盐修饰试剂盒(德国QIAGEN公司)使用说明书操作进行DNA的亚硫酸氢钠修饰及纯化回收。通过NCBI查找大鼠NIS基因(Gene ID:114613)启动子区域,选择转录起始前2 000 bp至第一个外显子作为分析区域。采用生物信息学在线网站MethPrimer对基因启动子区域CpG岛进行分析,经预测发现NIS基因启动子区域具有2个CpG岛,长度分别为137 bp和556 bp。因为2个甲基化区域挨的很近且较大,因此划分为两个反应进行的。根据 NIS 基因序列设计NIS基因CpG岛引物如下:① F:5′-AGTTGYGGAGAAAGGTAGATGTTTTTTGG G-3′,R:5′-CTACAAATTTATTAAACTCCAAAATCAA CRC-3′;② F:5′-TTTATYGAGTTATTTGTTTTTATGG AGGGTG-3′,R:5′-CRACAAAAAAAAAAACRCTAT AAACAACRA-3′。扩增产物长度分别为363 bp和342 bp,引物由华大基因科技有限公司合成 。扩增条件为:95 ℃预变性10 min。40个热循环 (94 ℃ 30 s、退火30 s、72 ℃ 40 s), 72 ℃延伸5 min。将目标片段割胶纯化。PCR 产物纯化后连接克隆载体,采用Generay 的PGH(Lot:GV0108)作为载体,XL10-Gold感受态进行转化、复苏和涂板。挑取质粒送北京六合华大基因科技有限公司测序,使用BiQ Analyzer v2.0对测序的结果进行对比和甲基化分析。
2 结果
2.1 各组血清甲状腺激素水平与适碘组比较,低碘组和各高碘组血清FT3 浓度均降低,差异有统计学意义(P<0.05);但低碘组与各高碘组比较,血清FT3水平无明显差异。与适碘组比较,低碘组和各高碘组血清FT4略增高,但差异无统计学意义(P>0.05);大鼠血清 TSH 各组间比较,低碘组、适碘组、各高碘组的血清TSH水平差异无统计学意义(P>0.05)。见表1。
表1 大鼠血清甲状腺激素水平的检测结果
2.2 各组NIS蛋白表达水平与NI组比较,LI组大鼠甲状腺组织中NIS表达水平升高,差异有统计学意义(P<0.05);而10HI组及20HI组大鼠甲状腺组织中NIS表达水平低于NI组(P<0.01),5HI组与NI组比较差异无统计学意义(P>0.05)。见图1、2。
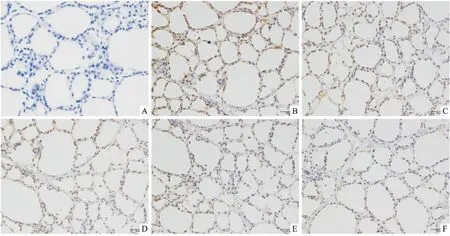
图1 大鼠甲状腺中NIS表达水平 DAB染色×400

图2 各组大鼠甲状腺组织中NIS蛋白表达量
2.3 各组NIS基因CpG岛甲基化比较经分析显示NIS基因启动子区域有2个CpG岛(Island 1,CpG1;Island 2,CpG2),见图3。每个CpG岛平均甲基化率=[CpG岛甲基化的CpG个数(m)/该CpG岛总 CpG 个数(M)]×100%。比较各组CpG1甲基化比率及CpG2甲基化比率差异无统计学意义(P>0.05);本文还研究了NIS启动子区域-420至-110碱基序列(CpG3),与适碘组比较,低碘组和各高碘组CpG3甲基化比率降低,但差异无统计学意义(P>0.05)。见表2。

表2 各组NIS基因CpG岛甲基化情况(n=3)
3 讨论
甲状腺是人体最大的内分泌腺,功能是合成甲状腺激素,对几乎所有组织的代谢调节都至关重要。碘严重缺乏致使甲状腺功能减退,影响儿童神经及智力发育,同时诱发甲状腺功能亢进症。而碘过量摄入也可引起各种疾病,如甲状腺自身免疫病,甚至甲状腺癌等。补碘政策实施后,我国碘缺乏病发生率大大降低,但西部偏远地区仍存在严重碘缺乏情况。另外,高碘摄入、区域过量碘摄入引发的各种疾病,成为我们必须高度关注的问题[3]。总之,进一步明确碘摄入量对甲状腺疾病的影响,了解其作用机制才能控制甲状腺疾病的发生,保证居民的身体健康。本研究用不同浓度碘饲养大鼠,3个月后检测尿碘提示尿碘与给碘剂量呈正相关,说明本研究大鼠造模成功[4]。低碘组和各高碘组与适碘组相比,血清FT3差异有统计学意义,说明碘对大鼠血清甲状腺激素水平有影响;与李思果 等[5]研究结论一致。
人NIS(hNIS)又称SLC5A5(solute carrier family 5 member 5),基因位于19号染色体(19p13.11)上,高度专一且有效地编码80~90 ku跨膜糖蛋白,介导碘从血流到甲状腺滤泡细胞的主动转运。此运输通过Na+/K+-ATPase泵产生的能量梯度完成,这是甲状腺激素生物合成关键的第一步[2]。编码hNIS的cDNA与鼠NIS(rNIS)相似。使用 rNIS cDNA序列的引物通过PCR从人甲状腺乳头状癌组织中扩增出hNIS的cDNA片段,该cDNA片段用于筛选人类甲状腺cDNA文库,编码hNIS的单个cDNA克隆被分离。hNIS基因有含1929个核苷酸的开放阅读框,它编码643个氨基酸的蛋白质。hNIS基因编码84%的氨基酸和rNIS有93%的相似性,仅因rNIS蛋白水平中不存在的两次插入而有所不同:5个氨基酸插入在最后两个疏水域之间(氨基酸485-488和499)和20个氨基酸插入在羧基末端(氨基酸618-637)[6]。

图3 NIS基因启动子区域CpG岛分析结果
叶艳 等[7]利用组织芯片分析NIS在不同碘摄入量下的大鼠组织器官的分布及表达,研究发现,与适碘组比较, NIS在低碘组甲状腺滤泡上皮细胞基底膜呈线性分布强表达, 而在高碘组较弱表达;本研究利用免疫组化检测大鼠甲状腺NIS蛋白的表达也得出了上述结论,进一步证实了碘影响大鼠甲状腺组织中NIS蛋白表达,但具体的、精确的机制尚需进一步探讨。近年研究发现,表观遗传学会是疾病发生的重要机制,主要有以下调控方式:DNA甲基化、组蛋白修饰、非编码RNA等机制。许敬 等[8]应用实时荧光甲基化特异性聚合酶链反应(real-time methylation-specific PCR,qMSP)分别检测152例甲状腺乳头状癌组织及癌旁正常组织中NIS基因启动子区5′-CpG岛的甲基化情况,研究表明,与癌旁正常组织相比,甲状腺乳头状癌组织中NIS基因启动子区5′-CpG岛的甲基化率显著升高,致使甲状腺恶性肿瘤中NIS基因表达降低;这与Galrão et al[9]研究是一致的。本文通过前瞻性的研究,分析碘摄入量对大鼠甲状腺NIS基因启动子区5′-CpG岛甲基化是否有影响。对通过MethPrimer网站预测的基因启动子区域两个CpG岛进行分析,研究显示各组大鼠对应的两个CpG岛均未见明显差异。Serrano-Nascimento et al[10]报道调控大鼠NIS基因表达的区域主要包含位于近端启动子相对于转录起始位点-110~-420的核苷酸,以及影响TSH的增强剂(NUE),在-2 264和-2 495核苷酸之间;故本研究进一步分析-110~-420的核苷酸序列(CpG3)CG位点甲基化情况,发现各组之间仍无显著性差异。Lakshmanan et al[11]研究显示在甲状腺恶性肿瘤中microRNA(miR)可以调节NIS蛋白的表达,miR-339-5p过表达降低了表达外源性hNIS HEK293细胞中NIS介导的放射性碘摄入(RAIU)。Li et al[12]及Tang et al[13]研究分别发现miR-146b和miR-875-5p也可以调节NIS的表达。Puppin et al[14]研究表示组蛋白脱乙酰基酶(HDAC)抑制剂可激活甲状腺肿瘤细胞中的NIS表达。这提示碘可能通过组蛋白修饰、miR等其他机制调节甲状腺组织中NIS表达。
本研究利用BSP法检测不同碘摄入量大鼠甲状腺NIS基因启动子区5′-CpG 岛甲基化情况,结果显示在各组大鼠中DNA甲基化无明显差异,但不同碘营养组NIS表达存在差异,提示碘可能通过其他机制调节NIS的蛋白表达。

