利用泌汗功能筛查2型糖尿病患者肾脏病变
周善磊,章诗琪,邓大同
近年来,2型糖尿病(type 2 diabetes,T2DM)的发病率在全球范围内逐年升高,如何在早期有效发现进而及早治疗其慢性并发症已成为当今国内外学者密切关注的课题。糖尿病肾脏病变(diabetic kidney disease,DKD)是糖尿病主要慢性并发症之一,当前临床上常以尿白蛋白肌酐比值(urinary albumin to creatinine ratio,UACR) 作为临床DKD的早期诊断指标[1]。Sudoscan仪作为一种新型的电导分析仪,不仅可以通过导电性来评估糖尿病周围神经病变[2],还可以评价糖尿病肾脏病变的发生风险[3]。目前国内外研究主要倾向于应用Sudoscan仪来评估糖尿病周围神经病变、糖尿病心血管自主神经病变及代谢综合征等的发病风险。该研究主要探讨Sudoscan仪检测的泌汗功能与 T2DM 患者UACR之间的相关性,旨在为筛查T2DM人群中DKD的发病情况提供新的思路。
1 材料与方法
1.1 病例资料选取2019年5~9月在本院内分泌科住院的300例T2DM患者。根据患者是否伴有泌汗功能异常(采用Sudoscan仪检测)进行分组,双手电导率(hand electrochemical skin conductance,HESC)>60 μs且双脚电导率(foot electrochemical skin conductance,FESC)>70 μs为泌汗功能正常组(NSF组,n=125);HESC≤60 μs或FESC≤70 μs为泌汗功能异常组(ASF组,n=175)。纳入标准:① 符合WHO 1999年糖尿病诊断标准。② 年龄在18岁以上。排除标准:① 糖尿病急性并发症患者;② 心脏起搏器、支架植入患者;③ 合并脊柱外伤及脊柱骨病,曾做过截肢手术的患者;④ 合并痛风、严重心脏、肝脏、肾脏、恶性肿瘤及精神疾病的患者。⑤ 1型糖尿病、尿路感染、月经期及妊娠期女性患者。所有患者均签署知情同意书。
1.2 尿白蛋白/肌酐比值(UACR)及生化指标检测所有患者均由同一操作者按标准流程测量身高、体质量、血压。体质指数(body mass index,BMI)=体质量(kg)/身高 (m2)。留取随机尿,充分混匀后离心,取上清液,免疫比浊法测定尿白蛋白浓度,Benedict-Behre法测定尿肌酐浓度,计算二者比值得到UACR;隔日再按照上述方法重新留取一次尿标本,取两份尿标本UACR的平均值。留取患者空腹静脉血,以葡萄糖氧化酶法检测患者空腹血糖(fasting blood glucose,FBG);以高效液相色谱法检测患者糖基化血红蛋白(glycosylated hemoglobin,HbA1c);应用酶比色法测定患者血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)及血尿酸(uric acid,UA)水平。
1.3 Sudoscan检测Sudoscan检测仪(Impeto Medical,法国)检测双手及双脚的电化学皮肤电导率作为评估泌汗功能的指标。具体方法:嘱患者脱鞋袜后双脚站立于足电极板,双手(注意勿涂抹护手霜,除去戒指等饰品)压在手电极板上,操作者输入患者一般基本信息后,点击SCAN键开始扫描,嘱患者在测试过程中不要移动双手及双脚,3 min后出结果、打印报告。所有患者在Sudoscan检测过程中均无不适症状。
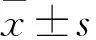
2 结果
2.1 两组一般资料及生化指标比较两组性别、BMI、收缩压、舒张压、HbA1c、FBG及C肽相比较,差异无统计学意义(P>0.05)。与NSF组相比,ASF组年龄、糖尿病病程、UACR、Scr升高,而HESC、FESC降低(P<0.05或P<0.01)。见表1。

表1 两组一般资料及生化指标
2.2 泌汗功能与其他相关指标的Spearman分析分别以HESC、FESC为因变量,以糖尿病病程、UACR、Scr、FBG、HbA1c及C肽等为自变量,行Spearman相关分析,结果显示:HESC、FESC均与糖尿病病程、UACR、Scr呈负相关 (P<0.01,P<0.05)。见表2。
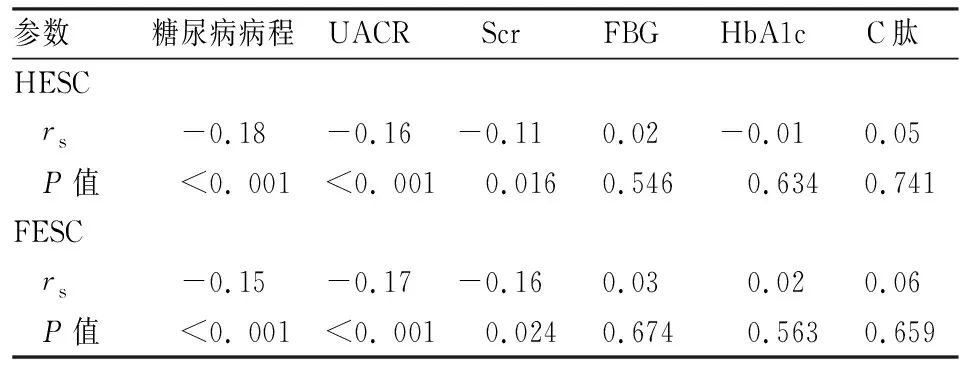
表2 泌汗功能与相关指标的 Spearman相关分析(rs)
2.3 多因素线性回归模型分析与泌汗功能相关的独立因素分别以HESC、FESC为因变量,以年龄、糖尿病病程、UACR、Scr、收缩压、舒张压、FBG、HbA1c及C肽等为自变量,行多因素线性回归模型分析,结果显示:糖尿病病程、UACR是HESC的影响因素,糖尿病病程、UACR、Scr是FESC的影响因素,见表3。

表3 以HESC和FESC为因变量的多元逐步线性回归分析
2.4 HESC和FESC对DKD的筛查价值本研究以UACR作为诊断DKD的标准,以HESC和FESC绘制ROC曲线,见图1,其曲线下面积(area under curve,AUC)分别为58.7%和59.8%,特异度分别为64.3%和70.5%,敏感度分别为57.2%和65.6%,见表4。
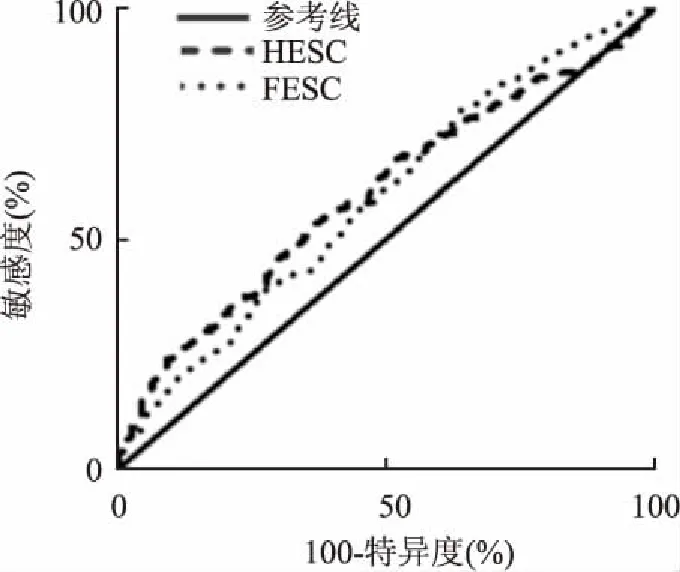
图1 HESC和FESC筛查DKD的ROC曲线

表4 HESC和FESC对DKD的筛查价值
3 讨论
研究[4]表明DM是慢性肾脏疾病和终末期肾病的常见原因。DKD诊断标准主要包括UACR和eGFR水平[5]。随机尿UACR大于30 mg/g即可认为合并肾脏损伤,而UACR处于30~300 mg/g提示为微量白蛋白期,是DKD的早期标志[1]。T2DM患者发病时可能已经存在微量白蛋白尿,因此T2DM患者应当在诊断初期就需要进行DKD的筛查。但临床上DKD患者在病程早期基本无临床症状,并且其UACR检测结果往往为阴性,另外UACR易受到包括尿路感染、血压、运动等诸多因素的干扰,因此UACR在诊断DKD方面可能存在一定的局限性,亟需一种快速、无创、客观、可靠的筛查方法来早期识别DKD。
Sudoscan仪是一种便捷无创的设备,其工作原理为:通过对手足的皮肤施加逐渐递增的直流低电压(<4 V),电流穿过不锈钢传感器,吸引来自手掌和足底汗腺中的氯离子,从而形成氯离子电流;低电压下,皮肤的角质层是绝缘的电容器,因此只有汗腺管有氯离子转运,这确保了检测到的只是汗腺功能;逐渐增加电压,获得相应增加的电流,将检测到的电流与电压差绘制曲线,斜率为电化学皮肤电导率(electrochemical skin conductance,ESC);斜率越大提示神经功能越好。Sudoscan仪器操作方便,受试者只需将手足分别放置至相应电极板上,操作者仅需输入患者的基本信息,其正常参考范围没有年龄、性别及种族差异[6],且重复性好[7]。有多项研究[8-9]证实,Sudoscan仪在检测糖尿病周围神经病变方面的敏感性和特异性均较高;另有研究[2]证实,Sudoscan检测小神经病变诊断性能与皮肤活检相当。基于糖尿病周围神经病变与DKD均为常见的DM相关微血管并发症,黄雪 等[10]研究发现Sudoscan仪可辅助用于T2DM患者DKD的早期风险筛查。
早有研究[11-12]证实,随着糖尿病病程的延长,血管内皮细胞的损伤越来越严重,引起糖尿病周围神经病变的风险也随之显著增加。DKD的发病机制包括氧化应激、炎症反应、肾脏血流动力学变化等[13],DKD与糖尿病周围神经病变均属于糖尿病微血管并发症,两者在发病机制及发生发展上均具有一致性,因此,泌汗功能障碍的患者更容易合并肾脏病变。研究[3]证实,与不合并DKD 的T2DM 患者相比,DKD 患者的HESC和FESC均减低,HESC、FESC与eGFR 降低明显相关。本研究结果显示糖尿病病程、UACR、Scr均是泌汗功能的影响因素,与上述研究结果一致。
多项研究[10,14]均可证实Sudoscan仪评估 T2DM 患者DKD的有效性。Ozaki et al[14]研究发现在中国人群中可应用Sudoscan仪检测DKD,其敏感性94%,特异性78%。黄雪 等[10]研究证实Sudoscan 检测指标与肾功能损伤显著相关,以HESC筛查DKD,其特异度及敏感度均为57.6%;以FESC筛查DKD,其特异度为71.9%,敏感度为35.2%。而本研究分别以HESC和FESC筛查DKD,其特异度分别为64.3%和70.5%,敏感度分别为57.2%和65.6%。推测研究结果的差异可能与病例数、课题设计、入排标准等因素相关。
综上所述,在T2DM患者中,UACR与泌汗功能呈负相关,提示Sudoscan检测的泌汗功能对于筛查T2DM人群DKD的患病个体具有一定的价值。但本研究存在以下不足之处:首先本研究为横断面研究;其次本研究为单中心研究。下一步可能需要开展多中心的前瞻性研究来进一步评估UACR与泌汗功能的相关性。

