P16/Ki-67双染联合DNA倍体分析在ASCUS分流诊断中的应用价值
尹 璐,马成斌,刘 平,张 祎,*,赵学军
(1.上海市长宁区妇幼保健院妇产科,上海200051;2.上海市长宁区妇幼保健院病理科,上海 200051)
在宫颈细胞检查中可经常观察到意义不明的不典型鳞状细胞(atypical squamous cells of undetermined significance,ASCUS),它既可以提示有HPV感染,宫颈上皮内瘤变,甚至是宫颈癌,也可能与炎症、细胞萎缩等有关。目前针对检测到ASCUS的患者,主要管理策略是从中分流出更多宫颈上皮内瘤变2级及以上(CIN2+)病变,从而优化临床医师对患者的分层管理[1]。虽然病理活检是其检测的金标准,但由于炎性改变和宫颈癌均可出现ASCUS检验结果异常,过多的阴道镜活检会加重患者的经济负担、心理负担,故临床对ASCUS处理方法依然存在分歧[2]。99%的宫颈癌标本中存在高危型人乳头瘤状病毒(high-risk humanpapillomavirus,HR-HPV)感染,HR-HPV感染是子宫颈癌及其癌前病变的主要致病因子,目前临床主要采用HR-HPV检测来分流诊断ASCUS。但此法亦存在特异性低、阳性预测值低等问题,因此需要寻找新的辅助检测方法提高ASCUS分流的准确度。近年来,DNA倍体分析逐渐用于宫颈癌早期筛查工作,相对于传统人工阅片具有更高的敏感性和特异性。多项研究发现,宫颈癌的发生、发展及预后情况与肿瘤抑制基因P16和增殖细胞核抗原Ki-67有关[3-4]。若在一细胞中同时检测到P16和Ki-67共表达,则高度提示有高级别病变的存在,是近年来一种较新的宫颈病变检测手段。宫颈癌或癌前病变细胞发生形态学改变通常较晚,在不依赖于细胞形态学基础上,结合DNA倍体分析检测和细胞学P16/Ki-67双染检测,可提高CIN2+及以上病变的检出率,减少阴道镜创伤性检查。本研究通过比较DNA倍体分析检测、细胞学P16/Ki-67双染检测,以宫颈活检病理检测结果为金指标,来评价P16/Ki-67双染联合DNA倍体分析检测在ASCUS分流处理中的价值。
1 材料与方法
1.1 病例和标本
收集2016年12月—2018年8月上海市长宁区妇幼保健院收治的115例诊断为ASCUS的细胞学标本,纳入标准:①均具有明确信息(如年龄、性别、病史等);②经液基细胞学检查(liquid-based cytology test,LCT)确诊为ASCUS,参考《宫颈癌诊断标准》[5];③年龄21岁以上;④宫颈完整,且未接受过宫颈手术或物理治疗;⑤无临床怀孕疑似症状;⑥患者知情并签署知情同意书。排除标准:①患者为孕妇或处于哺乳期;②存在子宫切除术或宫颈手术史;③曾进行过盆腔放射治疗;④同时参加其他临床研究者。115例患者年龄21~70岁,平均(49.0±5.8)岁,本次研究提交上海市长宁区妇幼保健院伦理委员会审核并通过。
1.2 方法
1.2.1 P16/Ki-67双染将收集来的剩余标本在BD SurePath载玻片上制备一张薄片,采用由罗氏公司提供的全自动免疫组化分析仪(型号为CINtec PLUS)进行染色,试剂盒采用罗氏公司的配套试剂,即抗P16(E6H4)/Ki-67(274-11AC3)单克隆抗体鸡尾酒试剂,整个操作严格按照说明书进行。P16定位在胞质或胞核上,显棕色;Ki-67定位在胞核上,显红色,在细胞上同时出现P16和Ki-67显色才为阳性,单独显色或不显色作为阴性[6]。
1.2.2 DNA倍体检测将宫颈脱落细胞样本薄层制片,Feulgen染色后采用全自动DNA定量分析仪(武汉呵尔医疗科技发展有限公司,SPICM-DNA型)进行扫描,保证每张玻片扫描6 000个以上细胞核,系统根据不同细胞核参数进行分类和同价,被检测细胞中出现DNA指数(DNA index,DI)大于2.5的即为DNA倍体异常。
DI=全部细胞DNA的IOD值/正常细胞DNA(G0/G1)IOD均值
式中,IOD值指的是积分光密度值。针对阳性玻片应再次由实验技术员进行逐一核对,避免系统将其他物质或重叠细胞误认为癌细胞。
1.2.3 宫颈阴道镜病理活检所有患者均行阴道镜活检,由妇科医师取组织后实验技术员将其制作成石蜡切片并进行HE染色,分类标准:阴性,慢性宫颈炎、HPV感染等相关病变;CINI,累及鳞状上皮的1/3;CIN2累及鳞状上皮的2/3;CIN3,累及鳞状上皮全层;浸润癌,鳞状细胞癌、腺癌等。根据WHO制定的肿瘤分类标准和宫颈癌诊断标准[5]将组织学结果CIN2级及以上病变作为阳性。
1.3 统计学方法
采用SPSS 22.0统计软件包对数据进行统计分析,符合正态分布计量资料以xˉ±s表示,组间比较采用独立样本t检验;计数资料以百分率表示,组间比较采用四格表法χ2检验。以α=0.05为检验水准。
2 结果
2.1 115例经LCT诊断为ASCUS的患者病理检查结果
本次研究共收集115例患者,均行阴道镜活检,进行病理组织学检查,部分典型结果见图1。各种病理类型的例数和占比见表1,其中CIN2及以上病变45例,阳性率为39.1%,阳性病例中CIN2有20例,CIN3有23例,鳞癌2例。

图1 病理组织学观察结果

表1 病理组织学检查结果
2.2 P16/Ki-67双染检测结果
115例患者采用P16/Ki-67双染检测,典型双染阳性细胞见图2。这115例患者共检出CIN2及以上病变51例(阳性率44.3%),64例P16或Ki-67只在1个细胞显色或不显色。将阴道镜病理检测结果作为金标准,51例病变中35例病理检测为CIN2及以上,见表2。根据表2计算P16/Ki-67双染检测的敏感度、特异度、准确度分别为77.8%、77.1%、77.4%。
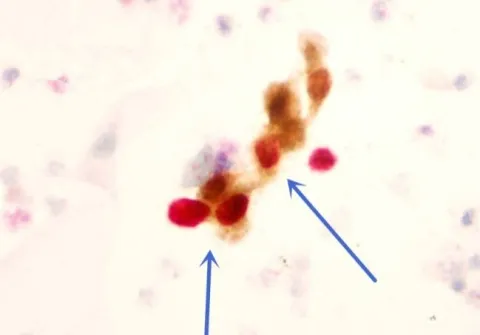
图2 P16/Ki-67双染阳性细胞

表2 P16/Ki-67双染检测结果
2.3 DNA倍体分析检测结果
115例患者采用DNA倍体分析,其中共检出CIN2及以上病变78例(阳性率67.8%),37例为CIN1及以下。将病理检测结果作为金标准,78例病变中32例病理检测为CIN2及以上,见表3。根据表3计算DNA倍体分析检测的敏感度、特异度、准确度分别为71.1%、34.3%、48.7%。此外,DNA倍体分析为阴性的P16/Ki-67双染检测全为阴性。

表3 DNA倍体分析检测结果
2.4 P16/Ki-67双染联合DNA倍体分析对CIN2+的诊断价值
P16/Ki-67双染联合DNA倍体分析对CIN2+病变检测的敏感度、特异度、准确度分别为92.9%、71.4%、86.5%,见表4。根据P16/Ki-67双染和DNA倍体分析以及联合诊断的检测结果,以灵敏度为纵坐标,假阳性率(1-特异度)为横坐标绘制ROC曲线,结果见图3,并计算得P16/Ki-67双染检测的AUC为0.792,DNA倍体分析检测的AUC为0.634,两者联合诊断的AUC为0.856。

表4 P16/Ki-67双染、DNA倍体分析及联合诊断对CIN2+的诊断价值
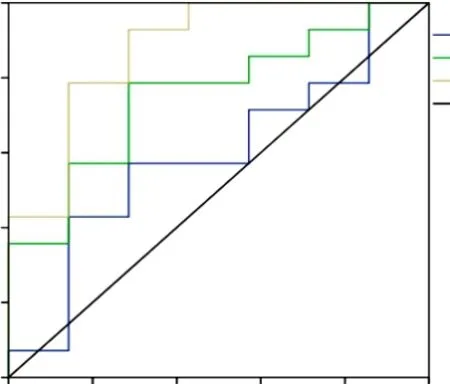
图3 P16/Ki-67双染、DNA倍体分析及联合诊断对CIN2+诊断价值的ROC曲线
3 讨论
目前多项研究表明,有5%~22%的ASCUS患者可进展为CIN2、CIN3或浸润癌。Ebisch等[7]收集了120例ASCUS患者的组织和细胞学样本,发现9.2%样本为CIN2和CIN3。Gage等[8]报道3年内ASCUS发生高级别瘤变及以上的风险为2.6%。张云清等[9]在1 185例行宫颈癌筛查的样本中发现95例ASCUS,病理活检发现CIN2及以上病变占ASCUS的比例为15.28%。本次研究结果显示,115例ASCUS患者经阴道镜病理活检发现45例CIN2及以上病变,占比39.1%,高于相关文献报道,推测可能与选择样本不同有关。本次选择样本为经液基细胞学(liquid-based cytology test,LCT)诊断为ASCUS的患者,且行阴道镜病理活检。而上述文献多是对一定例数的ASCUS及以上级别的患者或严重宫颈糜烂、接触性阴道出血的患者均行阴道镜活检的结果,因此本次研究可表现为标本中CIN2及以上病变的阳性率较高。虽然理论上宫颈细胞学异常患者都应进行阴道镜检查从而识别患者是否存在相关病变,并且是否进行阴道镜检查也会对研究结果产生影响[10],但是,一些不必要的阴道镜检查、病理活检仍会给部分患者带来一定的经济负担和心理负担,尤其是未婚、未育的患者。
P16是一种肿瘤抑癌基因的产物,能对肿瘤细胞的周期调节相关蛋白酶进行抑制,在多数的宫颈癌、鳞癌、腺癌等细胞中呈现高表达,在病变等级较低或正常鳞状细胞中呈弱阳性或阴性[11-12]。P16定位于细胞质和细胞核,在进行染色的判断时,需要参考细胞的形态学特征,因在非肿瘤细胞中也可出现P16的高表达[13]。Ki-67在细胞中高表达表明此时细胞处于增殖的活跃期[14]。相关研究发现,宫颈病变越严重,Ki-67表达量越高,因此Ki-67可作为宫颈病变严重程度的判断指标[15]。采用P16/Ki-67双染能有效降低P16染色误判问题,相关研究报道,P16/Ki-67双染检测宫颈癌病变具有良好的灵敏度和特异度[16]。亦有相关报道指出,P16/Ki-67双染技术的灵敏度与特异性均高于细胞学。Robial等[17]在总结了多篇关于P16/Ki-67双染检测宫颈癌的文章发现,P16/Ki-67双染检测CIN2及以上的灵敏度和特异度分别在60%~90%和50%~80%的范围之间。而本次研究中P16/Ki-67双染检测CIN2及以上的灵敏度和特异度分别为77.8%、77.1%,与相关研究报道相符。
虽然随着液基薄层细胞学检查(thinprep cytologic test,TCT)技术的应用,宫颈癌的发病率及死亡率都明显下降,但TCT在筛查过程中仍然存在敏感性低的问题。因DNA倍体检测全自动化、诊断标准化、客观性,且相较于TCT检测,具有可重复性好、敏感性和特异性高、人为误差低、漏诊率低等优点,故DNA倍体检测在欧美已成为一种常规的临床检测方法。但多项研究亦发现,受标本的取材、染色、细胞数的差异及细胞的重叠等因素的影响,宫颈上皮细胞DNA非整倍体异常不足以对患者病情及预后做出判 断[18-20]。刘峰等[21]采用DNA倍体分析预测CIN2及以上的阳性预测值为33.3%,敏感度为78.4%。而本次研究中DNA倍体分析预测CIN2及以上病变的阳性预测值为41.0%,敏感度为71.1%,与相关报道一致。但检测的特异度和准确度均较低,可能是检测的假阳性结果较多,因此临床诊疗时应配合其他检测方法使用才能得到更好的诊断效果。
而本次研究采用P16/Ki-67双染检测结合DNA倍体分析检测,发现对CIN2及以上病变的灵敏度和特异度均明显高于单独采用DNA倍体分析,同时也略高于单独使用P16/Ki-67双染检测,且DNA倍体分析检测为阴性例数在P16/Ki-67双染检测中也均为阴性。P16/Ki-67双染阳性记数虽独立于细胞形态学,且在重复细胞学制片中存在少数病例中无阳性特征细胞,但笔者仍认为在可重复性的细胞学制片的实验基础上,DNA倍体分析基础上进行P16/Ki-67双染检测能有效减少一过性感染造成的假阳性,从而提高宫颈高级别病变检出率,减少阴道镜转诊和创伤性宫颈活检,尤其在医疗资源缺乏、细胞学医师缺乏的边远地区。
综上所述,P16/Ki-67双染能明显提高CIN2+检出的预测值,DNA倍体分析联合P16/Ki-67双染具有较高的灵敏度和特异度,可辅助用于ASCUS分流诊断,减少阴道镜和活检造成的创伤、减轻患者的心理压力和经济负担,甚至成为辅助宫颈细胞学精准筛查的有效方法之一。

