利用全胚胎和微团培养模型评价硝酸镧的发育毒性
康陈萍,刘青云,肖倩倩,郝卫东*
(北京大学公共卫生学院毒理学系/食品安全毒理学研究与评价北京市重点实验室,北京 100191)
元素周期表第Ⅲ族的15种过渡金属元素被称为镧系元素,分别为镧(La)及镧系物。镧系物由14种元素组成,镧系元素以及与其化学和物理学特性非常相似的第Ⅲ族的过渡金属元素钪(Sc)和钇(Y)共同组成稀土元素。
硝酸镧[lanthanum nitrate,La(NO3)3]是镧系化合物的一种,可用于蓄电池生产、流动催化裂解、废气及废水净化系统等工业生产领域[1],也被用于农用稀土肥料等农业生产领域[2]。茶叶生产常用添加稀土元素的叶面肥产品(催芽剂),即硝酸稀土植物生长调节剂。人为将含稀土元素的叶面肥直接喷洒于茶树的举措是导致茶叶稀土元素高残留(超标)的主要原因[2]。研究表明,我国鄂东南地区砖茶中稀土含量分布为4.09~8.01 mg/kg,其中 5 种轻稀土元素(Sc、Y、La、Ce和Nd)之和占稀土总量的82.6%,其含量已超过《GB 2762-2005食品中污染物限量》中规定的茶叶中稀土(氧化物总量)限量值(2 mg/kg)。
朱为方等[3]根据动物实验并结合人群流行病学调查结果提出稀土的每日允许摄入量(acceptable daily intake,ADI)以氧化物计为4.41 mg/d(以元素计为0.03 mg/kg)。第四次中国总膳食研究[4]结果显示,我国成年男子的16种稀土摄入量平均为250.9 μg/d(相当于4.18 μg/kg),总体范围为27.5~706.2 μg/d,其中镧元素的摄入量平均为 29.1 μg/d(相当于 0.49 μg/kg),总体范围为1.6~112.2 μg/d,未超过目前提出的ADI值。
稀土元素的环境暴露对人体健康具有一定的影响。研究显示,稀土矿区儿童头发内镧元素的含量(0.14~6.93 μg/g)远超文献报道的平均水平(0.04~0.4 μg/g)[5],其血液中稀土总量为2.18 ng/g(相当于2.29 ng/mL),是对照区(1.26 ng/g,相当于1.32 ng/mL)的1.73倍,有显著性差异,且其血液稀土负荷水平与其血压及肺活量呈负相关[6],表明稀土对儿童健康发育可能具有一定影响。
稀土可透过胎盘屏障,导致胎儿或新生儿发育迟缓。Zhang等[7]的研究表明,以0.83 μg/d的剂量给予孕鼠含钇和镱的混合溶液9 d,可在新生小鼠体内检测到的稀土元素为母鼠接触剂量总量的14.1%,提示稀土可快速经胎盘吸收并转运到胚胎。研究显示,非矿区产妇静脉血和脐血中镧的含量分别为0.543和0.541 ng/g(相当于0.570和0.568 ng/mL),二者之间无明显差异,表明镧可能透过胎盘屏障经脐带血进入胎儿体内[8]。Xiao等[9]的研究表明,大鼠孕期经口染毒硝酸镧(2、20、60 mg/kg),母鼠与出生后4 d仔鼠血液中的镧元素含量具有剂量依赖性,且60 mg/kg染毒组出生后61~66 d仔鼠的空间记忆学习能力和血浆神经递质水平均受到明显的影响。
稀土对胚胎早期发育具有一定的毒性效应,可导致胚胎发育缺陷甚至畸形。有研究表明,稀土可导致海胆早期生命阶段胚胎发育缺陷并具有明显的剂量相关趋势[10]。此外,亲代暴露于稀土可导致其精子活性及受精成功率降低、子代发育缺陷率升高[11]。据报道,小鼠孕期经腹腔注射给予氯化镧可导致其受孕成功率及平均胎产仔数显著降低,且其易感期为围着床期(孕期第4~6天)及临产期(孕期第14~16天)[12]。
我国为稀土生产储存大国,但现有稀土元素的发育相关毒理学资料不够完整。本研究参考欧洲替代方法验证中心(European Centre for the Validation of Alternative Methods,ECVAM)的大鼠植入后全胚胎培养(post-implantation whole embryo culture,WEC)[13]和微团培养(micromass test,MM)[14]体外预测模型,评价硝酸镧潜在的胚胎发育毒性。
1 材料与方法
1.1 实验动物及处理
SPF 级 SD 大鼠(雄性 280~300 g,雌性 220~240 g),购自北京市维通利华实验动物技术有限公司(合格证号11804700015381)。动物饲养于屏障环境,室温20~25℃,湿度50%~60%,12 h/12 h明暗周期,自由饮水和摄食。动物适应性饲养5 d后将雌、雄SD大鼠于18:00按2∶1比例合笼,次日7:00进行阴道涂片检查,镜下可见精子视为受孕成功,并记为受孕第0天(GD0)。动物实验方案经北京大学生物医学伦理委员会实验动物福利伦理分会审查批准。
小鼠胚胎成纤维细胞BALB/c 3T3细胞系,由北京大学人类疾病基因研究中心赠送。
1.2 主要试剂与仪器
硝酸镧(纯度大于99.999%)及Ham's F-12培养基购自美国Sigma公司,DMEM高糖培养基购自美国Thermo公司Gibco系列,胎牛血清购自北京全式金生物技术有限公司,胰蛋白酶(1∶250)购自美国BD公司,3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、中性红和阿利新蓝购自美国Amresco公司,5-氟尿嘧啶(5-fluorouracil,5-FU)购自北京索莱宝科技有限公司,盐酸胍购自美国Amresco公司,青链霉素购自美国Thermo公司Gibco系列。
体视显微镜为OLYMPUS公司SZX2-ILLT型,旋转培养箱为Gold-SIM公司Hp11型杂交箱改造,细胞培养箱为Thermo公司3111型,酶标仪为德国Omega公司FLUOstar Omega型,显微镜成像设备为Motic公司2000型。
1.3 全胚胎培养模型
1.3.1 全胚胎培养过程 受孕9.5 d的SD大鼠,乙醚麻醉后处死,无菌条件下取出子宫,以37℃预温的Hank's液清洗2次后转移至新的盛有Hank's液的平皿中,剪开子宫并剥离蜕膜团,转移到盛有Hank's液的平皿中,将胚胎从蜕膜团中剥离,在体视显微镜下剥除Reichert's膜,保留完整脏层卵黄囊,挑选含3~5个初始体节、外形饱满的健康胚胎,随机分组。将37℃预温、含相应浓度受试物的即刻离心血清(100%大鼠血清、56℃灭活30 min、0.22 μm过滤、-20℃保存)加入50 mL培养瓶中,按每个胚胎1 mL血清、每瓶4个胚胎的比例加入相应数量胚胎后于37℃进行旋转培养48 h。分别于开始培养前(O2、CO2、N2的体积分数分别为10%、5%、85%)、培养至第16小时(O2、CO2、N2的体积分数分别为20%、5%、75%)、第26小时(O2、CO2、N2的体积分数分别为40%、5%、55%)进行3次充气,每次充气时间2.5 min。
根据预实验结果,100%胚胎产生发育畸形时的浓度作为最高染毒浓度,对胚胎无明显效应的浓度作为最低浓度,硝酸镧最终染毒浓度为0、0.12、0.23、0.46、1 mmol/L,每组至少7只胚胎。
1.3.2 BALB/c 3T3细胞增殖活性检测 BALB/c 3T3细胞在高糖DMEM完全培养基中传代培养。细胞接种于25 cm2培养瓶,培养于37℃、CO2体积分数为5%、饱和湿度的恒温培养箱,至80%~90%汇合时按1∶4~1∶8比例传代,2~3 d传一代。
取BALB/c 3T3细胞悬液,台盼蓝染色计数后调整细胞浓度为5×103个/mL,混匀后以每孔100 μL的量接种于96孔培养板,培养2 h待细胞贴壁后每孔加入100 μL含2×终浓度受试物的完全培养液,对照组加入100 μL不含受试物的完全培养液,于培养箱中培养3 d。第3天更换培养液。培养第6天,每孔加入20 μL MTT(5 mg/mL),培养2 h后小心弃去各孔液体,将DMSO以每孔150 μL的量加入96孔板中,振荡摇匀10 min后于560 nm检测吸光度值。
将全胚胎培养模型允许的最大浓度作为最高浓度,为防止高浓度间梯度过大,首次稀释采用1.5倍梯度,而后以2倍梯度稀释。硝酸镧终浓度为0、0.03、 0.06、 0.12、 0.23、 0.46、 0.92、 1.85、 2.31 mmol/L,每个浓度设置6个复孔。实验重复3次。
1.3.3 胚胎发育评分及毒性预测 胚胎培养48 h后,选取仍有心跳及血液循环的胚胎,测定其卵黄囊直径(yolk sac diameter,YSD)、顶臀长(crown-rump length,CRL)、头长(head length,HL)等生长指标。根据Brown's评分法,记录其总形态学评分(total morphological score,TMS)、心跳、卵黄囊循环、尿囊循环、体节数(somite)、有无特殊畸形等。绘制剂量反应关系曲线,计算50%胚胎产生畸形时的浓度(IC50,mal)、对胚胎形态学评分(TMS)无影响的最大浓度(ICNOEC,TMS)、达到最大致畸率的最低浓度(ICmax)等数据资料,根据560 nm处吸光度值计算50%的BALB/c 3T3细胞增殖受抑制时的受试物浓度(IC50,3T3)。
利用全胚胎培养预测模型[13]对胚胎发育毒性进行评价。ECVAM的全胚胎培养预测模型分为预测模型1(prediction model 1,PM1)和预测模型2(prediction model 2,PM2),各具有3个判别式(判别式中各参数单位均为μg/mL)。
PM1判别式如下:
判别式 I,18.08×lg(IC50,mal)-11.56×lg(ICNOEC,TMS)-10.19
判别式 II,21.55×lg(IC50,mal)-15.31×lg(ICNOEC,TMS)-10.65
判别式 III,8.70×lg(IC50,mal)-8.53×lg(ICNOEC,TMS)-2.53
PM2判别式如下:
判别式 I,0.21×[(IC50,3T3-ICNOEC,TMS)/IC50,3T3)]×100+15.37×lg(ICmax)-23.58
判别式II,0.27×[(IC50,3T3-ICNOEC,TMS)/IC50,3T3)]×100+17.71×lg(ICmax)-32.37
判别式 III,0.093×[(IC50,3T3-ICNOEC,TMS)/IC50,3T3)]×100+4.21×lg(ICmax)-4.23
若判别式I的值高于判别式II和判别式III,化学物判定为无发育毒性化学物;若判别式II的值高于判别式I和判别式III,化学物判定为弱发育毒性化学物;若判别式III的值高于判别式I和判别式II,化学物判定为强发育毒性化学物。
1.4 微团培养模型
1.4.1 微团培养过程受孕第13天的SD大鼠,乙醚麻醉后处死,无菌条件下分离子宫,PBS清洗两次后转移至盛有37℃预温PBS的平皿中。剪开子宫暴露蜕膜团,并将其转移到盛有新PBS的平皿中,将胚胎从蜕膜团中剥离,剥除Reichert's膜后挑选含40~45个体节的健康胚胎,分别取其肢芽转移至15 mL离心管中。PBS清洗3遍后加入0.25%胰酶-0.53 mmol/L EDTA并置于37℃孵育消化10 min,Ham's F-12培养液终止消化并清洗3次后弃去清洗液,重悬为呈单细胞悬液,200目网筛过滤后台盼蓝计数,细胞存活率须在90%以上。调整细胞浓度为2×107个/mL,于96孔板每孔正中央点种5 μL细胞悬液,培养箱(37℃、CO2体积分数为5%)中孵育2~3 h,细胞贴壁后每孔补足200 μL含相应浓度受试物的培养液,于培养箱中连续培养5 d。
以5-氟尿嘧啶作为阳性对照建立模型,染毒浓度分别为15.62、31.25、62.5、125、250、500和1 000 ng/mL。将微团培养模型允许的最大浓度作为最高浓度,为防止高浓度间梯度过大,首次稀释采用1.5倍梯度,而后以2倍梯度稀释。硝酸镧终浓度为0.03、0.06、0.13、0.25、0.5、1、2及3 mmol/L,每个浓度设置6个复孔。实验平行重复3次。
1.4.2 微团细胞增殖及分化检测细胞培养第5天,去除培养液后加入0.005%的中性红染液200 μL,37℃孵育3 h后弃中性红,生理盐水洗3次后加入200 μL甲醛钙1 min,弃甲醛钙加入200 μL酸性乙醇摇床提取60 min,并于540 nm测定吸光度值以检测其细胞增殖能力。
生理盐水清洗3次去除孔内中性红,加入1%阿利新蓝常温过夜。生理盐水清洗3次后拍照并计数微团数目,6 mol/L盐酸胍振荡提取2 h后于620 nm测定吸光度值,以检测肢芽细胞分化为软骨细胞的能力。
1.4.3 发育毒性预测根据中性红染色测定的吸光度值,计算50%细胞增殖活性被抑制时的浓度(50%inhibition of cell viability and growth,IC50);根据阿利新蓝染色的吸光度值计算50%细胞分化及集落形成受抑制的浓度(50%inhibition of cells differentiation,ID50)。
ECVAM的微团培养发育毒性预测模型[14]包括3个判别式,具体如下(判别公式中各参数单位均为μg/mL):
判别式I,6.65×lg(ID50)-9.49
判别式II,6.16×lg(ID50)-8.29
判别式III,-1.31×lg(ID50)-1.42
若判别式I的值高于判别式II和判别式III,化学物判定为无发育毒性化学物;若判别式II的值高于判别式I和判别式III,化学物判定为弱发育毒性化学物;若判别式III的值高于判别式I和判别式II,化学物判定为强发育毒性化学物。
依据ECVAM关于微团培养的另一模型[15],对发育毒性的特异性进行判别,若IC50和ID50的比值大于2,说明该物质具有特异的潜在致畸性;若比值小于2,说明该物质的发育毒性可能与其细胞毒性有关。
1.5 数据统计和分析
采用SPSS 26.0数据统计处理分析软件对数据进行方差分析。当数据满足正态分布和方差齐性时,采用单因素方差分析(one way ANOVA)并用LSD及Dunnett-t法进行两两比较。当不满足正态分布或方差不齐时,采用Dunnett's C进行多重比较。全胚胎培养模型中的形态学评分和体节数采用Mann-Whitney U检验。采用Linear-by-Linear Association法进行剂量相关趋势性检验。设定统计学检验水准α=0.05。各培养模型中的IC50及ID50用GraphPad Prism 7软件进行拟合计算。
2 结果
2.1 硝酸镧对胚胎生长的影响
0.23 mmol/L及以上浓度硝酸镧染毒组胚胎卵黄囊直径较对照组减小,且呈现出明显的剂量相关趋势,0.46和1 mmol/L组胚胎卵黄囊直径、顶臀长、头长均明显减小(图1)。提示较高浓度硝酸镧可能会导致胚胎生长迟缓。
2.2 硝酸镧对胚胎形态及各器官系统发育的影响
根据Brown's评分法对胚胎进行形态学评分,0、0.12、0.23、0.46、1 mmol/L硝酸镧染毒组的TMS分别为50.80、50.50、49.78、45.67和45.33分。0.46和1 mmol/L硝酸镧可使胚胎体节数减少,总形态学评分降低,且呈现剂量相关趋势(图2)。

图1 硝酸镧对大鼠胚胎生长的影响

图2 硝酸镧对大鼠胚胎形态学(TMS)评分及体节数的影响
体视显微镜下观察各组胚胎发现,对照组胚胎卵黄囊血管丰富、形态清晰,胚胎形态及各器官系统均发育正常,0.12 mmol/L组与对照组无明显差异。随剂量升高,胚胎体积逐渐减小,且0.46 mmol/L硝酸镧染毒可使胚胎产生卵黄囊血管缺陷以及头小且向后弯曲等发育畸形,1 mmol/L硝酸镧染毒使胚胎脐、卵动脉不可见,且产生背中线不规则、体屈不足、尾充血、后肢芽缺失等发育畸形(图3)。提示较高浓度硝酸镧可能导致胚胎发育不良,具有胚胎发育毒性。
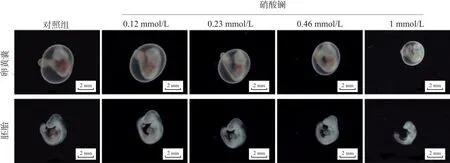
图3 硝酸镧对大鼠胚胎形态发育的影响
如表1所示,0.46 mmol/L以上浓度硝酸镧染毒组的胚胎出现前、后肢芽不可见、体节数减少等畸形,除此之外1 mmol/L硝酸镧染毒组胚胎还出现了卵黄囊血管及尿囊循环发育畸形及体屈异常等,提示较高浓度硝酸镧可能对大鼠胚胎的血管发育、营养输送及骨骼系统发育产生影响。
2.3 全胚胎培养模型对硝酸镧发育毒性的评价

图4 硝酸镧对BALB/c 3T3细胞增殖活性的影响

表1 硝酸镧对大鼠胚胎各器官系统形态学评分的影响
如图4所示,1.85和2.31 mmol/L硝酸镧可显著降低BALB/c 3T3细胞的增殖活性。经GraphPad Prism 7软件进行拟合计算出本模型中硝酸镧的IC50,mal为0.34 mmol/L(110.50 μg/mL), ICNOEC,TMS为 0.12 mmol/L(39.00 μg/mL),ICmax为 1 mmol/L(325.00 μg/mL),IC50,3T3为1.58 mmol/L(513.50 μg/mL)。根据以上评价指标,代入全胚胎培养预测模型PM1和PM2,均显示硝酸镧为弱胚胎发育毒性化学物。
2.4 硝酸镧对肢芽细胞增殖和分化的影响
5-FU对肢芽细胞的增殖和分化均有明显抑制效应(图5、6),经GraphPad Prism 7软件拟合计算出5-FU的ID50为90.85 ng/mL,代入微团培养模型的发育毒性预测判别式得出:5-FU为强发育毒性物质,符合该预测模型的建立标准,证明该模型建立成功。

图6 5-FU对肢芽微团形成的影响
如图7、8所示,2 mmol/L及以上浓度的硝酸镧可引起大鼠微团肢芽细胞增殖能力明显降低,其IC50为1.57 mmol/L(510.25 μg/mL)。0.5 mmol/L 及以上浓度硝酸镧可降低大鼠肢芽细胞分化为软骨细胞的能力,并对微团形成数目产生影响,随硝酸镧剂量升高,单个微团体积逐渐减小,软骨细胞阿利新蓝着色度逐渐降低,至2 mmol/L组已无微团形成,但其对细胞迁移无明显影响。
2.5 微团培养模型对硝酸镧发育毒性的评价
经GraphPad Prism 7软件拟合得出硝酸镧的ID50为0.99 mmol/L(321.75 μg/mL)。代入微团培养模型的发育毒性预测判别式,显示硝酸镧为无胚胎发育毒性化学物。

图7 硝酸镧对肢芽细胞分化的影响

图8 硝酸镧对肢芽微团分化的影响
3 讨论
全胚胎培养和微团培养模型为发育毒性的体外替代方法,具有耗时短、花费少,灵敏度高等特点,更符合动物实验的福利伦理及“3R”原则。全胚胎培养模型通过完整、独立的胚胎培养体系,模拟生物体胚胎发育早期(GD 9.5~11.5)对受试物的暴露过程,通过评价胚胎形态和多器官系统的整体发育,可评估化学物质对器官发生关键时间窗内胚胎发育的影响。微团培养模型通过在体外对胚胎肢芽原代细胞以高密度共培养的方式,模拟体内发育过程,可研究细胞-细胞通讯、细胞分化和细胞与胞外基质的相互作用等[16],通过对肢芽细胞向软骨细胞分化能力的影响的评价,判断受试物在胚胎发育中晚期(GD 13~18)是否具有潜在的发育毒性。本研究利用上述两种方法,评估了硝酸镧对大鼠胚胎的发育毒性。
研究表明,镧可在围着床期(GD 4~6)显著降低小鼠受孕成功率及平均胎产仔数[12],且可导致海胆早期生命阶段胚胎发育缺陷[10]。本研究中,0.46 mmol/L及以上浓度的硝酸镧可对大鼠胚胎YSD、CRL和HL产生明显影响,具有明显的生长迟滞效应,且可诱导胚胎产生发育畸形,尤其是血管发育、营养输送及骨骼系统发育方面效应显著,表明硝酸镧在高剂量下具有一定的胚胎早期发育毒性。
ECVAM在全胚胎模型验证过程中根据胚胎的分化及发育情况建立了预测模型1(PM1),后引入小鼠胚胎成纤维细胞毒性数据建立了预测模型2(PM2),完善了受试物胚胎发育毒性的预测。本研究中,全胚胎培养的两个预测模型均判定硝酸镧为弱胚胎早期发育毒性化学物。
根据硝酸镧对BALB/c 3T3细胞毒性测试的结果,硝酸镧对BALB/c 3T3细胞增殖的未观察到有害效应的最大水平(no observed adverse effect level,NOAEL)为0.92 mmol/L,远高于其对胚胎生长发育的ICNOEC,TMS和 IC50,mal,表明硝酸镧诱导的胚胎生长迟缓和发育畸形并非由其细胞毒性所致。
脏层卵黄囊(visceral yolk sac,VYS)作为啮齿类动物母体与胚胎之间营养物质、废物和气体交换系统,在胚胎生长发育过程中发挥着重要的作用[17]。脏层卵黄囊间质层的卵黄囊血管,为营养物质向胚胎的输送提供直接通道[18],硝酸镧对卵黄囊血管发育的抑制作用可能是导致其诱导胚胎生长迟缓的原因之一,对于其具体的作用机制有待进一步研究。
研究[19]表明稀土氯化钇可致金黄地鼠子代产生外观畸形及骨骼损伤,如骨质溶解、肋骨增生及成骨不良。本研究结果显示,1 mmol/L及以下浓度硝酸镧对肢芽细胞增殖无明显影响,而0.5 mmol/L以上浓度硝酸镧可降低肢芽细胞的分化能力,对微团形成数目及其形态产生影响,且相对而言,肢芽细胞分化较细胞增殖更为敏感,提示较高剂量硝酸镧有可能导致大鼠胚胎肢芽细胞分化为软骨细胞过程受阻。结合全胚胎培养模型中硝酸镧对胚胎肢芽分化的抑制效应,提示高浓度硝酸镧可能对肢芽细胞生长及再聚合具有一定影响,可能对胚胎骨骼系统发育具有一定抑制效应。
本研究中,微团培养预测模型判定硝酸镧为无胚胎中晚期发育毒性化学物。根据ECVAM关于微团培养的另一模型[15]中的提示,若IC50和ID50的比值大于2,说明该物质具有特异的潜在致畸性;若比值小于2,说明该物质的发育毒性可能是由于细胞毒性引起的。硝酸镧IC50和ID50的比值为1.59,其ID50值较高,表明其在较高浓度下对肢芽细胞分化的阻滞效应可能是由细胞毒性引起的,不一定具有实际意义。
据研究,稀土矿区居民血液中镧元素含量平均为1.71 μg/L,最高为 18.23 μg/L[20]。研究表明[21],稀土经血液输送至各器官后在体内呈不均匀分布,具有明显的组织特异性。镧元素主要沉积于肝脏和骨骼(分别占吸收量的50%和25%),远高于其在血液中的浓度[22-23]。波兰的一项研究显示[24],人初乳中镧元素含量平均为7.1 μg/L,最高为51 μg/L,提示镧在母乳中具有较高的蓄积量,可通过母乳喂养的方式进入婴幼儿体内。尽管本研究中镧元素对胚胎生长发育的NOAEL为0.12 mmol/L(16.68 μg/mL),高于矿区居民平均暴露水平,但由于其具有较强的蓄积能力且半衰期较长[25],因此由镧元素蓄积导致的高暴露风险不容忽视。
综上所述,可初步认为硝酸镧对早期胚胎发育有弱的毒性。但由于本实验采取的两种替代方法均为体外试验,不能分析母体代谢、母体-胎儿间相互作用等影响,且ECVAM对发育毒性体外替代方法的验证也认为替代方法在强发育毒性化学物的判断上准确性较好,但不能准确判别弱发育毒性化学物和无发育毒性化学物。硝酸镧的发育毒性还需要更多的实验进一步确认。

