完全性脊髓损伤亚急性期脑运动控制功能变化的功能磁共振研究
刘舒佳 ,张军卫,王方永,唐和虎,白金柱,吕振,李建军
1.首都医科大学康复医学院,北京市 100068;2.中国康复研究中心北京博爱医院脊柱脊髓外科,北京市 100068;3.北京脑重大疾病研究院神经损伤与修复研究所,北京市 100068;4.北京市神经损伤与康复重点实验室,北京市 100068
脊髓损伤后运动功能重建是近年的临床热点[1],其前提是人脑依然保有产生运动指令的能力。电生理学和功能神经影像学研究显示,中枢神经损伤后,人脑能够广泛重组,具有可塑性[2-4],但重组方式却存在争论。功能磁共振成像(functional magnetic resonance imaging,fMRI)因具有较高的时空分辨率,对神经元活动定位较准确,可重复性较好,被广泛应用于脑科学研究[5]。脊髓损伤患者损伤远端肢体感觉和运动功能缺失,意象运动(motor imagery,MI)和试图运动(attempted movement,MA)成为脑功能研究的主要运动任务[6]。
MI 是指想像、模拟特定动作的动态过程,而不伴有任何明显的实际动作[7-8],等同于运动准备和再现[9]。与之对应的是实际运动(executive movement,ME)。MI 和ME 均依赖类似的运动再现,激活共同的脑皮质区域[10-11];在行为学水平,二者保持相同的时间结构并遵循同样的运动规律[12-13]。MA 则是指尽力去做某一动作,不论该动作最终是否能够完成。MA所兴奋的神经网络与健康人实际执行该动作时所兴奋的网络相同。
本研究观察通过不同运动任务下,脊髓损伤患者脑皮质激活区域和强度的变化,揭示脑运动控制功能的可塑性改变。
1 资料与方法
1.1 一般资料
选取2017 年1 月至2019 年1 月北京博爱医院脊柱脊髓外科收治的完全性脊髓损伤患者为患者组,符合美国脊髓损伤协会残损分级(American Spinal Injury Association Impairment Scale,AIS)[14]的诊断标准。
纳入标准:①AIS 分级A 级;②病程3~6 个月,度过脊髓休克期;③足背伸功能缺失(经体格检查、运动诱发电位检查证实)[15];④MI 形象度问卷(Vividness of Motor Imagery Questionnaire,VMIQ)[16]评分<60分。
排除标准:①不能接受MRI 检查;②颅脑外伤、神经疾患,或积极性不高;③并发四肢骨折或其他严重损伤。
共纳入外伤致脊柱骨折/脱位患者11 例,其中男性9例,女性2例;年龄18~48岁,平均32.6岁;滑铁卢利足量表评定为右利足;高中以上文化程度;损伤节 段T74 例,T102 例,T4、T6、T8、T11、L2各1 例;病程3~6个月,平均4.1个月。
在MRI 扫描前1 d 再次查体,确认仍为完全性脊髓损伤,没有恢复。1 例患者在扫描中表现紧张,检查发现心率加快等类幽闭恐惧症;1 例扫描发现颞叶部分缺如,但无任何体征、症状;1 例发现颞极部圆形短T2信号灶,追问病史发现曾应用颅环牵引治疗,推测固定螺栓位置可能有金属残留;1 例扫描后表示不能清楚区分音频指令与扫描过程中的噪音。均予排除,按照纳入标准补足。
对照组共纳入健康志愿者12例,均为本院职工和进修医师。两组性别、年龄和VMIQ 均无显著性差异(P>0.05)。见表1。
所有参与者均签署知情同意书。本研究获中国康复研究中心医学伦理委员会批准(No.2019-113-1)。
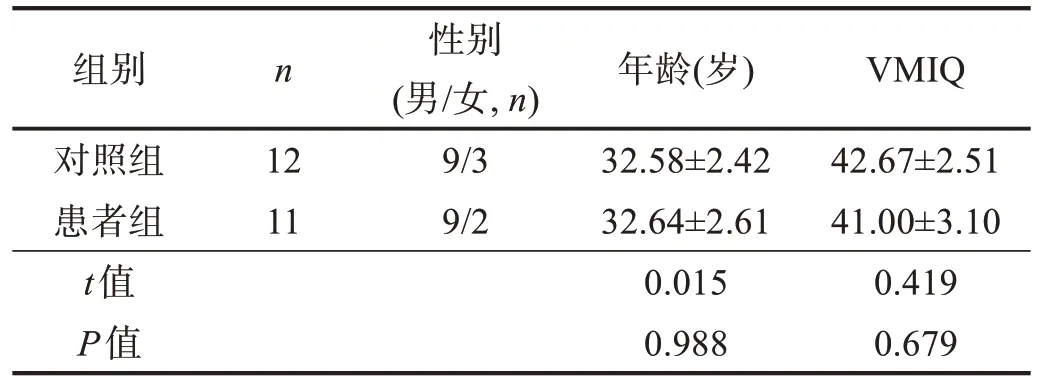
表1 两组一般情况比较
1.2 方法
采用1.5 T Signa Excite 超导磁共振成像系统(美国GE 公司),标准正交头颅线圈。以正中矢状面图像为定位图像,获取横断面T1WI 和T2WI 图像,扫描基线与前-后联合连线平行。T1WI 成像参数:TR/TE 2925 ms/10.4 ms,层厚/间隔5 mm/0 mm,视野24 cm,激励次数4 次。T2WI 采用GE-EPI 序列,TR 3000 ms,TE 40 ms,翻转角90°,激励次数1 次,矩阵64×64,视野24 cm,层厚/间隔5 mm/0 mm。
首先行定位扫描。28层无间隔扫描线的标记要确保顶叶能完全包括在内。然后按照功能相-解剖相-功能相的顺序扫描。每个功能相时长504 s,前24 s为预扫描期,无数据产生。两次功能相扫描间隔以解剖相扫描,避免患者疲劳和重复任务执行带来的兴奋性下降。
采用组块设计(block-design)模式,静息状态与运动任务执行过程交替进行,以静息-想象-静息-运动为1 个循环,共4 个循环。具体的音频组成:静息21 s,指令3 s,MI 21 s,静息21 s,指令3 s,MA/ME 21 s,4 个循环共360 s。指令为“准备想象/运动开始”;最后指令为“停”,1 s,任务结束。
预先录制好的音频文件通过MRI 内部系统播放,辅以内部通话系统指导研究。
受检者每天晨起和睡前各伴随音频指令进行练习2次,约30 min,共6 d,第7天进行扫描。
1.2.1 MA/ME任务
对照组完成ME。闭目平卧,听到指令后将优势足维持于背屈中立位21 s。用力适度,以仅能对抗令足背下垂的重力为准。以长腿石膏模具的前托规范背屈角度。
脊髓损伤患者无法活动足部,完成MA,即尽最大努力去“命令”优势足背伸。
1.2.2 MI任务闭目平卧,听到指令后仅想象MA/ME 任务中描述的内容,而并不实际完成。
1.3 统计学分析
以叠加于T1解剖相上的后验概率图(posterior probability maps,PPMs)显示不同运动任务下,两组脑运动功能网络的激活区域和程度。
采用运行于MATLABR 2007b 平台的SPM5 软件包进行数据后处理。数据依次进行运动校正、功能像与结构像配准、归一化和平滑。运动校正以第一时段成像数据的第一幅扫描图像为基准,对同一受试者两个时段的成像数据进行基于刚体模型的运动校正。空间平滑采用9×9×9 mm 全宽半高高斯核进行[17]。运动校正后,使用SPM5 提供的Bayes 推断进行激活/抑制体素识别,所得PPMs 投射到运动校正后写出的T1解剖相上。
采用SPM5 软件包提供的Bayes 推断法进行组间分析,效应水平阈值采用SPM5 给出的γ 值,概率阈值设为0.95。效应水平阈值γ相当于背景噪音的水平。
2 结果
2.1 MA/ME
对照组ME 激活区仅见于右侧侧初级感觉(primary somatosensory cortex,S1)、顶下小叶(inferior parietal lobule,IPL)、壳核及小脑后叶(图1、图4)。患者组MA 激活区包括双侧S1/初级运动皮层(primary motor cortex,M1)、辅助运动区(supplementary motor area,SMA)、背侧运动前区(premotor dorsal cortex,PMd)、扣带回运动区(cingulate motor area,CMA)、外侧苍白球、小脑,左侧腹侧运动前区(premotor ventral cortex,PMv)、丘脑腹后外侧核、壳核和右侧顶下小叶(图2、图4)。患者组MA 所激活程度高于ME 的区域包括双侧M1/S1、SMA、上顶叶皮质(superior parietal cortex,SP)、CMA、小脑、岛叶、丘脑、壳核,右侧顶下小叶(图3、图4)。
2.2 MI
对照组MI激活区域位于左侧M1,双侧SMA、颞上回,右侧PMd(图5、图8)。患者组MI 激活区域位于双侧SMA、前额叶皮质(prefrontal cortex,PFC)、岛叶,左侧PMv、基底核,右侧PMd、PMv、顶下小叶(图6、图8)。患者组激活程度更高的区域存在于右侧SMA、M1、PMd,左侧SMA、顶下小叶、岛叶、基底核(图7、图8)。
2.3 MI和MA/ME比较
对照组MI 时,左侧PFC,双侧CMA、M1/S1、SMA 较ME时兴奋;ME时没有比MI更多的激活区域(图9)。患者组MA 时,左侧M1,双侧CMA 和SMA,右侧小脑较MI 时兴奋;MI 时没有比MA 更多的激活区域(图10)。
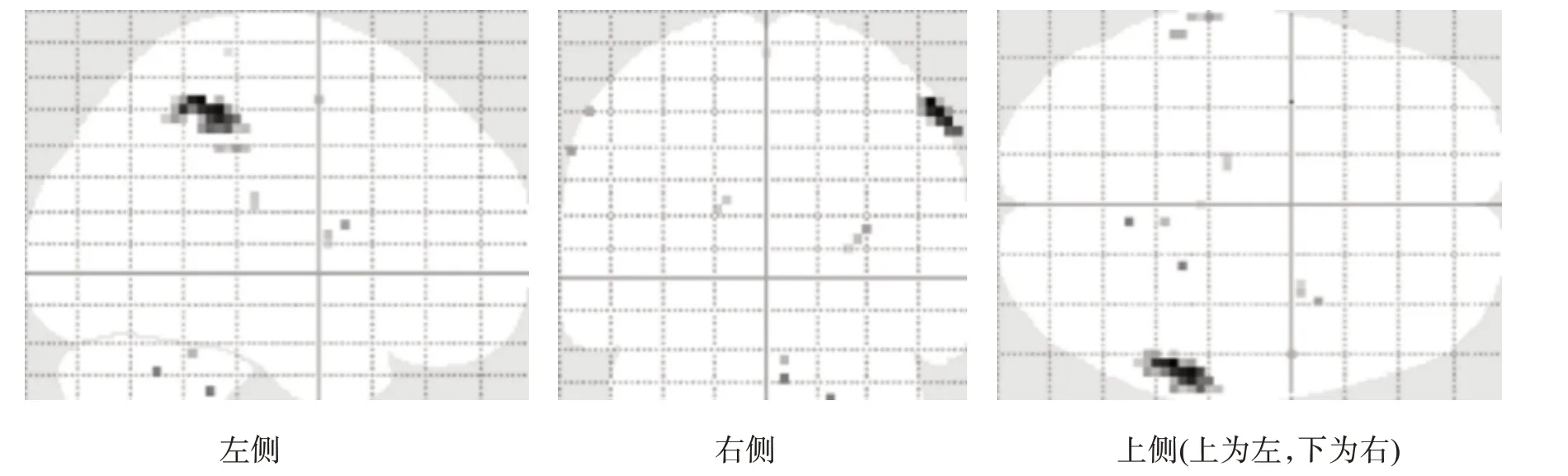
图1 ME时激活脑区简图
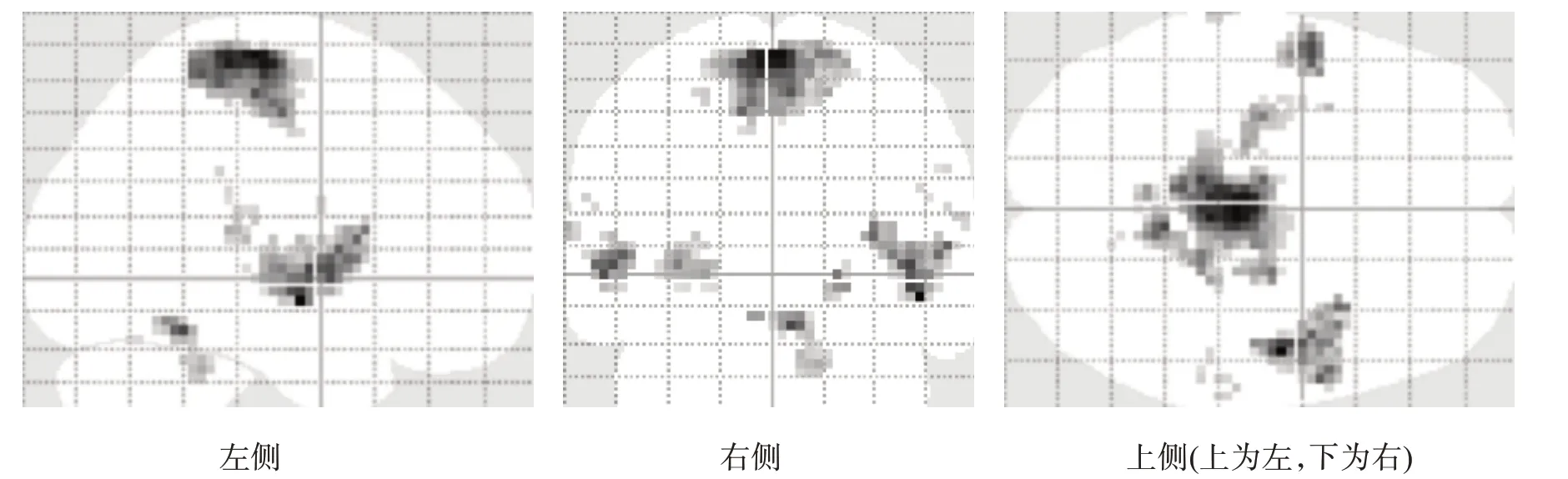
图2 MA时激活脑区简图
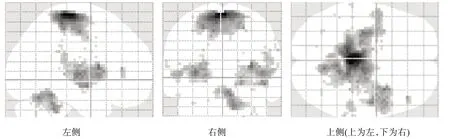
图3 患者组较对照组激活程度更高的脑区
3 讨论
许多重建脊髓损伤后运动功能的治疗方案均假设脑运动控制功能完整。事实上,脊髓损伤后脑皮质结构会发生适应性重塑[18-19],尤其是在接受某些康复训练后[20]。Dias Leao 等[21]的研究发现,仅仅在脊髓休克期后几天内,大脑皮质就发生了重组。
脑运动功能网络分布广泛,大脑、基底节、丘脑、小脑等均有涉及。Oni-Orisan 等[2]对病程2 年以上完全性脊髓损伤患者进行fMRI 扫描,发现感觉运动皮质激活模式已发生重组。本研究显示,脊髓损伤患者M1、SMA 等运动皮质兴奋,表明脑运动控制功能仍保留。但也发现一些脑激活紊乱情况,如顶叶和小脑等感觉运动整合区域的激活增加,苍白球-丘脑-皮质环路募集增多等。顶叶是感觉运动整合的关键结构,在运动技巧的习得和唤醒中扮演重要角色;后顶叶皮质对运动准备和运动编程起一定作用[2,22]。壳核与技巧性行为的长期保持有关。丘脑腹后外侧核接受PFC 和边缘系统的输入并转继至PFC 联合区,在注意、计划、组织、摘要思考、多任务、激活记忆方面发挥重要作用。这些区域的异常激活,反映脊髓损伤患者组织动作计划能力的变化。至于它们究竟是代表兴奋增多还是抑制增多,有待进一步研究。
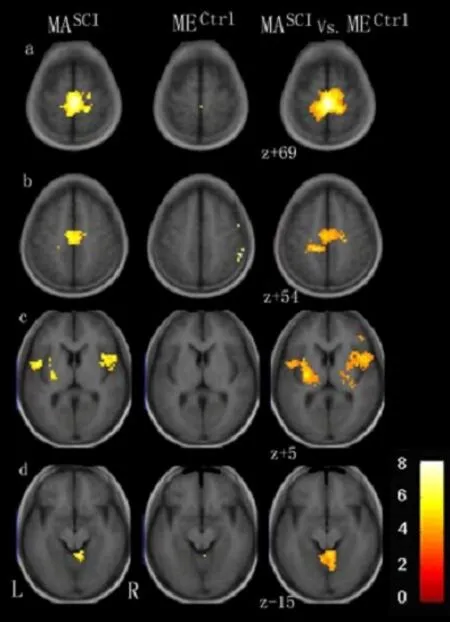
图4 两组MA/ME激活模式比较

图5 对照组MI时激活脑区

图6 患者组MI时激活脑区
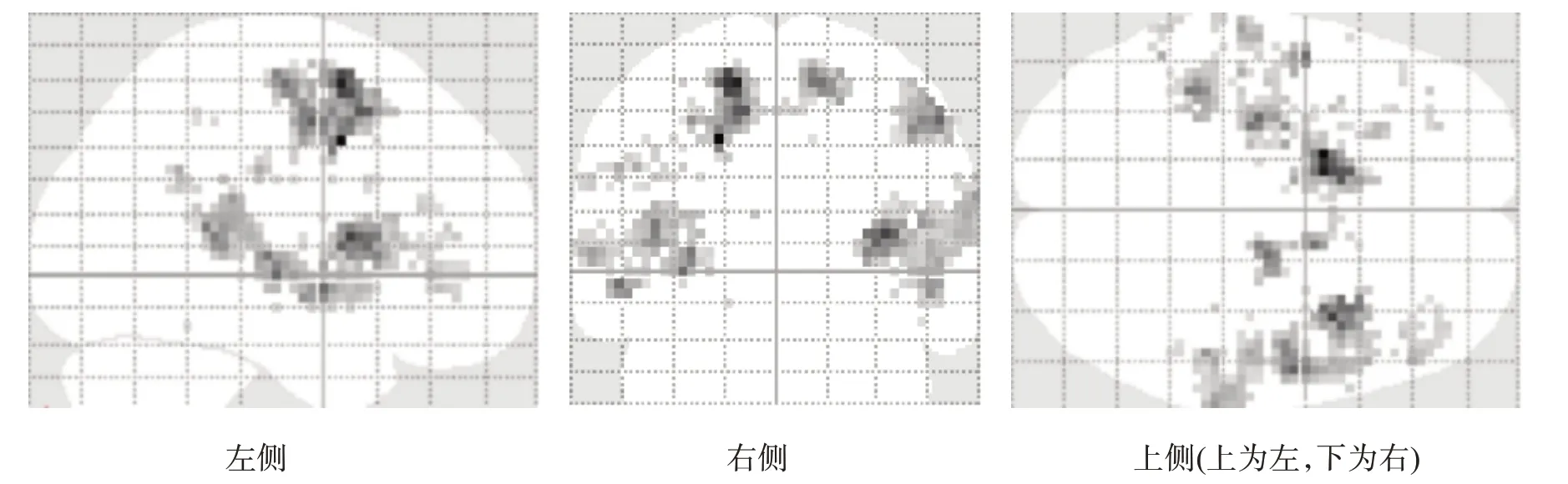
图7 患者MI激活程度较对照组更高的脑区
本研究显示,脊髓损伤患者MA 与健康人ME 相比,激活区域较多,激活程度更高。可能的原因是:①足部适度背屈对于健康人而言非常简单,皮质兴奋很低,而脊髓损伤患者则要“用尽全力”,从而诱发较广范围的脑区激活[23];②由于脊髓损伤患者没有实际的感觉反馈,所以在MA 过程中会持续提高皮质兴奋程度。本研究发现,脊髓损伤患者MA 与健康人ME 时,运动相关皮质的激活情况类似,说明MA 与ME 在相当程度上共享一套神经网络;脊髓损伤后短时期内,患者脑运动控制系统有较多保留。
MI 时,脊髓损伤患者同样激活了更多区域。可能的原因是健康人MI 时,那些直接或间接联系到脊髓的区域被积极抑制,激活较少。Porro等[24]研究这一效应对M1 影响,认为信号强度降低70%。脊髓损伤患者的MI 无需任何动作抑制,没有发现信号减低。所以M1/S1 感觉输入和运动输出的长期缺失所致脑皮质抑制减少,可能是脊髓损伤患者MI 时皮质和及皮质广泛显著激活的原因。由此可见,皮质重组是生理需求、病变程度、病变时程、大脑内部联系以及大脑和外周联系的综合反应,是大脑适应内部和外部环境变化进行调整的结果。
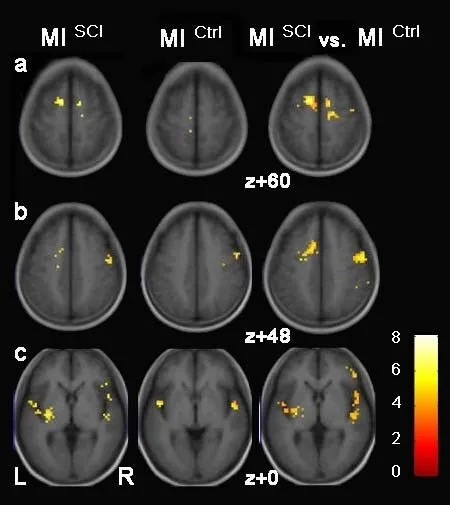
图8 两组MI激活模式比较
综上所述,病程3~6 个月的完全性脊髓损伤患者依然保有区分MA 与MI 的能力,执行运动任务时M1、SMA 的兴奋模式基本正常,表明脑运动控制功能基本保留,运动相关网络较为完整。但脊髓损伤后感觉缺失和运动障碍已经对脑兴奋模式产生一定影响,顶叶和小脑等感觉运动整合区域的激活增加,说明脑功能已经发生了某种适应性重组。
本研究采用的运动任务较为简单,诱发的激活效应较低,有待今后研究改进。
利益冲突声明:所有作者声明不存在利益冲突。
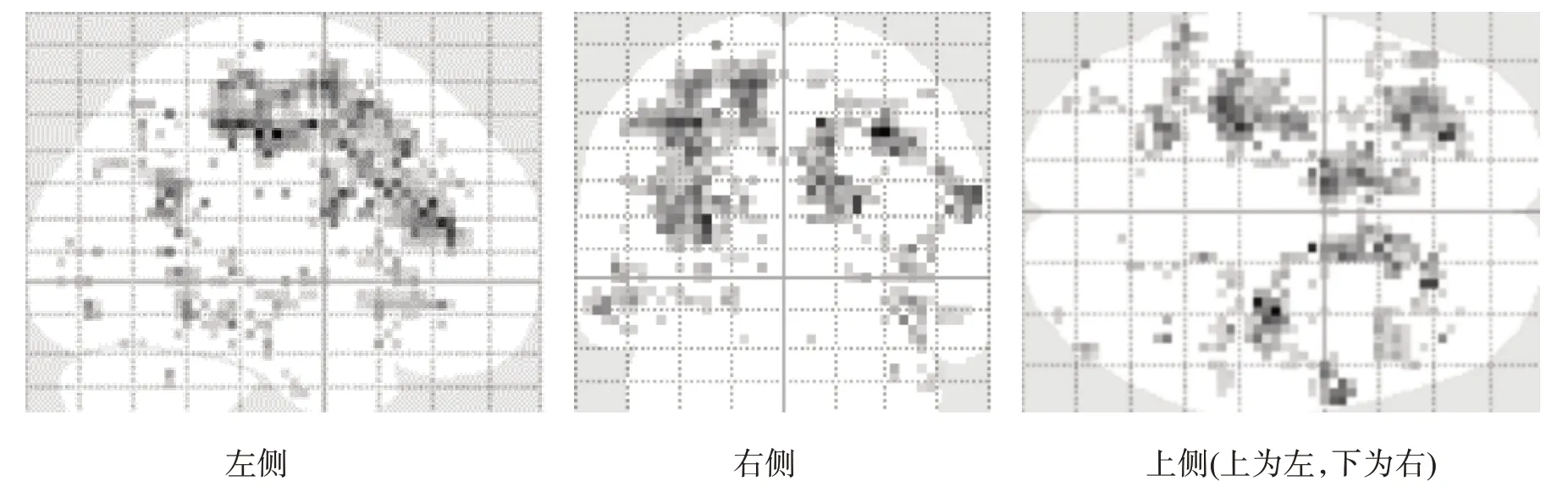
图9 对照组MI较ME激活程度更高的脑区

图10 患者组MA较MI激活程度更高的脑区

