恒温毯保温对重型脑外伤患者血管内低温治疗效果的影响
廖利萍 ,陈鹏,王科,吴晓苏,陈英,张晞,赵洁,王军,曲鑫
1.重庆市急救医疗中心,a.神经外科;b.老年科,重庆市 400014;2.首都医科大学宣武医院神经外科,北京市 100053
重型脑外伤(severe traumatic brain injury,sTBI)后亚低温治疗有降低颅内压、改善神经功能等作用[1-2]。但在血管内低温治疗各阶段,易发生寒战、心律失常等并发症[3]。患者出现寒战直接影响亚低温疗效。目前临床常用的抗寒战措施是使用体表保温和抗寒战药物[4]。本文回顾性分析不同体表保温方法的临床效果。
1 资料与方法
1.1 一般资料
2013 年1 月至2018 年12 月重庆市急救医疗中心共收治sTBI患者387 例,均符合美国重型脑外伤救治指 南(2017) sTBI 诊 断 标 准[5],并 经CT 或MRI 检 查证实[6]。
纳入标准:①年龄18~65 岁;②有明确外伤史,格拉斯哥昏迷量表(Glasgow Coma Scale,GCS)评分3~8 分,伤后昏迷6 h 以上,或伤后24 h 内意识状况恶化,再次昏迷6 h 以上;③伤后12 h 内入院;④患者家属均签署知情同意书。
排除标准:①严重低血压(收缩压≤90 mmHg);②体温≤35 ℃;③有出血倾向;④严重心血管功能障碍;⑤肝肾功能不全;⑥其他脏器损伤或功能障碍。
最终112 例sTBI 患者纳入研究,将采用恒温毯保温的54 例作为观察组,采用普通棉被覆盖保温的58例为对照组。两组一般资料无显著性差异(P>0.05)。见表1。
本研究已通过重庆市急救医疗中心医学伦理委员会的审查,符合医学伦理学要求。
1.2 方法
患者入院后监测生命体征、意识瞳孔变化。需急症手术者行手术治疗;术后及保守治疗者行脑室外引流,采用Codman 颅内压监测系统(美国强生公司)持续颅内压监测。伤后72 h内或颅内压>20 mmHg时予血管内低温治疗。
其他治疗包括脱水降颅压、利尿消肿和促进神经功能恢复等。
血管内低温治疗选择8.5 F 热交换导管(美国ALSIUS 公司),经右股静脉,置于下腔静脉,与Cool-Line 冷凝导管连接;测温尿管探头与温度传感线连接;启动CoolGard 3000 血管内温度控制系统(美国ALSIUS 公司),设置目标温度33~35 ℃,持续4~7 d。然后0.25 ℃/h复温,直至36.5 ℃。
寒战时,口服丁螺环酮30 mg,以后每8 小时予15 mg 维持;静脉滴注哌替啶,首量50~75 mg,25~45 mg/h维持。
血管内低温治疗时,观察组加盖24240 型恒温毯(美国3M公司),对照组加盖普通棉被保温。
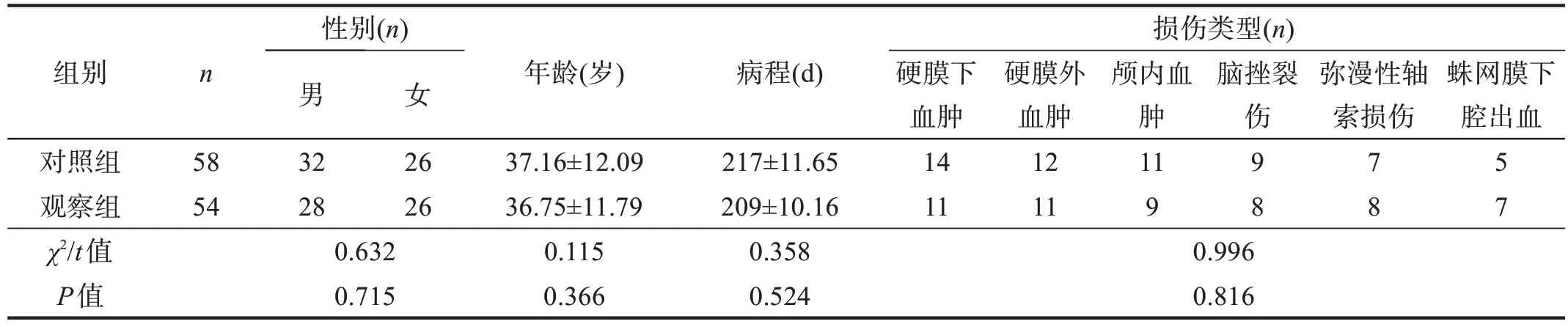
表1 两组一般资料比较
1.3 观察指标
1.3.1 寒战
采用床边寒战评估量表(Bedside Shivering Assessment Scale,BSAS)[7]评估,分为0~3级,级别越高,寒战越严重。
记录患者在低温治疗过程中使用抗寒战药物总剂量。
1.3.2 凝血功能检测
于低温治疗后即刻、6 h、12 h、24 h、36 h、48 h和72 h,采集外周静脉血,检测凝血酶原时间(prothrombin time,PT)、部分凝血活酶时间(activated partial thromboplastin time,APTT)和D-二聚体。
1.3.3 颅内压
记录低温治疗开始后即刻、6 h、12 h、24 h、36 h、48 h和72 h患者颅内压。颅内压6.0~13.5 mmHg为正常,15~20 mmHg 为轻度高颅压,>20~40 mmHg 为中度高颅压,>40 mmHg为重度高颅压[8]。
1.3.4 临床结局
治疗后1 个月、6 个月和12 个月后,采用扩展版格拉斯哥预后量表(Glasgow Outcome Scale Extended,GOSE)进行评估。GOSE <5 分为预后不良,GOSE ≥5分为预后良好[9]。同时计算病死率。
1.4 统计学分析
采用SPSS 21.0 统计软件进行数据分析。计数资料以频数表示,采用χ2检验或Fisher精确概率法检验;计量资料以()表示,组间比较采用独立样本t检验。显著性水平α=0.05。
2 结果
2.1 寒战
观察组寒战发生率(BSAS ≥1 级的人数)和严重程度均明显低于对照组(P<0.01)。见表2。观察组丁螺环酮和哌替啶使用剂量低于对照组(P<0.05)。见表3。
2.2 凝血功能
观察组治疗后6 h,高凝状态明显改善,12 h时凝血功能趋于稳定;对照组治疗后12 h 高凝状态明显改善,24 h时凝血功能趋于稳定。见图1~图3。
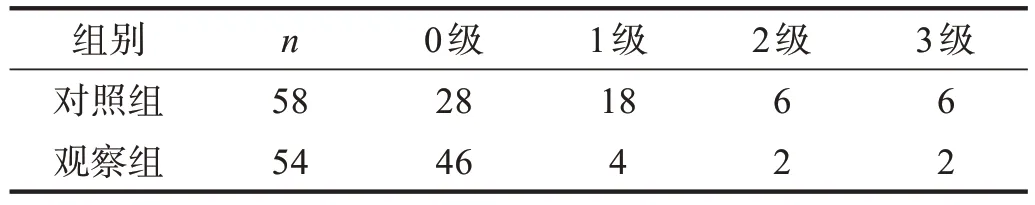
表2 两组BSAS分级比较(n)
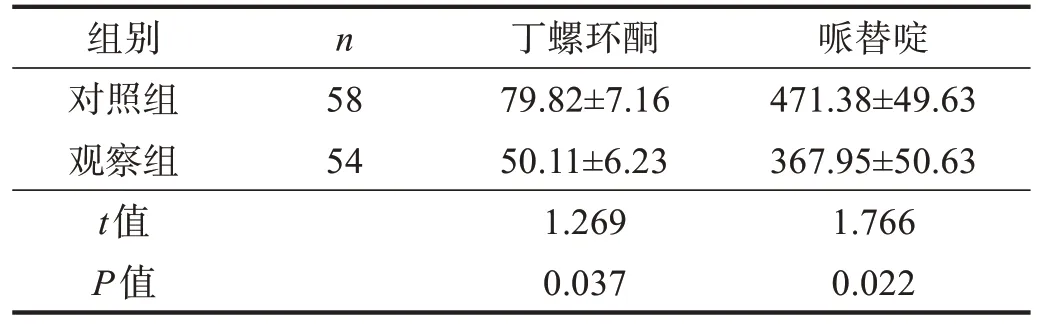
表3 两组抗寒战药物总剂量比较(mg/d)
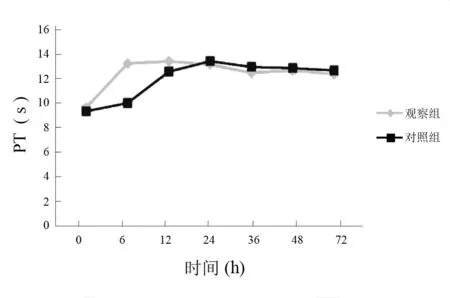
图1 两组低温治疗中PT比较(s)
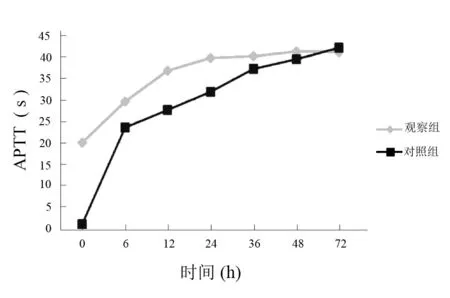
图2 两组低温治疗中APTT比较(s)
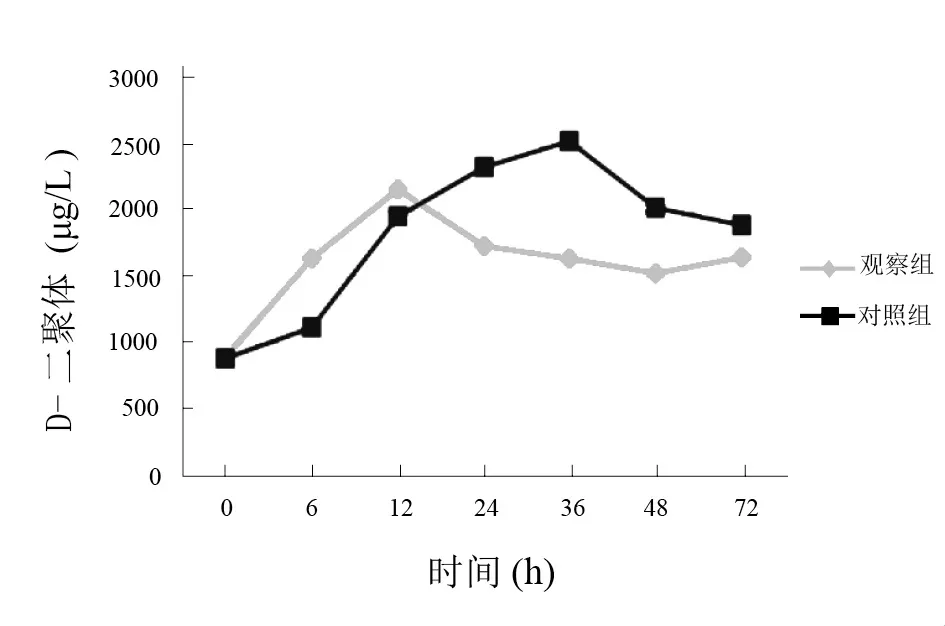
图3 两组低温治疗中D-二聚体比较(μg/L)
2.3 颅内压
低温治疗后,两组颅内压均下降,观察组降低幅度更大。见图4。
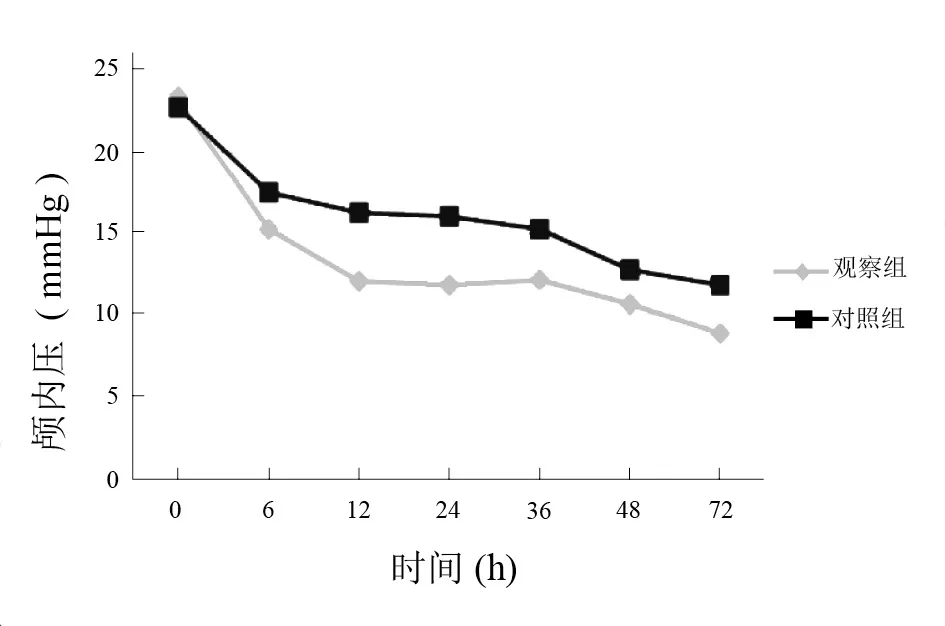
图4 两组低温治疗中颅内压比较(mmHg)
2.4 预后
观察组治疗后1个月、6个月和12个月时,GOSE评分均高于对照组(P<0.05)。见表4。病死率低于对照组(P<0.05)。见表5。
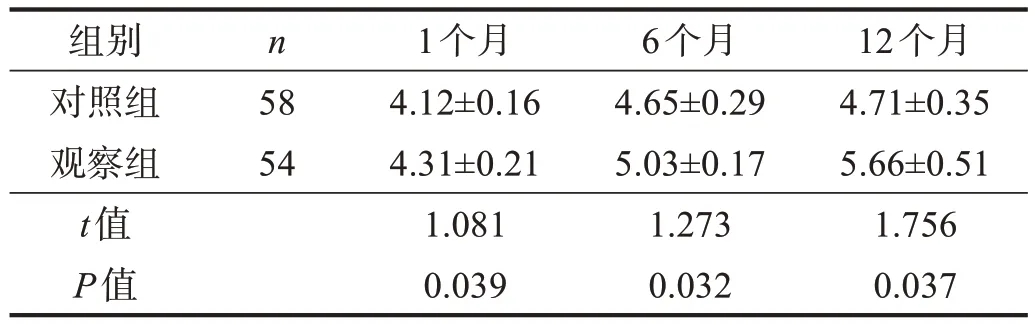
表4 两组治疗后各时间GOSE评分比较
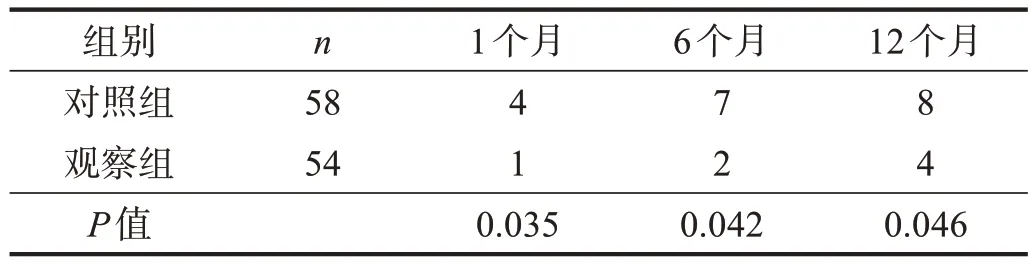
表5 两组治疗后各时间死亡人数比较(n)
3 讨论
国内外sTBI 病例总数呈上升趋势,病死率达42%~45%[10],临床治疗需早期预防和控制脑水肿、高颅压等一系列症状[11]。亚低温治疗有助于减轻脑水肿,保护脑神经[12-13],但往往出现寒战、凝血功能障碍等并发症[14]。寒战的发生率约40%[15],可引起交感神经过度兴奋、脑灌注压降低和颅内压升高等症状[16],增加患者心肌缺血和呼吸窘迫的危险[17]。抗寒战措施在血管内低温治疗中意义重大,甚至决定治疗成败[18]。
目前针对寒战的干预措施主要是使用体表保温和抗寒战药物[19]。体表保温通过提高皮肤温度,减少散热,预防和控制寒战。本研究显示,采用恒温毯进行体表保温,效果优于使用普通棉被保暖。与Cobb等[20]的研究结果一致。降低寒战发生率和严重程度,可提高低温治疗效果和预后[21-22]。药物也是控制寒战的有效手段,但并非所有患者都能通过药物治疗降低寒战阈值[23-24],且药物存在呼吸抑制、胃潴留等副作用。本研究显示,采用恒温毯体表保温可减少抗寒战药物应用。
Johansen 等[25]报道,由于低温治疗改变血凝块强度,可改善脓毒症患者凝血功能。Kounis 等[26]研究显示,亚低温治疗可通过影响代谢产物,使患者凝血功能障碍加重。本研究显示,低温治疗前,脑外伤患者PT、APTT 低于正常,D-二聚体增高明显,提示处于高凝状态[27];使用恒温毯保温,患者凝血功能恢复更快。这可能与恒温毯保温后降温时间更快、达目标温度时间更早有关。sTBI后,脑组织、血脑屏障和血管内皮等组织损伤,局部产生炎症反应,使内源性和外源性凝血系统激活,机体处于纤溶亢进和高凝状态[28],引起凝血功能相关并发症,如迟发性血肿和脑梗死等[29]。早期改善sTBI患者凝血功能障碍,对于改善预后,降低病死率有重要意义。
颅内高压可导致急性脑疝,是脑外伤死亡的最主要原因[30];保持颅内压平稳,有利于病情恢复[31]。本研究显示,低温治疗可有效降低颅内压,与包贇等[32]的结果一致;观察组降低幅度更大。原因可能与对照组达到目标温度时间较晚,在低温维持阶段温度波动有关。低温治疗中,颅内压出现反跳可导致患者预后不良[33]。在低温治疗中使用恒温毯保温,不仅确保降温速度更快,达到目标温度时间更早,而且还能维持目标温度更稳定,确保患者颅内压平稳。研究显示,恒温毯覆盖保温,可降低病死率,改善患者预后。
综上所述,本研究显示,sTBI患者低温治疗期间使用恒温毯保温,能降低寒战发生率,改善凝血功能,降低颅内压和病死率,为安全、方便实施血管内低温治疗提供保障,可在临床推广运用。
由于本研究样本量较小,未来还需要大量研究探讨恒温毯的最佳应用时间和持续时间,以及抗寒战药物可能具有的协同作用。
利益冲突声明:所有作者声明不存在利益冲突。

