自然发酵酸笋中乳酸菌的筛选鉴定及益生特性研究
孙 宁,雷敬玲,吴晓青,黄 丽,李 玲,黄子珍
(1.皇氏集团华南乳品有限公司,广西 南宁 530000;2.广西水牛乳工程技术研究中心,广西 南宁 530000;3.广西壮族自治区水牛乳质量与安全控制技术工程研究中心,广西 南宁 530001;4.中国农业科学院 广西水牛研究所,广西 南宁 530001)
酸笋以竹笋为主要原料,无盐、低盐或高盐,经过漂水排气后密封自然发酵而成,是我国传统特色的发酵蔬菜制品。其风味独特,富含膳食纤维和人体必需氨基酸,具有降血脂、增强免疫力等功效[1]。酸笋发酵过程中,乳酸菌起主导作用,丰富了发酵制品的风味及营养物质,且改善人体肠道不适及增强结肠功能与稳定性,是筛选益生菌的来源。
目前,主要集中于对酸笋产品和发酵过程中微生物菌群的研究,周金沙等[2]应用Illumina MiSeq高通量测序技术并通过生物信息统计与分析发现,广西无盐发酵酸笋样品中优势细菌属为乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)和魏斯氏菌属(Weissella)。夏雪娟等[3-4]采用聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reactiondenaturing gradient gel electrophoresis,PCR-DGGE)技术监控腌制麻竹笋的发酵过程中微生物区系变化,发现发酵7 d后优势菌为食窦魏斯氏菌(Weissella cibaria)和乳酸乳球菌(Lactococcus lactis)。同时,还研究了腌制大叶麻竹笋发酵过程中优势菌乳酸乳球菌含量的变化发现,在腌制0~63 d过程中,乳酸乳球菌(Lactococcus lactis)含量在14 d时达到最大值,与0 d相比增加了6个数量级。郑炯等[5]也采用PCR-DGGE对2种腌制麻竹笋的微生物区系进行研究发现,低盐腌制笋的优势菌多为益生菌,如乳球菌属(Lactococcussp.)和魏斯氏菌属(Weissellasp.),而高盐腌制笋的优势菌多为抗性较强的菌,除了益生菌,还有腐败菌如绿色气球菌(Aerococcus viridans)和芽孢杆菌属(Bacillussp.)。SINGHAL P等[6]从印度东北部地区传统发酵竹笋中分离得到13株菌,其中8株均为乳杆菌属。而对我国传统自然发酵酸笋乳酸菌的研究较少。
本研究拟从广西自然无盐发酵酸笋中筛选益生特性较强的乳酸菌,并对分离菌株进行鉴定及特性研究,为后续开发和应用优良发酵剂提供理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 酸笋样品
自然发酵酸笋:采集于广西南宁市,包括中尧菜市3份(ZR1、ZR2、ZR3)、新村菜市3份(XC1、XC2、XC3),自制2份(Z1、Z2),采用无菌瓶收集,放置于4 ℃冷藏。
1.1.2 化学试剂
2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、1,1-二 苯基-2-三硝基苯肼(1,1-diphenyl-2-picylhydrazyl,free radical,DPPH)(均为分析纯):美国Sigma Aldrich公司;凝胶琼脂(分析纯):上海玉博科技有限公司;DL 2000脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:美国Takaba Clontech公司;Chelex-100纯化DNA提取试剂盒:天根生化科技(北京)有限公司;细菌通用引物27f、1492r:苏州金唯智生物科技有限公司;2×Es TaqMasterMix(含染料):康为世纪生物科技有限公司;氯化钠、碳酸钙、氢氧化钠、浓盐酸、铁氰化钾(均为分析纯):天津市博迪化工有限公司;磷酸氢二钠、磷酸二氢钠、磷酸二氢钾、无水乙醇(均为分析纯):天津市大茂化学试剂厂;三氯乙酸、邻二氮菲(均为分析纯):成都市科龙化工试剂厂;胃蛋白酶(3 000 U/mg)、胰蛋白酶(250 U/mg):江苏绿叶生物科技有限公司;牛胆盐(分析纯):广东环凯微生物科技有限公司;无菌脱纤维羊血:青岛海博生物技术有限公司。
人工胃液[7]:NaCl 0.8 g、KH2PO40.02 g、Na2HPO40.115 g、胃蛋白酶0.35 g、蒸馏水100 mL,用1 mol/L HCl调整pH为2.5,使用0.22 μm滤菌器过滤除菌,备用。
人工肠液[7]:NaCl 0.8 g、KH2PO40.02 g、Na2HPO40.115 g、胰蛋白酶0.1 g、牛胆盐1.8 g、蒸馏水100 mL,使用NaOH调节pH值至8.0,使用0.22 μm 滤菌器过滤除菌,备用。
1.1.3 培养基
MRS肉汤培养基、MRS固体培养基、血琼脂基础培养基:青岛高科园海博生物技术有限公司。
1.2 仪器与设备
Biotek Epoch2微孔板分光光度计:美国伯腾仪器有限公司;SHP-150生化培养箱:上海精宏实验设备有限公司;PB-10 pH计:德国赛多利斯集团;SW-CJ-2F洁净工作台:苏州安泰空气技术有限公司;YM 50立式压力蒸汽灭菌器:上海三申医疗器械有限公司;Biofuge Stratos高速冷冻离心机、LP Vortex Mixer旋涡振荡器:美国赛默飞世尔科技公司;DYY-6D型电泳仪:北京市六一仪器厂;BIO-RAD C1000 Touch cthemal聚合酶链式反应(polymerase chain reaction,PCR)仪:伯乐生命医学产品(上海)有限公司;Ose-470p便携式蓝光凝胶成像系统:天根生化科技(北京)有限公司;ME204E分析天平:梅特勒-托利多仪器(上海)有限公司;C21-SDHCB39电磁炉:浙江苏泊尔股份有限公司。
1.3 方法
1.3.1 乳酸菌的分离纯化
将样品用生理盐水进行梯度稀释,将稀释后的样品分别均匀涂布于含1.6%溴甲酚紫或2%CaCO3的MRS固体培养基上,37 ℃条件下培养24~48 h。挑选溴甲酚紫平板变黄和有溶钙圈的单菌落在平板上划线分离反复纯化。
1.3.2 乳酸菌的鉴定
形态观察:对分离纯化后的菌落进行革兰氏染色和接触酶实验。革兰氏染色阳性、接触酶实验为阴性的菌株可初步判定为乳酸菌。
分子生物学鉴定:采用Chelex-100纯化DNA提取试剂盒[8]提取分离菌株的基因组DNA,以其为模板,采用WALSH P S等[9]的方法对分离菌株的16S rDNA序列进行PCR梯度扩增,PCR扩增引物为细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-GGTTACCTTGTTACGACTT-3')。PCR扩增条件:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸90 s,共30个循环;72 ℃再延伸10 min。PCR扩增产物用1%的琼脂糖凝胶电泳检测,Ose-470p便携式蓝光凝胶成像系统成像,委托上海美吉生物医药技术有限公司广州分公司进行测序。测序结果提交至EzBioCloud数据库[10]及美国国立生物技术信息中心(national center for biotechnology information,NCBI)的Gen-Bank数据中进行在线比对。
1.3.3 具有潜在益生特性乳酸菌的初筛
(1)供试菌液的制备
将待测乳酸菌冻存菌液100 μL接种于6 mL MRS肉汤培养基中,37 ℃静置培养24 h。按2%(V/V)的接种量将种子液接种于MRS肉汤培养基中,37 ℃静置培养24 h,活化至3代,使用磷酸缓冲盐溶液(phosphate buffer saline,PBS)(pH 7.4)调菌体浓度为1.0×108CFU/mL。
(2)溶血性实验[11]
将供试菌液划线于含有5%脱纤维羊血的血琼脂基础培养基中,37 ℃培养24 h,观察平板上菌落生成情况。
(3)耐酸性实验[7]
将供试菌液以2%(V/V)的接种量分别接种于pH值为2.0、2.5、3.0的MRS肉汤培养基中,37 ℃培养24 h,将发酵菌液涂布于MRS固体培养基上,37 ℃培养24 h后观察平板上是否有菌落生成。
(4)胆盐耐受性实验[7]
将供试菌液以2%(V/V)的接种量接种于含有0.3%牛胆盐的MRS肉汤培养基中,同时将供试菌液涂布于含有0.3%牛胆盐的MRS固体培养基上,37 ℃培养24 h,测定其发酵液在波长630 nm处的吸光度值,并观察固体平板上是否有菌落生成。
(5)模拟人工胃液耐受性试验[7]
选取γ型溶血、耐pH 2.0和0.3%胆盐的乳酸菌,取0.5 mL供试菌液与4.5 mL pH 2.5的人工胃液混匀后,置于37 ℃厌氧培养,分别在0 h和3 h取样0.2 mL,以2%(V/V)的接种量涂布于MRS固体培养基上,37 ℃培养24 h后观察平板上是否有菌落生成。
(6)模拟人工肠液耐受性试验[7]
选取γ型溶血、耐pH 2.0和0.3%胆盐的乳酸菌,取0.5 mL供试菌液与4.5 mL模拟人工胃液混匀,置于37 ℃厌氧培养3 h后,从中吸取0.5 mL发酵菌液加入4.5 mL模拟人工肠液混匀,37 ℃厌氧培养,分别取0 h和6 h菌液涂布于MRS固体培养基上,37 ℃培养24 h后观察平板上是否有菌落生成。
1.3.4 乳酸菌的体外抗氧化能力测定
供试菌液在4 ℃条件下经8 000 r/min离心30 min,收集发酵上清液,即为胞外分泌物,用0.45 μm的滤膜过滤,参照文献[12]测定DPPH自由基清除能力;参照文献[13]测定ABTS自由基清除能力;参考文献[14]测定还原力。
1.3.5 统计分析
采用IBMSPSS20.0进行统计学分析,采用Duncan进行单因素方差分析,通过DNA Star软件进行序列整理,每个实验进行3次重复,结果以“平均值±标准差”表示。
2 结果与分析
2.1 乳酸菌的分离纯化
从广西南宁市8种不同来源的自然发酵酸笋中分离得到69株菌,革兰氏染色均为阳性,接触酶反应均为阴性,因此,初步鉴定这69株菌为乳酸菌,其中菌株ZR1-20及ZR3-01的菌落形态及细胞形态见图1。由图1可知,两株菌株的菌落表面微凸、半透明、光滑、圆形、直径为0.5~3.5 mm,菌株ZR1-20细胞呈杆状,菌株ZR3-01细胞呈球状。

图1 部分乳酸菌的菌落形态和细胞形态Fig.1 Colony morphology and cell morphology of some lactic acid bacteria
2.2 乳酸菌的分子生物学鉴定结果
对分离得到的69株疑似乳酸菌进行分子生物学鉴定,部分菌株的16S rDNA PCR扩增产物的琼脂糖凝电泳结果见图2。

图2 部分乳酸菌16S rDNA PCR扩增产物琼脂糖凝胶电泳图Fig.2 Agarose gel electrophoresis of 16S rDNA PCR products of some lactic acid bacteria
由图2可知,均得到约1 500 bp的目标条带,且电泳带光亮明显,证明PCR扩增产物无杂质可进行双向测序。测序结果经在线相似性比对,结果见表1。

表1 乳酸菌16S rDNA序列相似性比对结果Table 1 Comparison results of 16S rDNA sequences similarity of lactic acid bacteria
由表1可知,32株、26株、6株和2株菌株分别与Lactobacillus brevis(ATCC14869)、Lactobacillus alimentarius(DSM20249)、Lactobacillus plantarumsubsp.plantarum(ATCC14917)和Streptococcus lutetiensis(CIP106849)相似性在97.88%~100.00%,分别占分离乳酸菌总数的46.38%、38.68%、8.70%和2.90%。菌株XC3-01、XC3-02和Z1-06分别与Pediococcus pentosaceus(DSM2033)、Lactobacillus pentosus(DSM20314)、Streptococcus anginosussubsp.whileyi(CCUG39159)的相似度均≥99.74。因此,鉴定69株菌株隶属于2个科3个属,包括乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、链球菌属(Streptococcus)。周金沙等[2]研究发现,无盐自然发酵酸笋中的优势菌属为乳杆菌属(Lactobacillus)、乳球菌属(Lacto-coccus)和魏斯氏菌属(Weissella),与本研究结果部分相似。
2.3 溶血实验
溶血是指细菌分泌的溶血素使细胞溶解的现象,与菌株自身致病性相关,是评价益生菌安全性的先决条件[11,15]。在益生菌筛选中,γ-溶血是指菌落周围显示正常血平板颜色,对溶血没有副作用,可作为益生菌候选菌株;α-溶血是指在血平板上菌落周围呈现草绿色,为潜在性致病菌;β-溶血是指菌落周围出现无色透明圈,为强致病性,不宜作为益生菌[16-18]。本研究对69株乳酸菌进行溶血活性检测,在血平板上菌落周围均未出现透明圈和绿色,均为γ-溶血,说明没有引起溶血现象,能用于益生菌研究。
2.4 乳酸菌的耐受性

表2 69株乳酸菌的耐酸性及耐胆盐实验结果Table 2 Results of acid tolerance and bile salt tolerance tests of 69 strains of lactic acid bacteria
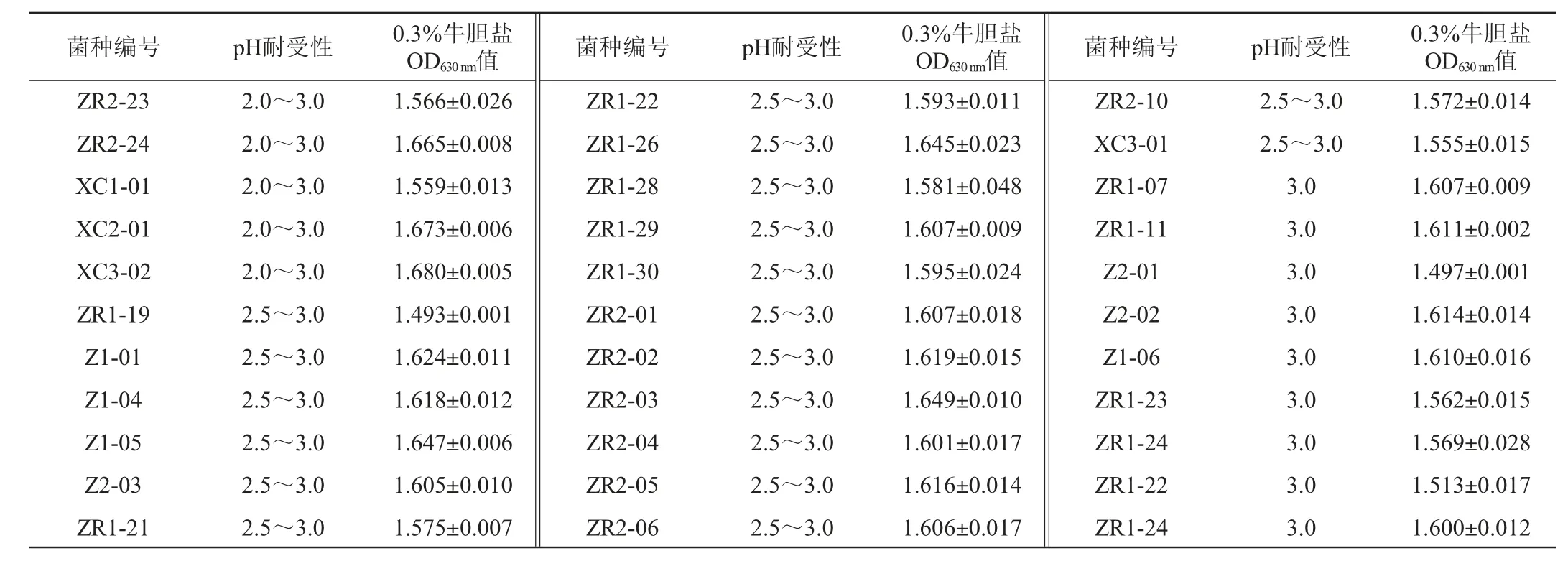
续表
食物在胃中消化1~2 h,在此期间以活菌方式顺利通过人体胃肠道是乳酸菌成为益生菌的前提,胃液中胃蛋白酶能分解菌体细胞,胃酸pH值约为1.5~3.0,一般维持在3.0,此条件下能抑制或杀死细菌,因此,低pH环境下具有耐受性的乳酸菌才能在胃酸中存活,后续到达肠道[19]。由表2可知,能在pH 3.0、pH 2.5和pH 2.0酸性条件下生长的乳酸菌分别有69株、60株和41株,分别占比100%、86.96%和59.42%,说明酸笋中分离的乳酸菌耐酸特性较好。
人体肠液中胰蛋白酶能水解菌体蛋白质;胆汁中胆盐是人体干细胞分泌胆汁酸和牛磺酸或甘氨酸结合得到的钠盐或钾盐,其浓度为0.03%~0.3%,在人体小肠中能够影响菌体细胞膜的通透性,受两者的抑制作用,乳酸菌存活力降低,因此也需对肠液具有一定耐受性,以利于在肠道中定植[20-22]。由表2可知,在0.3%胆盐的条件下,69株乳酸菌的OD630nm值均≥1.488,平板结果显示菌株布满整个培养基,说明在0.3%胆盐的条件下69株乳酸菌生长非常好,均具有较强的耐受性。
从同时属于γ-溶血、耐pH 2.0和耐0.3%胆盐的41株乳酸菌中选取17株进行模拟人工胃肠液耐受性试验。结果表明,17株菌株在MRS平板上均长势良好,说明17株乳酸菌对人工胃肠液耐受性很好,将用于抗氧化能力的研究。
2.5 乳酸菌的体外抗氧化能力
2.5.1 乳酸菌胞外分泌物对DPPH自由基的清除能力
由表3可知,17株菌株都表现出一定的DPPH自由基清除能力,清除能力较强且差异较大,清除率为49.90%~76.47%。其中短乳杆菌Z1-02具有最强的DPPH自由基清除率,为(76.47±1.18)%,显著强于其余乳酸菌(P<0.05)。消化乳杆菌ZR1-05和3株短乳杆菌ZR2-14、ZR2-12、ZR2-22的DPPH自由基清除率均>70%,具有较理想的DPPH自由基清除能力。乳酸菌产生胞外多糖,一部分是附着于菌体表面,另一部分是分泌到菌体细胞外,与其DPPH自由基清除活性相关[23]。本试验17株菌株胞外分必物对DPPH自由基具有较强的DPPH自由基清除能力,说明其均可能会产生胞外多糖。

表3 乳酸菌胞外分泌物对DPPH自由基的清除率Table 3 DPPH free radical scavenging rate of extracellular secretions of lactic acid bacteria
2.5.2 乳酸菌胞外分泌物对ABTS自由基的清除能力

表4 乳酸菌胞外分泌物对ABTS自由基的清除率Table 4 ABTS free radical scavenging rate of extracellular secretions of lactic acid bacteria
由表4可知,17株乳酸菌均对ABTS自由基具有较强的清除能力,稀释10倍后胞外分泌物的ABTS自由基清除率为57.50%~90.37%,与DPPH自由基一样,其中短乳杆菌Z1-02具有最强的ABTS自由基清除率,为(90.37±0.29)%,显著强于其余乳酸菌(P<0.05),另外短乳杆菌ZR2-22、2株消化乳杆菌ZR1-05和ZR1-17的ABTS自由基清除率均>85%,清除自由基效果均较高。
2.5.3 乳酸菌胞外分泌物的还原能力

表5 乳酸菌胞外分泌物的还原能力Table 5 Reducing power of extracellular secretions of lactic acid bacteria
由表5可知,17株乳酸菌胞外分泌物均具有较高的还原能力,菌株胞外分泌物5倍稀释液的A700nm值范围在0.284~0.552,其中菌株Z1-02、ZR1-05、ZR1-02、XC2-01、ZR2-12、ZR2-22表现出较强的还原能力,吸光度值(A700nm值)均>0.480。与DPPH自由基清除率、ABTS自由基清除率一样,短乳杆菌Z1-02还原能力最高。
3 结论
本研究从广西自然发酵酸笋中筛选出69株乳酸菌,经生理生化实验及16S rDNA序列分析鉴定其隶属于2个科3个属,分别为乳杆菌属(Lactobacillus)、片球菌属(Pediococcus)、链球菌属(Streptococcus)。69株乳酸菌均为γ-溶血安全菌株,且均对0.3%胆盐具有良好的耐受性。其中,41株乳酸菌耐pH 2.0酸性条件,且从中优选出的17株乳酸菌对人工胃肠液均有良好的耐受性。17株乳酸菌中4株短乳杆菌(Z1-02、ZR2-14、ZR2-12、ZR2-22)和2株消化乳杆菌(ZR1-02、ZR1-05)对DPPH自由基及ABTS自由基的清除率、还原能力分别>62%、79%、0.393,其中乳杆菌Z1-02的综合抗氧化能力最强。结果表明,这6株乳酸菌具备优良的体外抗氧化活性和益生性能,可用于后续乳酸菌的菌种选育,是研制功能性抗氧化食品发酵剂以及开发新型益生活菌制剂的理想菌株。

