miRNA-95靶向FOXD1基因对结直肠癌LoVo细胞放射敏感性的影响及其机制*
梁宛伶, 肖天保△, 袁 峰, 曹一波, 颜登国
(1. 贵州中医药大学第一附属医院肛肠外科, 贵阳 550001; 2. 四川省自贡市第一人民医院核医学科, 自贡 643000; 3. 贵州医科大学附属医院肛肠外科, 贵阳 550001)
结直肠癌是常见的恶性肿瘤之一,手术切除是结直肠癌的主要治疗方式。为控制癌细胞的转移,提高结直肠癌患者的5年生存率,放化疗成为常见的辅助治疗手段[1]。放射治疗过程中,影响治疗效果的主要原因就是放射敏感性降低,而微小RNA(microRNA,miRNA)对癌症的诊断和治疗存在着巨大的潜在价值,近年来, miRNA 逐渐成为一种新型的非侵入性的疾病早期诊断的标志物[2-3]。肿瘤形成中miRNA-95发挥着不同的功能,miRNA-95在结直肠癌细胞中呈现上升趋势,抑制细胞凋亡,影响肿瘤的放疗敏感性,但在胶质母细胞瘤中却呈现低表达[4]。miRNA-95与肿瘤抗辐射性密切相关,在某些抗辐射的肿瘤细胞中,miRNA-95会出现过表达,过表达miRNA-95会使肺癌细胞、结直肠癌细胞增殖并对辐射治疗产生抗性[5]。提示miRNA-95可能成为肿瘤细胞放射敏感性的参考指标,亦可能是肿瘤治疗的有效新靶点。
叉头框(forkheadbox,FOX)家族的成员FOXD1位于5q12染色体上,具有调控细胞周期。转录增强和抑制转录的作用[6]。目前发现,FOXD1基因存在于真核生物组织和细胞中,在肺癌和结直肠癌中FOXD1表达异常,FOXD1过表达与不良预后相关,且促进癌细胞增殖,是潜在的致癌基因[7]。但在神经胶质瘤细胞中,FOXD1表达升高后细胞的增殖能力和转移能力明显升高,但与临床预后无关。由此本文通过建立转染细胞分组进行X射线照射实验,探讨miRNA-95靶向FOXD1基因对结直肠癌细胞LoVo细胞放射敏感性的有机制研究。
1 材料与方法
1.1 主要试剂和仪器
上海吉玛制药技术有限公司生产的miR-133b模拟物(miRNA-95-mimics)。抑制物(miRNA-95-inhibitions),上海博升生物科技有限公司生产的RPMI-1640培养基,上海抚生实业有限公司生产的CCK-8检测试剂盒。BCA蛋白浓度测定试剂盒,北京中科科尔仪器有限公司生产的Real-time PCR仪,30只BALB/C-nu雄性裸鼠购自广东省医学实验动物中心,8周龄,体质量(20 g±2 g),结直肠癌LoVo细胞购自武汉普诺赛生命科技有限公司。
1.2 裸鼠成瘤实验
相同转染而未经X射线照射的C组、M组、I组LoVo细胞,制成细胞浓度为5×107cells/ml的细胞悬液,各取0.2 ml分别接种于C组、M组、I组BALB/C-nu雄性裸鼠左下肢足部皮上1次,每组10只,注射2周后,待肿瘤生长至100 mm3时,各组选取5只裸鼠进行X射线照射,每天4 Gy 照射一次,连续照射15 d,其余小鼠不照射,15 d后处死裸鼠并取出肿瘤进行称重。
1.3 细胞培养
在RPMI-1640培养基加入含10%胎牛血清,再加入1%氰基链霉素,将LoVo细胞放入培养基中传代培养,培养条件:温度37℃,CO2浓度5%,待细胞生长至80%~90%时,离心传代,收集细胞进行后续实验。
1.4 细胞分组与实验设计
传代培养时,每2周用浓度为2 mg/ml的DDP进行冲洗,然后加入2 ml浓度1×105cells/well对数生长期细胞接种于6孔板中,细胞生长至60%~70%时,按照说明书取50 pmol miRNA-95-mimics、miRNA-95-inhibitions加入无血清稀释液,制成25 μl的RNA稀释液与Lipofectamine2000混合,然后将含有miRNA-95-mimics、miRNA-95-inhibitions以Lipofectamine2000为载体分别在LoVo细胞中转染miRNA-95-mimics。miRNA-95-inhibitions,并分组:C组(对照组正常LoVo细胞),M组(miRNA-95-mimics转染LoVo细胞),I组(miRNA-95-inhibitions转染LoVo细胞),48 h后转染成功,胰蛋白酶消化后收集细胞悬液,于24孔板中接种细胞悬液,室温放置培养24 h,利用直线加速器6 MV/8 Gy的X射线垂直照射细胞,剂量率3 Gy/min,照射12 h后收集细胞。采用RT-PCR法检测LoVo细胞中FOXD1的表达情况,流式细胞术检测LoVo细胞凋亡情况,Western blot检测细胞中FOXD1蛋白的水平,细胞克隆测定细胞存活率,裸鼠成瘤实验检测X射线照射后的裸鼠肿瘤体积。
1.5 细胞克隆测定LoVo细胞存活率
将8 GyX射线照射后的细胞种植到含 10 ml 培养液的培养皿中,37℃环境下培养,孵育 14 d 细胞克隆成功,用 4% 多聚甲醛固定细胞15 min,加入结晶紫染色液,染色时长 20 min,计数细胞克隆数,对各组细胞存活率进行计算。克隆形成率(%) = (形成的细胞克隆数/ 接种细胞数)× 100%。
1.6 RT-PCR法检测照射后LoVo细胞中FOXD1的表达
裂解LoVo细胞提取RNA,根据FOXD1和β-actin基因序列号进行引物。FOXD1产物片287 bp。β-actin产物262 bp,RT-PCR反应体系为10 μl的灭菌ddH2O,上游引物 0.5 μl。下游引物与其相同。通过Trizol提取RNA定量,将RNA逆转录为cDNA,PCR反应条件:97℃6 min,98℃28 s,75℃30 s,80℃4 min,总计55个循环。实验重复3次,用β-actin作参考将PCR产物电泳,用相对定量2-ΔΔCT计算FOXD1水平,引物序列如表1。

Tab. 1 Primer Sequences of PCR
1.7 流式细胞术检测照射后LoVo细胞凋亡情况
三组LoVo细胞以2×110cells/ml浓度置于6孔板,培养24 h,用0.25%胰蛋白酶消化细胞,用冷的70%的乙醇固定,4℃放置一天,后离心5 min倒掉上清液,用PBS洗涤5 min,重复三次。在37℃。无光照下染色30 min,用流式细胞仪分析三组细胞凋亡程度。
1.8 Western blot检测细胞中FOXD1蛋白的水平
取三组LoVo细胞,加入细胞裂解液,提取总蛋白测定浓度,在100 V SDS-PAGE对总蛋白进行电泳,蛋白样品采用Bradford法定量,将电泳产物转至PVDF 膜上,用10%的山羊血清,封闭0.5 h,分别加入一抗4°C孵育过夜,二抗常温孵育1 h,常温环境下洗膜三次,β-Actin 作内参,用Quantity one 4.0软件分析FOXD1蛋白表达。
1.9 统计学处理
2 结果
2.1 各组LoVo细胞中FOXD1的表达情况
RT-PCR法用于检测C组、M组、I组LoVo细胞中FOXD1的表达水平,结果发现C组细胞中FOXD1表达为(3.62±1.02),M组细胞中FOXD1表达为(5.21±1.67),I组细胞中FOXD1表达为(2.34±0.95),下调I组LoVo细胞中miRNA-95表达后,FOXD1表达明显降低,M组LoVo细胞中miRNA-95表达增加,FOXD1表达也明显升高(P<0.05,图1,表2)。

Fig. 1 Expression of FOXD1 in loVo cells of each group
2.2 各组LoVo细胞凋亡变化
流式细胞术检测显示,在同样8 Gy 照射后,I组细胞凋亡率高于C组,而M组细胞凋亡率显著下降, C组LoVo细胞凋亡率(25.03±3.29),M组(16.23±2.96),I组(40.01± 4.32)(P<0.05,图2,表2)。

Fig. 2 Apoptosis of Lovo cells in each group

Tab. 2 Comparison of FOXD1 expression in loVo cells of different n=3)
2.3 各组LoVo细胞中FOXD1蛋白表达
Western blot检测FOXD1蛋白表达,转染miRNA-95-mimics模拟物后M组FOXD1蛋白(5.35±1.74)表达上升,转染miRNA-95-inhibitions抑制物I组FOXD1蛋白表达 (2.45±1.12)降低,M组FOXD1蛋白显著高于C组(3.75± 1.23)(P<0.05),I组FOXD1蛋白显著低于C组(P<0.05,图3)。

Fig. 3 Effect of FOXD1 expression on loVo cells in each group
2.4 细胞克隆测定各组LoVo细胞的存活率
细胞克隆实验检测发现在8 Gy照射后,C组、M组及I组LoVo细胞的存活率分别为(42.36±2.52)%、(50.51± 3.03)%、(30.23±2.03)%,与I组比对,M组和C组LoVo细胞的单克隆存活率有上升趋势(P<0.05,图4)。
2.5 X射线照射对裸鼠结直肠癌移植瘤的影响
无照射结果:与M组相比,C组和I组肿瘤体积减少(P均<0.05,表3),与C组比较,I组肿瘤体积减少(P<0.05)。X射线照射结果:照射15 d后I组裸鼠肿瘤体积显著减小,与M组相比,C组和I组肿瘤体积减少(P均<0.05),三组裸鼠中I组肿瘤体积最小,M组肿瘤体积最大,C组次之,无照射裸鼠肿瘤体积显著大于X射线照射组(P<0.05),表明X射线照射可抑制细胞生长,miRNA-95低表达,结直肠癌种植瘤放射敏感性提高,肿瘤的生长得到明显抑制。
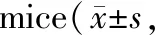
Tab. 3 Tumor volume comparison of colorectal cancer in nude n=5)
3 讨论
近十年来,结直肠癌严重威胁着人类的身体健康,我国结直肠癌发病率约占全球的24%,死亡率约占22%[8]。目前,临床治疗手段有限,放化疗效和手术预后较差,如果通过合理的综合治疗,肠癌的五年生存期可达到80%以上。大量文献报道,FOXD1在多种肿瘤的发生发展过程中起关键作用,参与癌细胞的增殖和分化[9]。有研究证实,miRNA-95过表达会使乳腺癌细胞、直肠癌细胞增殖并对辐射治疗产生抗性,提示miRNA-95可能成为肿瘤细胞放射敏感性的参考指标[10]。我们利用流式细胞术检测miRNA-95的表达对LoVo细胞凋亡的影响,发现同样在8 Gy照射后,miRNA-95抑制物组细胞凋亡率高于对照组,而miRNA-95模拟物组细胞凋亡率显著下降,证实miRNA-95表达与结直肠癌的发生密切相关。2009年Arndt等[11]发现在早期(Ⅰ期。Ⅱ期)结直肠癌组织中的miRNA-95表达呈上升趋势且高于正常组织。更进一步研究结直肠癌发生中的miRNA-95的作用,2011年Huang等[12]发现有机体内和体外miRNA-95都出现过表达,对结直肠癌细胞凋亡产生抑制作用,使患者放疗敏感性大大降低。
近年来的研宄提示FOXD1也参与了癌症的发生和发展过程,本研究利用Western blot和RT-PCR法检测不同表达水平的miRNA-95对FOXD1表达的影响,结果发现下调LoVo细胞中miRNA-95表达后,FOXD1表达明显降低,上调LoVo细胞中miRNA-95表达,FOXD1表达也明显升高,转染miRNA-95模拟物后FOXD1蛋白表达上升,miRNA-95抑制物则降低FOXD1蛋白的表达,提示了解结直肠癌患者miRNA-95表达水平可以预测其接受放疗效果。有研究发现在miRNA-95在胰腺癌组织及子宫内膜癌中表达异常,下调miRNA-95表达能有效抑制胰腺癌及子宫内膜癌细胞的侵袭、迁移,其表达与癌症的发生、临床分期及淋巴结转移等密切相关[13]。FOXD1 基因存在于真核生物组织和细胞中,FOXD1激活主要受到多种因素调节,其中主要的激活方式是被磷酸化,磷酸化FOXD1从细胞核转移至细胞浆中发挥作用,在各种细胞、组织、器官中表现活跃,FOXD1活性的变化会影响细胞的稳定性,当FOXD1活化可以稳定细胞,促进细胞增殖[14]。研究发现FOXD1是直肠癌潜在的致癌基因,在直肠癌组织呈上升趋势,敲低 FOXD1 的表达可抑制直肠癌细胞的增殖活性[15]。大量文献报道,结直肠癌LoVo细胞的凋亡会受到FOXD1过表达的影响,还会对化疗药物的产生耐药性。靶向基因调控FOXD1的表达影响放射的敏感性,监测FOXD1表达是分子作用机制和生物学功能的重点[16-17]。
8 Gy照射后,miRNA-95抑制物组单克隆群数最少,肿瘤体积最小,显著低于对照组和miRNA-95模拟物组。miRNA-95模拟物组单克隆群数及肿瘤体积均高于对照组。抑制miRNA-95的表达后FOXD1降低,提高了LoVo细胞的放射敏感性,LoVo细胞裸鼠移植瘤的生长受到抑制,提高患者肿瘤放疗效果,miRNA与肿瘤放疗敏感性相关,miRNA-95能够影响多种癌症放射抵抗性,并在癌细胞系中高表达。有研究发现miRNA-95在放疗敏感的宫颈癌肿瘤组织和辐照敏感的宫颈癌细胞中均呈低表达,而抑制miRNA-95 表达水平能够显著提高宫颈癌细胞的辐射敏感性[18]。相关研究证实,结直肠癌细胞中FOXD1表达会随着放射剂量的升高而增长,具有一定依赖性,当FOXD1降低后,直肠癌细胞的放射敏感性随之提高,癌细胞出现大量死亡[19],FOXD1基因与直肠癌放疗敏感或抵抗密切相关,FOXD1基因高表达与放疗抵抗有关,降低FOXD1基因表达,放射可抑制癌细胞发展[20]。
综上所述,miRNA-95低表达可抑制FOXD1蛋白的活性,提高LoVo细胞的放射敏感性,促进细胞凋亡,提高肿瘤放疗效果。

