α-荼异硫氰酸酯诱导小鼠胆汁淤积性肝纤维化及其炎症通路*
罗怡爽, 郑秀婷, 章浩月, 徐丽萍, 裘加鹏, 徐港铭, 刘爱明
(宁波大学医学院, 浙江 宁波 315211)
肝纤维化的特征是由于慢性肝病导致肝组织反复受损从而引起细胞外基质蛋白的大量沉积[1]。酒精滥用、肝炎病毒感染、遗传异常、脂肪性肝炎、自身免疫和其他慢性肝病都能引起肝纤维化。肝纤维化不能得到及时治疗,容易发展成为肝硬化、肝衰竭、肝癌等恶性疾病[2, 3]。有文献报道,在美国每年有30 000人的死因是肝纤维化,并且在肝癌患者中,80%~90%患有肝纤维化[4]。
胆汁淤积性肝病是胆汁代谢稳态失衡,导致肝内胆汁酸水平升高,反流入血,并引起的一系列器质性损害,常导致肝硬化和肝功能衰竭[5]。原发性硬化性胆管炎(primary sclerosing cholangitis,PSC)和原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是两种典型的胆汁淤积性肝病[6]。中国南方的PBC患病率为492例/百万,英国北部的PBC患病率为200~251例/百万[7, 8]。此外,患有非酒精性脂肪性肝病的患者也会发生胆汁淤积,亚洲国家的发病率超过40%[9]。胆汁淤积性肝纤维化是肝纤维化中的一类疾病,胆汁淤积发生导致肝细胞受损后,相邻的成体肝细胞能够再生并代替凋亡和坏死细胞[10]。而受损肝细胞再生失败时将被细胞外基质蛋白代替,并伴随炎症的发生。细胞外基质组分从胶原蛋白IV,VI和糖蛋白,蛋白多糖转变为胶原蛋白I,III和纤连蛋白[11, 12]。
胆汁淤积性肝病的发病后果严重,慢性胆汁淤积性肝病模型涉及较少,而且炎症机制尚不明确。本次实验中,小鼠由0.05%-荼异硫氰酸酯(α-naphthylisothiocyanate,ANIT)饮食诱导产生慢性胆汁淤积,研究胆汁淤积性肝纤维化发生发展及所涉及的炎症通路,为研究胆汁淤积性肝纤维化发生机制和寻找药物治疗靶点提供实验依据。
1 材料与方法
1.1 实验动物
15只体重为(23±2)g的6~8周龄SPF级129/Sv雄性小鼠,购自南京模式动物中心。实验前,在宁波大学医学院动物中心适应性饲养7 d。外部环境保持在(23±1)°C的温度,50%~60%的湿度和12 h的正常光暗循环。动物研究方案及操作流程经宁波大学动物实验伦理委员会批准。
1.2 试剂
ANIT(Sigma,美国);玉米油(上海阿拉丁试剂公司);Trizol(Omega,美国);RT 试剂和Q-PCR 试剂(北京康为世纪生物科技公司);谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、碱性磷酸酶(alkaline phosphatase, ALP)、总胆汁酸(total bile acid,TBA,宁波瑞源生物科技有限公司);天狼星红染液(上海源叶生物科技有限公司);Collagen I 抗体 (SAB,美国);α-SMA,t-JNK,p-JNK,t-c-Jun,p-c-Jun,t-STAT3,p-STAT3,t-p65,p-p65和GAPDH抗体(Abcam,美国);RIPA和PMSF(北京索莱宝科技有限公司);BCA蛋白测定试剂盒(上海碧云天生物技术公司);实验所需超纯水用Millipore Elix新鲜制备(Millipore,美国)。
1.3 动物分组与实验干预
取15只成年雄性小鼠随机分为对照组(n=5)和实验组(n=10)。对照组常规饲料喂养(Ctrl),实验组给予0.05% ANIT(每日剂量估计为75 mg/kg)饲料食饲,实验期间采取尾静脉取血检测其生化指标。实验组在干预14 d时处死其中第一批小鼠5只,取其血清、肝脏、胆囊标本,实验结果标记为-荼异硫氰酸酯-14 d组(ANIT-Day14; A-D14);实验组剩余5只小鼠继续ANIT饲料喂养至第28日结束,处死小鼠并收集血清、肝脏、胆囊等样本,实验结果标记为-荼异硫氰酸酯-28 d组(ANIT-Day28; A-D28)。
1.4 标本采集与保存
各组小鼠处死时均称量体重,小鼠麻醉后进行眼球取血用于生化分析。脱颈处死后取新鲜肝脏和胆囊称重,并切取最大肝叶用磷酸盐缓冲液洗涤,然后固定在10%中性福尔马林溶液中。将剩余的肝组织立即在干冰中冷冻,并置于-80°C冰箱长期保存,用于Q-PCR和蛋白质分析。
1.5 血清生化指标检测
使用酶标仪通过速率法测定血清总胆汁酸(total bile acid,TBA)、碱性磷酸酶(alkaline phosphatase, ALP)、谷草转氨酶(aspartate aminotransferase,AST)和谷丙转氨酶(alanine aminotransferase,ALT),操作过程依据试剂盒中的描述进行。
1.6 肝脏组织病理学分析
肝脏组织在10%福尔马林溶液中固定24 h后切取2 mm组织块,对其进行梯度脱水、浸蜡、透明和包埋;包埋完全的石蜡块4 μm厚度连续切片,并进行天狼星红-苏木素染色(Sirius Red-Hematoxylin Staining)后中性树胶封片;最后使用显微镜(Olympus BX43)观察肝脏形态变化。
1.7 肝脏炎症及纤维化因子的转录分析
称取(20±2) mg冻存肝脏组织,在500 μl TRIzol中完全裂解,匀浆、离心、沉淀、洗涤和溶解后测量RNA的浓度。用逆转录试剂盒进行逆转录,方法如文献所述[13]。 用含有1 μl cDNA,2.2 μl UltraSYBR混合物,0.1 μl引物和1.6 μl双蒸水的5 μl体系在384孔板上进行定量聚合酶链反应(Q-PCR)扩增(表1)。

Tab. 1 The primers used for the Q-PCR assessment in this study
1.8 蛋白印迹分析
另取冻存肝脏组织(20±2) mg,在含有1%PMSF的RIPA中完全裂解,然后充分匀浆。4℃、 13 000 r/min离心20 min后收集上清液。蛋白质定量后,将等体积的5× SDS-PAGE上样缓冲液与蛋白质混合后煮沸8 min。上样、电泳、转膜,随后使用5%脱脂奶粉封闭3.5 h。将经TBST清洗后的膜与一抗在4~8℃冷房过夜,第2日取出用TBST洗涤,在室温下二抗孵育2 h。TBST再次洗涤后将ECL化学发光液对膜进行处理,并通过化学成像发光系统曝光,记录图像。
1.9 统计学处理
2 结果
2.1 ANIT对小鼠胆汁淤积和肝功能的影响
ANIT饲料喂养14 d和28 d小鼠胆囊相对重量明显增加,与Ctrl组有明显的差异(P<0.05,表2),而肝脏相对重量增长无明显差异。实验过程中给予ANIT饲料喂养的小鼠,TBA、ALP、AST、ALT水平始终高于Ctrl组。胆汁淤积性指标TBA在14、21、28 d分别升高8.9、4.7、7.2倍,ALP相应升高4.4、 3.7、5.4倍。指示肝损伤的指标AST与ALT则在14和28 d分别升高9.2、3.9倍和8.1、6.4倍(P< 0.05,表3)。这些结果表明小鼠胆汁淤积严重,并且有肝损伤发生。

Tab. 2 Gallbladder change of cholestasis after induction of cholestasis by ANIT (%, n=5)
Tab. 3 Serum biochemical analysis of cholestasis after ANIT treatment n=5)
2.2 肝纤维化基因表达及关键蛋白的变化
在纤维化因子基质金属蛋白酶2(matrix metalloproteinases 2,MMP-2)、金属蛋白酶组织抑制因子1(tissue inhibitors of metalloproteinases 1,TIMP-1)、结缔组织生长因子(connective tissue growth factor,CTGF)、单核细胞趋化因子(monocyte chemoattractant protein 1,MCP-1)、I型胶原蛋白(collagen protein I,CollagenI)、α-平滑肌肌动蛋白(alpha-smooth muscle actin,α-SMA)的转录分析中,给予ANIT 14 d后A-D14组中MMP-2明显高于对照组,但在A-D28组中约下降至A-D14的50%。TIMP-1和MCP-1升高幅度较大,实验组14 d时分别升高28和46倍,28 d时基因表达继续大幅上调。CollagenI在实验组中的表达量的变化与MMP-2类似,A-D14组呈明显上调改变,A-D28组又有所降低。CTGF始终保持在高于对照组2~3倍左右的范围(P<0.05,表4)。
蛋白印记实验的结果及条带灰度分析结果显示,与Ctrl组相比较,经过ANIT喂养的小鼠中Collagen I和α-SMA两种蛋白在14 d就已被显著激活。28 d的灰度图显示A-D28组中Collagen I蛋白表达量稍有上升,而α-SMA则有所降低,但与对照组的差异仍具有统计学意义(P<0.05,图1)。
Tab. 4 Gene expression levels of liver fibrosis n=5)
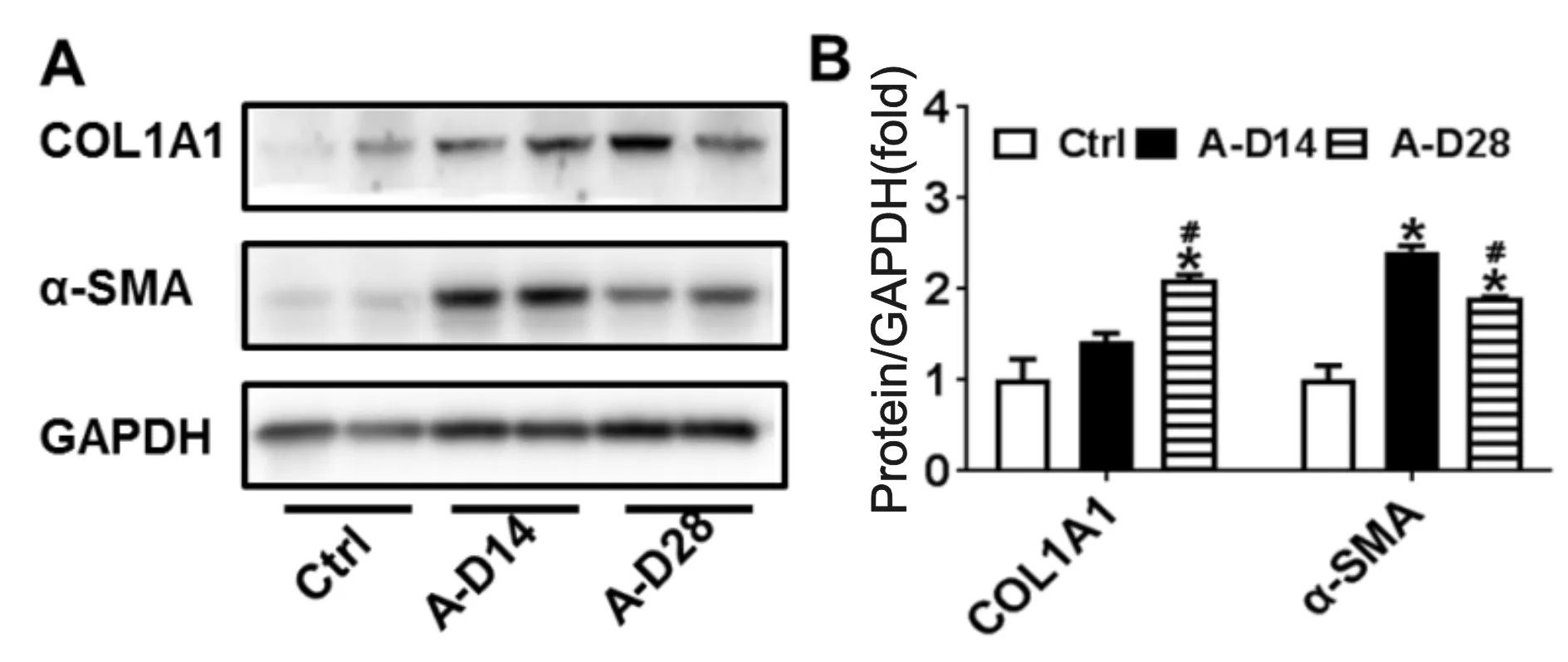
Fig. 1 Analysis of the degree of liver fibrosis n=5)
2.3 肝脏组织病理学改变
肝组织镜下观察,Ctrl组小鼠肝组织病理表现正常,未有坏死灶,且未产生纤维化。A-D14组小鼠肝组织胶原纤维大量沉积,肝脏坏死区域增多。A-D28组肝组织坏死灶的数量相对有所减少,但肝纤维化沉积程度呈现上升趋势(图2)。
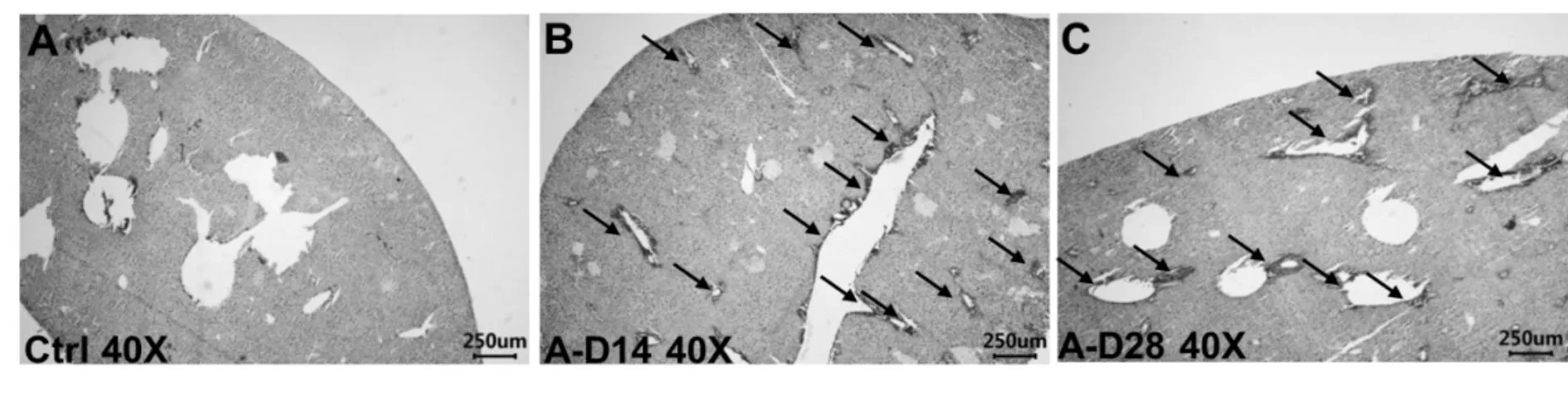
Fig. 2 Pathological evolution of liver fibrosis (Sirius Red - Hematoxylin Staining ×40)
2.4 炎症因子的表达及炎症通路的激活
在肝脏组织中,炎症因子白细胞介素1β、10、6(Interleukin-1β、10、6;IL-1β、10、6)mRNA水平在ANIT干预组A-D14和A-D28组中显著上升。A-D14与对照组相比IL-1β、10、6表达量明显升高约3.5倍左右。ANIT继续作用14 d后,A-D28组IL-1β、IL-10、IL-6表达量仍旧持续上升,并且IL-1β和IL-10要高于A-D14组(P<0.05,表5)。与Ctrl组相比,A-D14组和A-D28组的JNK、STAT3、c-Jun表达量在ANIT干预组中有显著上调。而无论是t-p65还是p-p65蛋白表达在ANIT干预条件下都没有上调,p-p65甚至稍有下调(图3)。上述结果表明胆汁淤积性肝纤维化产生过程中伴随炎症的发生,JNK通路被激活,NF-κB通路在胆汁淤积性肝纤维化发生发展中未发挥作用。
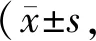
Tab. 5 The mRNA expression changes of related inflammatory factors n=5)
3 讨论
胆汁淤积可以通过ANIT、胆管结扎和四氯化碳等方式诱导。大鼠胆汁淤积性肝纤维化模型中,胆管结扎造模4周时见大量胶原组织沉积,ALT从(45.85±4.18)上升至(87.71±7.92),AST从(42.86±13.18)上升至(78.71±7.87),纤维组织增生明显[14, 15]。四氯化碳造模8周时,ALT从(39.0±7.52)上升至(3473.4±1669.29),AST从(125.8±8.79)上升至(4222.8±1034.24),胶原蛋白含量上升,胶原纤维沉积[16, 17]。上述两种方法建立的肝纤维化模型具有简便易行、病变典型的特点。但胆管结扎通过手术易造成器官机械性损伤,而且其胆汁淤积为肝外胆汁淤积;四氯化碳则存在较高的死亡率,剂量过高可能会提前发展为肝硬化,且该模型本质上是化学性肝损伤模型,而非单纯的胆汁淤积性肝纤维。
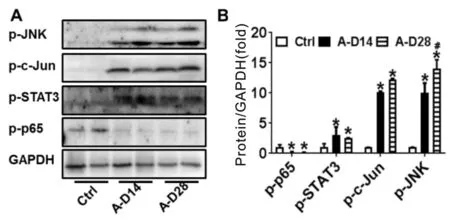
Fig. 3 Western blot analysis of inflammatory pathway n=5)
ANIT诱导的胆汁淤积在病理和生理反应中最接近人类肝内胆汁淤积,ANIT(50、75 mg/kg)常用来构建24、48 h的急性胆汁淤积模型[18-20]。但啮齿类动物的修复能力极强,单剂量造模很难形成慢性肝纤维化模型。而临床中真实常见是慢性胆汁淤积性肝病诱发的肝纤维化,因此研究慢性胆汁淤积性肝纤维化更具临床指导意义。本实验通过含 0.05% ANIT的饲料喂饲小鼠,建立慢性胆汁淤积性肝纤维化模型。在干预第2周,TBA、ALP、AST、ALT均显著升高,虽没有四氯化碳改变的程度剧烈,但仅仅造模2周时间,胆汁淤积、肝纤维化标志物水平明显上调,病理清楚显示有大量胶原沉积,表明在小鼠此时成功被诱导产生胆汁淤积性肝纤维化。
与对照组比较,本实验中纤维化因子MMP-2和CollagenI基因表达在A-D28干预组中虽仍呈现上调改变,但与A-D14组相比却有降低,存在统计学上的差异。而α-SMA的mRNA表达各组之间没有明显变化,但是其蛋白表达在实验组中有显著上调,也呈现在A-D28组比A-D14 组表达量稍低的改变。这种现象的发生可能在由于纤维化发展过程中小鼠自身修复有关。有实验发现姜黄素调节血红素加氧酶-1的活性改善胆管结扎造成的肝纤维化,吡非尼酮促进胶原降解而减少细胞外基质的合成、降低α-SMA基因表达从而对于四氯化碳引起的肝纤维化有一定的治疗作用[21, 22]。JNK信号转导通路是丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路中的一条,它在细胞周期、生殖、凋亡和细胞应激等多种生理和病理过程中起重要作用,在受到刺激后使相应基因表达发生改变。而本研究结果显示,胆汁淤积性肝纤维化过程中的相关炎症基因以及蛋白表达与JNK通路有关,因此在肝纤维化的发展进程中抑制该通路预期可以减轻纤维化程度,减缓肝纤维化发展进程。
综上所述,本研究结果表明喂饲含0.05%ANIT的饲料2周即可建立小鼠胆汁淤积性肝纤维化模型,JNK信号通路持续和稳定激活对肝纤维化的发生发展产生重要贡献,可能成为胆汁淤积性肝纤维化的治疗靶点。

