结肠癌组织中Musashi1蛋白和微小RNA-132的表达情况及与患者临床特征的关系
戴刚,朱荣华,龚庆豪,蔡一亭
上海交通大学医学院附属新华医院崇明分院胃肠外科,上海202150
结肠癌的发生发展严重影响患者的生活质量,同时增加患者的远期预后恶化风险及病死率[1‐2]。近年来结肠癌的发病率呈上升趋势,且在具有肠道息肉家族史的人群中,其发病率较高。临床上越来越多的研究关注分子改变对结肠癌的影响。研究表明,RNA结合蛋白Musashi 1能够通过影响转录RNA的功能状态,促进结肠癌细胞中结构蛋白的活性发生改变,进而导致结肠癌细胞异常分裂[3]。微小RNA‐132(microRNA‐132,miRNA‐132)可通过参与结肠癌细胞核DNA转录活性增强,影响结肠癌细胞DNA的合成速度,干预结肠癌细胞的复制及扩增[4]。本研究选择80例结肠癌组织标本和80例癌旁组织标本,分析两种组织中Musashi 1蛋白和miRNA‐132的表达情况及与患者临床特征的关系,旨在为临床中结肠癌的诊疗提供理论参考,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年5月至2018年7月于上海交通大学医学院附属新华医院崇明分院接受治疗的结肠癌患者。纳入标准:①符合《中国早期结直肠癌筛查及内镜诊治指南》[5]中结肠癌的诊断标准,且经病理学检查证实为结肠癌;②年龄<79岁;③接受手术治疗且获得结肠癌组织标本及其癌旁组织标本。排除标准:①合并其他部位恶性肿瘤;②合并免疫系统疾病;③具有放化疗史;④术后复发性结肠癌。根据纳入和排除标准,本研究共纳入80例结肠癌患者。患者的年龄为35~78岁,平均(53.0±12.4)岁;男47例,女33例;TNM分期:I期24例,Ⅱ期30例,Ⅲ期20例,Ⅳ期6例;组织分化程度:低分化27例,中分化20例,高分化33例;淋巴结转移29例,无淋巴结转移51例;浸润深度:侵及浆膜33例,未侵及浆膜47例。收集结肠癌患者的结肠癌组织标本80例及其癌旁组织标本80例。
1.2 实时荧光定量聚合酶链反应检测miRNA-132的相对表达量
采用组织研磨的方法提取组织中的RNA,在无酶的操作条件下加入焦炭酸二乙酯,测量RNA浓度后,逆转录合成cDNA,然后进行基因扩增。采用primer 5软件设计的miRNA‐132引物,采用甘油醛‐3‐磷酸脱氢酶(glyceraldehyde‐3‐phosphate de‐hydrogenase,GAPDH)作为内参。miRNA‐132上游引物为 5'‐CAAGGACCAACTACAACC‐3',下游引物为 5'‐TGCCTCTTCTTTAATTG‐3';GAPDH上游引物为 5'‐CGGAGTCAACGGATTTGGTCGTAT‐3',下游引物为5'‐AGCCTTCTCCATGGTGGT‐GAAGAC‐3'。聚合酶链反应(polymerase chain re‐action,PCR)条件:92 ℃ 30 s,52 ℃ 30 s,72 ℃ 60 s,共45个循环。采用2-△△Ct法计算miRNA‐132的相对表达量。实验重复3次,取平均值。
1.3 免疫组织化学染色检测Musashi 1蛋白表达
将石蜡切片采用二甲苯脱腊至水,应用5% H2O2常温孵育10 min,磷酸盐缓冲液冲洗5 min,蒸馏水冲洗3次,每次5 min。应用5%的山羊血清抗体封闭10 min,不冲洗,滴加一抗(1∶500),4 ℃冰箱孵育过夜,蒸馏水冲洗3次,每次5 min;滴加生物素标记的二抗(1∶1000),37 ℃孵育30 min,蒸馏水冲洗3次,每次5 min;滴加第二代辣根过氧化物酶标记的链霉卵白素工作液,37℃孵育10 min,蒸馏水冲洗3次,每次5 min;显色之后采用乙醇脱水、二甲苯透明、树胶封片,镜下观察。
1.4 免疫组织化学染色结果判定
Musashi 1蛋白主要定位于细胞质中,可见黄色、棕黄色、褐色颗粒。依据染色强度评分:无色为0分,淡黄色为1分,棕黄色为2分,褐色或黑色为3分;依据阳性细胞所占比例评分:≤10%为1分,11%~50%为2分,51%~75%为3分,>75%为4分。染色强度评分与阳性细胞所占比例评分相乘,<3分为阴性(-),3~5分为弱阳性(+),6~9分为中等阳性(++);>9分为强阳性(+++)。
1.5 统计学方法
采用SPSS 18.0软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,组间比较采用配对t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验。以P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌组织及癌旁组织中Musashi 1蛋白阳性表达率的比较
结肠癌组织中Musashi 1蛋白的阳性表达率为68.75%(55/80),明显高于癌旁组织的28.75%(23/80),差异有统计学意义(χ2=25.616,P<0.01)。(表 1)

表1 结肠癌组织及癌旁组织中Musashi 1蛋白的表达情况
2.2 结肠癌组织及癌旁组织中miRNA-132相对表达量的比较
结肠癌组织中miRNA‐132的相对表达量为(0.448±0.104),明显低于癌旁组织的(2.167±0.551),差异有统计学意义(t=18.063,P<0.01)。
2.3 不同临床特征结肠癌患者结肠癌组织中Musashi 1蛋白表达情况的比较
TNM分期为Ⅲ~Ⅳ期、有淋巴结转移、侵及浆膜的结肠癌患者结肠癌组织中Musashi 1蛋白的阳性表达率分别高于TNM分期为I~Ⅱ期、无淋巴结转移、未侵及浆膜的结肠癌患者,差异均有统计学意义(P<0.05)。不同组织分化程度的结肠癌患者结肠癌组织中Musashi 1蛋白的阳性表达率比较,差异无统计学意义(P>0.05)。(表2)
2.4 不同临床特征结肠癌患者结肠癌组织中miRNA-132相对表达量的比较
TNM分期为I~Ⅱ期、高+中分化的结肠癌患者结肠癌组织中miRNA‐132的相对表达量分别明显高于TNM分期为Ⅲ~Ⅳ期、低分化的结肠癌患者,差异均有统计学意义(P<0.01)。不同淋巴结转移情况和浸润深度的结肠癌患者结肠癌组织中miRNA‐132的相对表达量比较,差异均无统计学意义(P>0.05)。(表3)
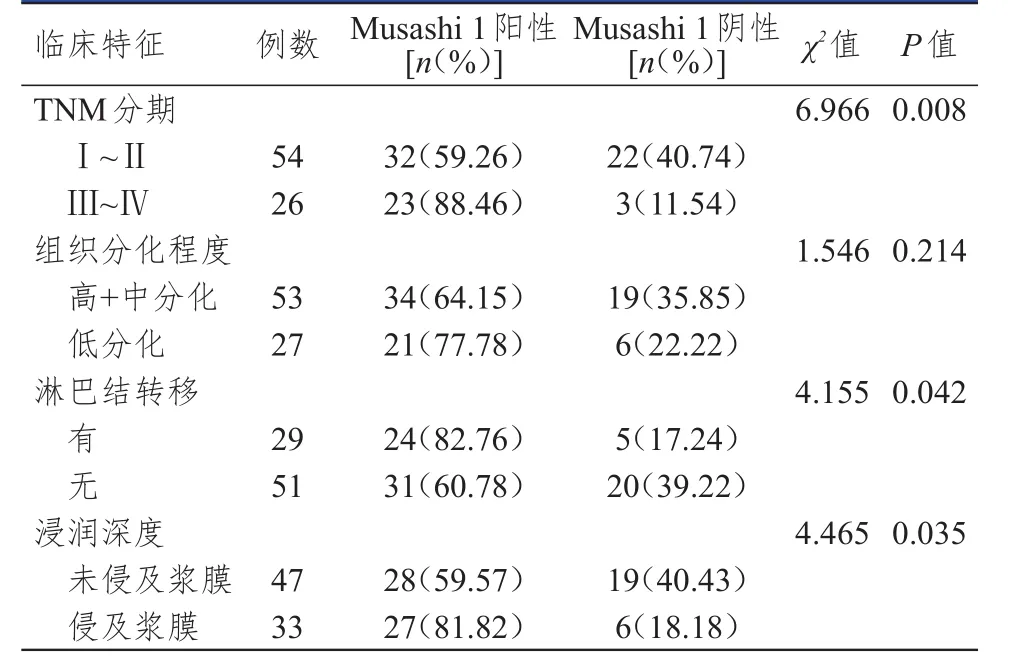
表2 不同临床特征结肠癌患者结肠癌组织中Musashi 1蛋白表达情况的比较( n=80)
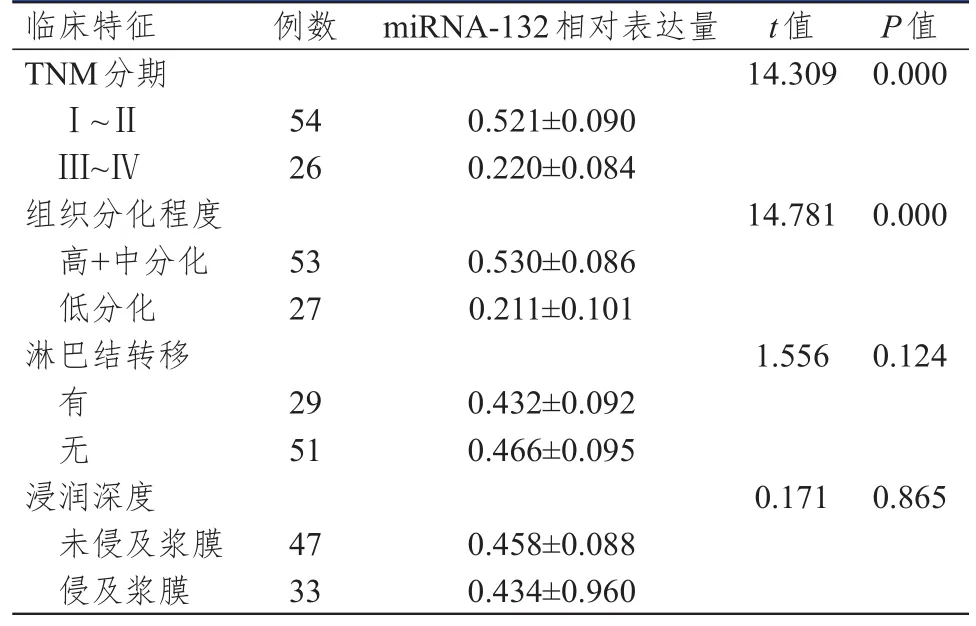
表3 不同临床特征结肠癌患者结肠癌组织中miRNA‐132相对表达量的比较( n=80)
3 讨论
高蛋白饮食、吸烟或家族性肠道息肉均能够促进肠道黏膜上皮细胞的异常病变,增加结肠癌的发生风险[6‐7]。研究发现,结肠癌患者的无瘤生存时间不足30个月,随着时间延长,患者多器官功能衰竭的发生率明显上升[8]。对结肠癌患者的临床特征进行分析具有一定的临床价值,能够在结肠癌的病情评估及预后预测方面发挥作用。虽然糖类抗原125(carbohydrate antigen 125,CA125)和癌胚抗原(car‐cinoembryonic antigen,CEA)等肿瘤标志物能够在结肠癌的病情评估中发挥作用,但仅依靠CA125或CEA评估结肠癌患者的病情可靠性较低[9‐10]。本研究的创新性在于探讨了Musashi 1蛋白和miRNA‐132表达情况与结肠癌患者临床特征的关系。
miRNA‐132作为非编码RNA家族成员之一,能够通过影响细胞增殖、凋亡及纺锤体的分离等过程,最终影响上皮来源恶性肿瘤细胞的发生过程。miRNA‐132可激活肿瘤细胞内不同的信号通路,抑制肿瘤细胞核DNA分裂,导致肿瘤细胞发生异型性改变[11]。Musashi 1是一种RNA结合蛋白,不仅能够影响miRNA‐132的活性,还能够通过影响肿瘤细胞膜内侧第二信使的活性,促进肿瘤细胞膜上跨膜双分子蛋白的异常激活,最终导致肿瘤细胞内信号转导通路异常。部分研究者探讨了miRNA‐132在结肠癌组织中的表达情况,结果发现结肠癌组织中miRNA‐132的表达水平较低[12‐13],但缺乏对于Musashi 1表达情况的分析。
本研究发现,结肠癌组织中Musashi 1蛋白的阳性表达率明显高于癌旁组织,miRNA‐132的相对表达量明显低于癌旁组织,差异均有统计学意义(P<0.01),提示Musashi 1蛋白和miRNA‐132的异常表达均可能与结肠癌的发生有关。Musashi 1蛋白和miRNA‐132表达水平的改变能够通过激活结肠癌细胞内促分裂原活化的蛋白激酶(mitogen‐activated protein kinase,MAPK)信号通路,增加结肠癌细胞的浸润和黏附能力,最终导致结肠癌细胞的分化成熟障碍,从而参与结肠癌的病情进展。贾伟等[14]研究报道,结肠癌组织中Musashi 1蛋白的阳性表达率高于癌旁组织,在中晚期或合并明显恶病质表现的结肠癌患者中,Musashi 1蛋白的阳性表达率更高。本研究结果显示,TNM分期为Ⅲ~Ⅳ期、有淋巴结转移、侵及浆膜的结肠癌患者结肠癌组织中Musashi 1蛋白的阳性表达率分别高于TNM分期为I~Ⅱ期、无淋巴结转移、未侵及浆膜的结肠癌患者,差异均有统计学意义(P<0.05)。提示Musashi 1蛋白的表达水平与结肠癌患者的临床特征具有密切关系,这主要是由于Musashi 1蛋白的表达水平升高可增加结肠黏膜上皮细胞的浸润能力,促进其对结肠肌层组织或结肠引流部位淋巴结的浸润,最终促进病情进展[15]。本研究结果还显示,TNM分期为I~Ⅱ期、高+中分化的结肠癌患者结肠癌组织中miRNA‐132的相对表达量分别明显高于TNM分期为Ⅲ~Ⅳ期、低分化的结肠癌患者,差异均有统计学意义(P<0.01)。表明miRNA‐132也能够影响结肠癌患者的病情进展,这主要是由于miRNA‐132的表达水平下降能够通过负反馈调节结肠黏膜上皮细胞的转录活性,促进结肠癌细胞内多种肿瘤相关效应因子的激活,进而影响结肠癌患者的病情。但本研究未发现miRNA‐132表达水平与结肠癌患者淋巴结转移的关系,表明miNA‐132表达水平的改变并不影响结肠癌细胞对淋巴结组织的黏附过程。
综上所述,结肠癌组织中Musashi 1蛋白表达上调,miRNA‐132表达下调,且其表达情况与结肠癌的恶性程度有关。但关于Musashi 1蛋白和miR‐NA‐132表达情况与结肠癌患者临床预后或生存转归的关系,仍然需要进一步深入研究和探讨。

