miRNA-574- 5 p通过靶基因高温需求因子 A 1调控肝癌细胞增殖、侵袭、迁移的分子机制
朱琼琼,陈雅宁,卢文杰,董贤明
河南省第二人民医院1消化内科,2呼吸内科,郑州451191
肝癌是临床中常见的消化道恶性肿瘤之一,发病率居世界第5位,死亡率居世界第3位。近年来,肝癌的发病率和病死率逐年上升,但目前仍缺乏有效的防治方法[1]。微小RNA(microRNA,miR‐NA)通过与靶基因的3'UTR结合调控靶基因的转录后水平,进而参与调控细胞的增殖、分化、凋亡等过程。miRNA‐574‐5p已被证实在宫颈癌和乳头状甲状腺癌的增殖、侵袭、转移中发挥重要作用,其在肿瘤组织中的表达水平较高,下调其表达可抑制肿瘤细胞的增殖、迁移,促进细胞凋亡[1‐3]。哺乳动物高温需求因子A1(high temperature require‐ment factor A1,HTRA1)作为一种分泌蛋白,与细胞外基质的降解密切相关[4]。研究报道,HTRA1参与食管癌、肝癌等疾病的发展过程,食管癌组织中HTRA1的表达水平明显低于癌旁组织,肝癌组织中HTRA1mRNA的表达水平明显低于癌旁组织[5‐6]。但miRNA‐574‐5p在肝癌细胞中的表达情况及其对肝癌细胞增殖、迁移和侵袭的影响,且其是否通过靶向调控HTRA1的表达影响肝癌细胞的增殖、迁移和侵袭目前尚未可知。因此,本研究通过生物学技术,探究miRNA‐574‐5p和HTRA1在肝癌细胞中的表达情况,以及miRNA‐574‐5p是否通过靶向调控HTRA1的表达影响肝癌细胞的增殖、迁移和侵袭,现报道如下。
1 材料与方法
1.1 细胞与试剂
肝癌细胞株HepG2、SMMC‐7721、BEL‐7402和正常肝细胞株L02均由上海细胞库提供,DMEM高糖培养基购自美国Hyclone公司,胎牛血清购自北京康为世纪生物科技有限公司,Trizol试剂购自美国Ambion公司,二甲基亚砜(dimethyl sulfoxide,DMSO)购自美国Sigma公司,二喹啉甲酸(bicin‐choninic acid,BCA)蛋白检测试剂盒购自美国Pierce公司,CCK‐8购自上海碧云天生物技术研究所,慢病毒载体pGCL购自上海吉凯基因化学技术有限公司,LipofectamineTM2000转染试剂购自美国Invitrogen 公司,HTRA1、细胞周期蛋白 D1(cyclin D1)、基质金属蛋白酶(matrix metalloproteinase,MMP)2、MMP9、MMP14、p21、p27、甘油醛‐3‐磷酸脱氢酶(glyceraldehyde‐3‐phosphate dehydrogenase,GAPDH)一抗均购自美国Santa Cruz公司,免疫球蛋白 G(immunoglobulin G,IgG)二抗购自美国Thermo Fisher Scientific公司。
1.2 实验方法
1.2.1 细胞培养L02、HepG2、SMMC‐7721、BEL‐7402细胞均采用含10%胎牛血清和双抗(青霉素100 U/ml,链霉素 100 μg/ml)的 DMEM 高糖培养基,置于5% CO2、37℃饱和湿度的细胞培养箱中进行培养。
1.2.2 载体构建、细胞转染与细胞分组构建anti‐miRNA‐574‐5p 及阴性对照质粒 anti‐miRNA‐NC、miRNA‐574‐5p mimic、miRNA‐NC,同时构建 si‐HTRA1及其阴性对照质粒si‐NC、pcDNA‐HTRA1及其对照质粒pcDNA。于6孔板中接种3×105/孔,CO2培养箱中37℃孵育过夜;细胞密度达到50%~80%时,加入无血清培养基中培养6 h,Lipofectami‐neTM2000瞬时转染,转染后4~6 h更换新鲜培养基,于荧光显微镜下观察转染效率。获得稳定低表达miRNA‐574‐5p的 anti‐miRNA‐574‐5p细胞株,标记为anti‐miRNA‐574‐5p组,其阴性对照anti‐miRNA‐NC细胞株标记为anti‐miRNA‐NC组,过表达miR‐NA‐574‐5p 的 miRNA‐574‐5p 细胞株标记为 miR‐NA‐574‐5p组,对照miRNA‐NC细胞株标记为miR‐NA‐NC组,以及HTRA1过表达的细胞株标记为pcDNA‐HTRA1组及其对照细胞株标记为pcDNA组。同时,在稳定低表达的 anti‐miRNA‐574‐5p 细胞株的基础上转染HTRA1低表达si‐HTRA1获得稳定细胞株 anti‐miRNA‐574‐5p+si‐HTRA1(anti‐miRNA‐574‐5p+si‐HTRA1 组)和 anti‐miRNA‐574‐5p+si‐NC(anti‐miRNA‐574‐5p+si‐NC 组)。
1.2.3 实时荧光定量聚合酶链反应(polymerase chain reaction ,PCR)检测miRNA-574- 5 p、HTRA 1表达情况收集处于对数生长期的细胞,采用Trizol试剂提取总RNA,反转录成cD‐NA,采用ABI7500型PCR仪进行实时荧光定量PCR,反应体系:95℃2 min,95 ℃15 s,60 ℃20 s,72 ℃20 s,共 40个循环。miRNA‐574‐5p的上游引物为 3'‐TACGATGAGTGTGTGTGTGTGAGTGT‐5',下游引物为 5'‐GTCCTTGGTGCCCGAGTG‐3';U6 的上游引物为 5'‐TACGAGTGCTCACTTCG‐GCAGC‐3',下游引物为5'‐AACGCTTCAC‐GAATTTGCGT‐3'。HTRA1的 上游引 物 为 3'‐TG‐GAAACTCGGGAGGCCCGTT‐5',下游引物为 5'‐TGGCTTTGCTGGACGTGAGTGAC‐3';GAPDH的上游引物为 5'‐AGAAGGCTGGGGCTCATTTG‐3',下游引物为5'‐AGGGGCCATCCACAGTCTTC‐3'。分别以U6、GAPDH为miRNA‐574‐5p、HTRA1 的内参基因,采用 2-ΔΔCt法计算 miRNA‐574‐5p、HTRA1的表达水平。实验重复3次,取平均值。
1.2.4 蛋白质印迹法(Western blot)检测蛋白表达情况采用RIPA裂解液裂解细胞,提取总蛋白,BCA法测定蛋白浓度并稀释蛋白,进行十二烷基硫酸钠‐聚丙烯酰胺凝胶电泳(sodium dodecyl sul‐phate‐polyacryl amide gel electrophoresis,SDS‐PAGE)凝胶电泳,转移至聚偏二氟乙烯(polyvinyli‐dene fluoride,PVDF)膜;室温脱脂奶粉封闭1 h;添加稀释适当比例的一抗,4℃孵育过夜,TBST清洗3次;二抗室温孵育1 h,TBST清洗3次;滴加电化学发光(electrochemiluminescence,ECL)显影液,使用Image Quant LAS4010凝胶成像仪观察目的蛋白条带,采集图片。分析条带灰度值,以GAPDH为内参,采用Western blot检测转染后HepG2细胞中HTRA1、cyclin D1、p21、p27、MMP2、MMP9、MMP14蛋白的表达水平。
1.2.5 噻唑蓝法检测HepG 2细胞增殖情况调整待测细胞浓度至5×103/ml接种于96孔板中,每孔100 μl,分别于 24、48、72 h 检测细胞增殖情况;弃去培养基,磷酸盐缓冲液(phosphate buffered sa‐line,PBS)清洗细胞,每孔加入噻唑蓝(methylthia‐zolyl tetrazolium,MTT)试剂20 μl,室温孵育42 h,离心留下层细胞,每孔加入100 μl DMSO振荡孵育15 min,采用酶标仪检测490 nm波长处的吸光度值,计算细胞增殖率。
1.2.6 Transwell实验检测 HepG 2细胞迁移和侵袭能力迁移实验:转染后细胞,以每孔104个细胞加入Transwell上室,下室加入含5% FBS的DMEM,5% CO2、37℃条件下培养;12 h后取出小室,弃去培养基,棉签擦去未穿过细胞,90%乙醇固定10 min,0.1%结晶紫溶液染色5 min,PBS清洗;随机选择5个低倍镜视野进行观察,计算穿膜细胞数目。侵袭实验:提前将Matrigel胶置于冰上解冻,并按照1∶2的体积比与无血清DMEM培养基混匀制备Matrigel基质胶;Matrigel基质胶包被Transwell小室,以每孔104个细胞加入Transwell上室,其余操作同迁移实验。
1.2.7 双荧光素酶实验检测miRNA-574- 5 p对HTRA 1的影响构建野生型pGL3‐HTRA1‐3'UTR(WT‐HTRA1 3'UTR)和突变型pGL3‐HTRA1‐3'UTR(MUT‐pGL3‐HTRA1‐3'UTR)表达载体,将构建后的载体采用LipofectamineTM2000瞬时转染至anti‐miRNA‐NC、anti‐miRNA‐574‐5p HepG2 细胞,分别标记为 miRNA‐NC+WT‐HTRA1 组、miRNA‐574‐5p+WT‐HTRA1 组 、miRNA‐NC+MUT‐HTRA1组 和 miRNA‐574‐5p+MUT‐HTRA1 组 。 转 染 后48 h,采用荧光素酶活性检测仪测定荧光素酶活性,以海肾荧光素酶活性为内参,计算荧光素酶的相对活性。
1.3 统计学方法
采用SPSS 20.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,组间比较采用t检验或单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-574- 5 p、HTRA 1 mRNA和HTRA 1蛋白在肝癌细胞和正常肝细胞中的表达情况
L02、HepG2、SMMC‐7721和BEL‐7402细胞中miRNA‐574‐5p、HTRA1mRNA和HTRA1蛋白的表达水平比较,差异均有统计学意义(P<0.01)。与L02细胞系比较,肝癌细胞系HepG2、SMMC‐7721、BEL‐7402 中 miRNA‐574‐5p 的表达水平均升高,HTRA1mRNA和HTRA1蛋白的表达水平均下降,差异均有统计学意义(P<0.05)。(表1)
表1 不同细胞中miRNA‐574‐ 5 p、HTRA 1 mRNA和HTRA 1蛋白表达水平的比较(± s)
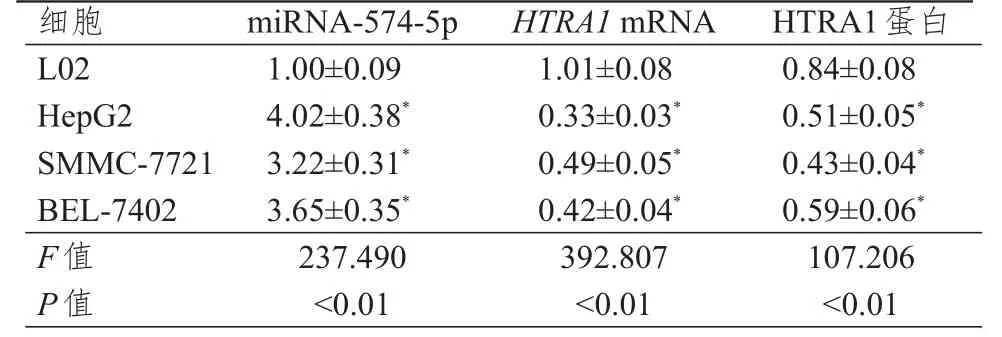
表1 不同细胞中miRNA‐574‐ 5 p、HTRA 1 mRNA和HTRA 1蛋白表达水平的比较(± s)
注:*与L02比较,P<0.05
细胞L 0 2 H e p G 2 S M M C‐7 7 2 1 B E L‐7 4 0 2 F值P值1.0 0±0.0 9 4.0 2±0.3 8*3.2 2±0.3 1*3.6 5±0.3 5*2 3 7.4 9 0<0.0 1 1.0 1±0.0 8 0.3 3±0.0 3*0.4 9±0.0 5*0.4 2±0.0 4*3 9 2.8 0 7<0.0 1 0.8 4±0.0 8 0.5 1±0.0 5*0.4 3±0.0 4*0.5 9±0.0 6*1 0 7.2 0 6<0.0 1 m i R N A‐5 7 4‐5 p H T R A 1 m R N A H T R A 1蛋白
2.2 抑制miRNA-574- 5 p表达对肝癌HepG 2细胞增殖能力及相关蛋白的影响
anti‐miRNA‐574‐5p 组 HepG2 细胞中 miRNA‐574‐5p的表达水平为(0.32±0.03),明显低于anti‐miRNA‐NC组的(1.01±0.09),差异有统计学意义(t=17.816,P<0.01)。与anti‐miRNA‐NC 组比较,anti‐miRNA‐574‐5p组培养48、72 h 的 HepG2 细胞的增殖率均明显降低,cyclin D1蛋白的表达水平明显降低,p21、p27蛋白的表达水平均明显升高,差异均有统计学意义(P<0.01)。(表2)
2.3 抑制miRNA-574- 5 p表达对肝癌HepG 2细胞迁移、侵袭及MMP相关蛋白的影响
与anti‐miRNA‐NC组比较,anti‐miRNA‐574‐5p组HepG2细胞的迁移、侵袭数目及MMP2、MMP9、MMP14蛋白的表达水平均明显减少,差异均有统计学意义(P<0.01)。(表3)
2.4 HTRA 1过表达对肝癌HepG 2细胞增殖、迁移和侵袭的影响
pcDNA‐HTRA1组HepG2细胞中HTRA1蛋白的表达水平为(0.81±0.08),明显高于pcDNA组的(0.48±0.05),差异有统计学意义(t=8.568,P<0.01)。与pcDNA组比较,pcDNA‐HTRA1组HepG2细胞48、72 h的增殖率明显降低,cyclin D1、MMP2、MMP9蛋白的表达水平均明显降低,p21蛋白的表达水平明显升高,迁移、侵袭数目明显减少,差异均有统计学意义(P<0.01)。(表4)
2.5 miRNA-574- 5 p靶向调控HTRA 1的表达
Target Scan生物信息学软件预测显示,miR‐NA‐574‐5p与HTRA1的3'UTR区域存在结合位点,提示HTRA1的3'UTR中含有与miRNA‐574‐5p互补的核苷酸序列(图 1),根据 miRNA‐574‐5p与HTRA1的潜在结合位点,构建 WT‐HTRA1‐3'UTR和MUT‐HTRA1‐3'UTR质粒,双荧光素酶报告实验显示,miRNA‐574‐5p+WT‐HTRA1组 HepG‐2细胞的荧光素酶活性为(0.42±0.04),明显低于miRNA‐NC+WT‐HTRA1组的(1.01±0.09),差异有统计学意义(t=14.674,P<0.01)。miRNA‐574‐5p+MUT‐HTRA1组HepG‐2细胞的荧光素酶活性为(1.02±0.09),与 miRNA‐NC+MUT‐HTRA1组的(1.04±0.08)比较,差异无统计学意义(P>0.05)。West‐ern blot检测结果显示,miRNA‐574‐5p组HepG‐2细胞中HTRA1蛋白的表达水平为(0.21±0.02),低于miRNA‐NC组的( 0.53±0.05),差异有统计学意义(P<0.05);anti‐miRNA‐574‐5p 组 HepG‐2 细胞中HTRA1蛋白的表达水平为(0.89±0.08),高于anti‐miRNA‐NC组的(0.50±0.05),差异有统计学意义(P<0.05);4组HepG‐2细胞中HTRA1蛋白的表达水平比较,差异有统计学意义(F=315.763,P<0.01),进一步证实了 miRNA‐574‐5p可直接下调HTRA1的表达。
2.6 抑制HTRA 1表达逆转抑制miRNA-574- 5 p表达对肝癌HepG 2细胞增殖、迁移、侵袭的作用
anti‐miRNA‐NC 组、anti‐miRNA‐574‐5p 组、an‐ti‐miRNA‐574‐5p+si‐NC 组和 anti‐miRNA‐574‐5p+si‐HTRA1组HepG2细胞中HTRA1蛋白的的表达水平分别为(0.52±0.05)、(0.84±0.08)、(0.87±0.08)、(0.66±0.06),差异均有统计学意义(F=68.127,P<0.01)。不同组别HepG2细胞的增殖(48、72 h)、迁移、侵袭及相关蛋白的表达情况比较,差异均有统计学意义(P<0.01)。与anti‐miR‐NA‐NC组比较,anti‐miRNA‐574‐5p组HTRA1蛋白的表达水平升高,培养48、72 h的肝癌HepG2细胞的增殖率均降低,cyclin D1、MMP2、MMP9蛋白的表达水平均下降,细胞迁移、侵袭数目均减少,p21蛋白的表达水平升高,差异均有统计学意义(P<0.05)。与 anti‐miRNA‐574‐5p+si‐NC 组比较,anti‐miRNA‐574‐5p+si‐HTRA1组HTRA1蛋白的表达水平降低,培养48、72 h肝癌HepG2细胞的增殖率均升高,cyclin D1、MMP2、MMP9蛋白的表达水平均升高,迁移、侵袭细胞数目均增多,p21蛋白的表达水平降低,差异均有统计学意义(P<0.05)。(表5)
表2 不同组别肝癌HepG 2细胞的增殖率及增殖相关蛋白表达水平的比较(± s)
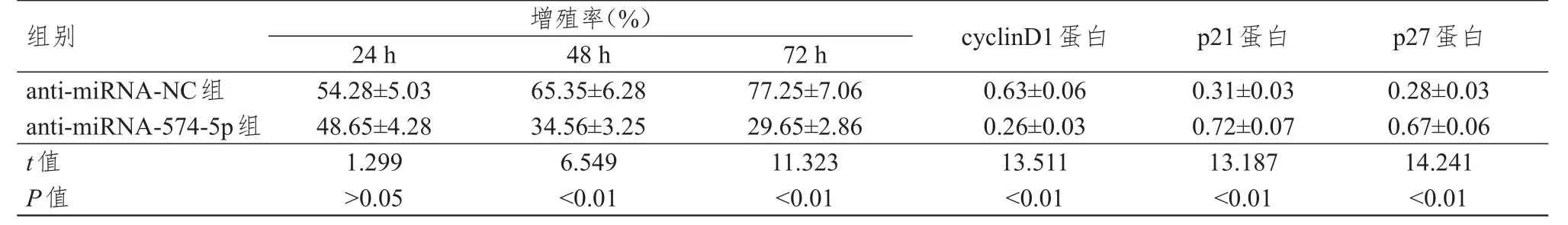
表2 不同组别肝癌HepG 2细胞的增殖率及增殖相关蛋白表达水平的比较(± s)
组别a n t i‐m i R N A‐N C组a n t i‐m i R N A‐5 7 4‐5 p组t值P值5 4.2 8±5.0 3 4 8.6 5±4.2 8 1.2 9 9>0.0 5 6 5.3 5±6.2 8 3 4.5 6±3.2 5 6.5 4 9<0.0 1 7 7.2 5±7.0 6 2 9.6 5±2.8 6 1 1.3 2 3<0.0 1 0.6 3±0.0 6 0.2 6±0.0 3 1 3.5 1 1<0.0 1 0.3 1±0.0 3 0.7 2±0.0 7 1 3.1 8 7<0.0 1 0.2 8±0.0 3 0.6 7±0.0 6 1 4.2 4 1<0.0 1增殖率(%)2 4 h 4 8 h 7 2 h c y c l i n D 1蛋白p 2 1蛋白p 2 7蛋白
表3 不同组别肝癌HepG 2细胞迁移、侵袭数目及MMP相关蛋白表达水平的比较(± s)
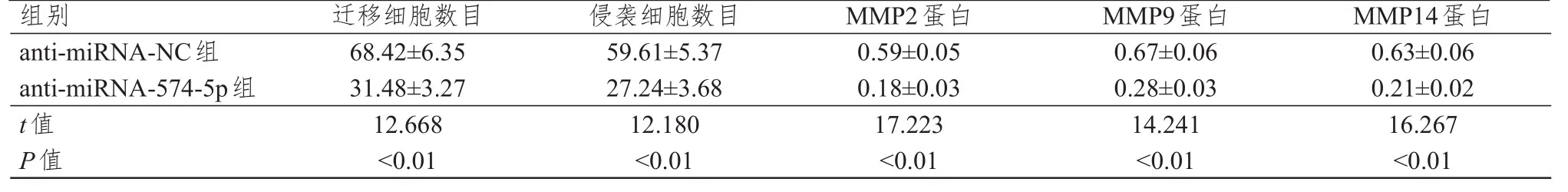
表3 不同组别肝癌HepG 2细胞迁移、侵袭数目及MMP相关蛋白表达水平的比较(± s)
组别a n t i‐m i R N A‐N C组a n t i‐m i R N A‐5 7 4‐5 p组t值P值6 8.4 2±6.3 5 3 1.4 8±3.2 7 1 2.6 6 8<0.0 1 5 9.6 1±5.3 7 2 7.2 4±3.6 8 1 2.1 8 0<0.0 1 0.5 9±0.0 5 0.1 8±0.0 3 1 7.2 2 3<0.0 1 0.6 7±0.0 6 0.2 8±0.0 3 1 4.2 4 1<0.0 1 0.6 3±0.0 6 0.2 1±0.0 2 1 6.2 6 7<0.0 1迁移细胞数目 侵袭细胞数目M M P 2蛋白M M P 9蛋白M M P 1 4蛋白
表4 不同组别肝癌HepG 2细胞增殖、迁移、侵袭情况及cyclin D 1、 p21、MMP 2、MMP 9蛋白表达水平的比较(± s)

表4 不同组别肝癌HepG 2细胞增殖、迁移、侵袭情况及cyclin D 1、 p21、MMP 2、MMP 9蛋白表达水平的比较(± s)
组别pcDNA组pcDNA‐HTRA1组t值P值增殖率(%)24 h 56.34±5.02 50.63±5.02 0.490>0.05 48 h 67.25±6.24 39.41±3.22 4.271<0.01 72 h 76.24±7.03 32.46±2.07 9.453<0.01迁移细胞数目72.46±7.38 39.52±3.55 9.853<0.01侵袭细胞数目62.41±6.28 35.44±4.18 8.757<0.01 cyclin D1蛋白0.65±0.06 0.32±0.03 12.050<0.01 p21蛋白0.28±0.03 0.68±0.07 12.865<0.01 MMP2蛋白0.61±0.06 0.22±0.03 14.241<0.01 MMP9蛋白0.69±0.07 0.36±0.03 10.614<0.01

图1 HTRA 1的 3'UTR和miRNA‐574‐ 5 p序列
3 讨论
肝癌的高复发率和高转移率严重影响患者的生存情况,目前多采用手术、放疗、化疗的方法进行治疗[7]。但是目前的治疗技术仍无法有效防治肝癌的复发、转移,因此,本研究以研究肝癌细胞增殖、转移、侵袭的分子机制为突破口,寻找靶向治疗分子,探究靶向治疗对肝癌防治的意义。
miRNA是一类内源性非编码小分子RNA,随着对miRNA研究的深入,研究证实,miRNA的失调在包括恶性肿瘤、炎症性疾病等在内的多种疾病中发挥重要作用[8]。目前,以miRNA模拟物及siRNA为靶向分子治疗的方案备受医学界青睐。miRNA‐574‐5p已被证实在肿瘤的侵袭和转移中发挥重要作用,乳腺癌患者血清中的miRNA‐574‐5p水平明显高于良性乳腺病变患者及健康人群,且miRNA‐574‐5p水平与乳腺癌患者的临床特征及预后密切相关[2,9];miRNA‐574‐5p在宫颈癌组织中高表达,抑制miRNA‐574‐5p的表达可使宫颈癌细胞的增殖、迁移、侵袭能力均明显下降[10]。研究显示,敲除miRNA‐574‐5p表达能够抑制甲状腺癌细胞的增殖,促进细胞凋亡[4,11]。本研究结果显示,肝癌细胞中miRNA‐574‐5p的表达水平明显高于正常肝细胞;进一步验证miRNA‐574‐5p对肝癌细胞增殖、迁移和侵袭的影响,结果发现,抑制miRNA‐574‐5p的表达后,细胞的增殖率明显下降,迁移和侵袭数目均明显降低,p21、p27蛋白的表达水平均明显升高,cyclin D1、MMP2、MMP9、MMP14蛋白的表达水平亦均明显降低,与上述研究结果一致,提示抑制miRNA‐574‐5p的表达可抑制肝癌细胞的增殖、迁移和侵袭。
HTRA1是第一个被发现的同源性的不同结构域的丝氨酸蛋白酶家族成员[12],被证实作为肿瘤抑制因子表达于多种肿瘤中,但其在肿瘤组织中随着恶性程度的升高呈下调性表达[13‐15]。HTRA1在浸润性宫颈癌组织中的表达水平低于原位癌,抑制宫颈癌细胞增殖的作用减弱[16]。HTRA1在胰腺癌组织中的表达水平明显降低,通过调控Notch‐1促进胰腺癌细胞凋亡,抑制胰腺癌细胞迁移[17]。HTRA1表达的下调与乳腺癌患者的不良预后有关[18]。HTRA1在脑膜瘤、肝癌组织中的表达水平均明显低于正常组织,抑制其表达可增强细胞的迁移和侵袭能力[19‐20]。本研究结果显示,HTRA1在肝癌细胞中的表达水平明显低于正常肝细胞;进一步验证HTRA1对HepG2细胞增殖、迁移和侵袭的影响,结果发现,过表达HTRA1的HepG2细胞的增殖率、迁移和侵袭数目及cyclin D1、MMP2、MMP9蛋白的表达水平均明显降低,p21蛋白的表达水平明显升高,与上述研究结果一致,提示过表达HTRA1可抑制肝癌细胞的增殖、迁移和侵袭。
Target Scan软件预测结果显示,miRNA‐574‐5p与HTRA1的3'UTR区域存在潜在结合位点,双荧光素酶报告实验显示,仅 miRNA‐574‐5p+WT‐HTRA1组HepG2细胞中miRNA‐574‐5p的表达水平明显降低,提示miRNA‐574‐5p可通过直接与HTRA1的3'UTR区域结合抑制HTRA1的表达;进一步验证miRNA‐574‐5p与HTRA1在肝癌发展中的作用,结果发现,过表达miRNA‐574‐5p的HepG‐2细胞中HTRA1蛋白的表达水平明显下降,抑制miRNA‐574‐5p表达的HepG‐2细胞中HTRA1蛋白的表达水平明显升高,提示miRNA‐574‐5p可靶向负调控HTRA1的表达;进一步研究miRNA‐574‐5p靶向HTRA1对肝癌细胞增殖、迁移、侵袭的影响,结果显示,与 anti‐miRNA‐574‐5p+si‐NC组比较,an‐ti‐miRNA‐574‐5p+si‐HTRA1组肝癌细胞的增殖率、迁移细胞数目、侵袭细胞数目,以及cyclin D1、MMP2、MMP9蛋白的表达水平均明显升高,p21蛋白的表达水平明显降低,提示抑制HTRA1表达可逆转抑制miRNA‐574‐5p表达引起的HepG2细胞增殖抑制及迁移、侵袭细胞数减少的作用,提示miRNA‐574‐5p可靶向HTRA1调控肝癌细胞的增殖、迁移和侵袭。
表5 抑制HTRA 1表达逆转抑制miRNA‐574‐ 5 p表达对肝癌HepG 2细胞增殖、迁移、侵袭的作用(± s)

表5 抑制HTRA 1表达逆转抑制miRNA‐574‐ 5 p表达对肝癌HepG 2细胞增殖、迁移、侵袭的作用(± s)
注:a与anti‐miRNA‐NC组比较,P<0.05;b与anti‐miRNA‐574‐5p+si‐NC组比较,P<0.05
组别a n t i‐m i R N A‐N C组a n t i‐m i R N A‐5 7 4‐5 p组a n t i‐m i R N A‐5 7 4‐5 p+s i‐N C组a n t i‐m i R N A‐5 7 4‐5 p+s i‐H T R A 1组F值P值5 5.3 2±5.3 5 5 1.2 3±5.0 2 4 8.2 6±4.2 8 5 2.6 1±5.2 8 1.8 6 1>0.0 5 6 8.2 5±6.0 7 3 8.6 5±3.2 8 a 3 7.9 1±3.0 7 5 9.6 2±5.0 7 b 8 0.2 7 4<0.0 1 7 6.9 8±7.0 2 3 1.5 2±3.2 8 a 2 9.6 5±2.7 7 6 5.4 2±6.0 7 b 1 6 4.6 4 0<0.0 1 7 3.5 2±7.3 2 3 2.4 9±3.7 1 a 2 8.5 4±3.5 1 5 9.6 7±5.3 4 b 2 0 7.8 6 8<0.0 1 6 2.3 8±6.1 6 2 4.3 1±3.0 5 a 2 1.9 7±3.4 8 4 8.6 8±4.3 9 b 2 3 3.1 3 0<0.0 1 0.6 4±0.0 6 0.2 5±0.0 3 a 0.2 2±0.0 3 0.5 1±0.0 5 b 2 5 2.1 5 2<0.0 1 0.3 0±0.0 3 0.7 3±0.0 7 a 0.7 6±0.0 7 0.4 9±0.0 5 b 1 7 0.9 0 9<0.0 1 0.6 1±0.0 6 0.2 1±0.0 3 a 0.1 9±0.0 2 0.4 7±0.0 4 b 3 0 9.1 6 9<0.0 1 0.6 8±0.0 7 0.2 9±0.0 3 a 0.2 7±0.0 2 0.5 5±0.0 5 b 2 2 2.2 9 9<0.0 1增殖率(%)2 4 h 4 8 h 7 2 h迁移细胞数目侵袭细胞数目c y c l i n D 1蛋白p 2 1蛋白M M P 2蛋白M M P 9蛋白
综上所述,本研究初步探讨了miRNA‐574‐5p在肝癌中的作用及机制,验证了miRNA‐574‐5p靶向调控HTRA1的表达对肝癌细胞增殖、迁移、侵袭的影响,为肝癌的分子靶向治疗提供理论依据。本研究尚存在不足之处,关于miRNA‐574‐5p和HTRA1靶向调控通路有待进一步深入研究。

