一株野生紫丁香蘑的分离鉴定及其菌种扩繁技术初探
岳万松 刘绍雄 郭 相 余金凤 张俊波 李雪松 罗孝坤*
(1云南云菌科技(集团)有限公司,云南昆明650221;2云南省供销合作社科学研究所,云南昆明650221;3中华全国供销合作总社昆明食用菌研究所,云南昆明650221)
紫丁香蘑(Lepista nuda)隶属白蘑科(Tricholomtaceae)、香蘑属(Lepista)[1]。香蘑属包含多种肉质细嫩、味道鲜美的食用菌。紫丁香蘑是云南一种常见的野生食用菌,在欧洲受欢迎程度可比松茸、牛肝菌[2-3]。研究表明紫丁香蘑有潜在的抗氧化活性、抗菌活性及抗肿瘤活性,有广泛的市场应用前景[4-6]。但紫丁香蘑属外生菌根菌[7],人工栽培难度较大。近年来我国科研工作者对同属中的花脸香蘑(L.sordida)人工驯化栽培研究较多,目前已取得较大突破[8-9]。而对紫丁香蘑的驯化研究仅在菌株分离鉴定、生物学特性、液体培养基及二级种筛选等方面[10-15]。已有研究表明,紫丁香蘑驯化栽培存在发菌速度慢、制种周期长、栽培周期长等问题[16-17],这也成为制约紫丁香蘑规模化栽培的主要技术瓶颈。由此可见,快速扩繁优良的菌种是紫丁香蘑驯化栽培的关键步骤之一。目前,食用菌菌种生产多采用固体菌种逐级扩繁,菌种生产周期长,且菌龄不一致。而液体菌种具有接种方便快速、发菌快、菌龄一致、制种周期短等优点,因此具有广阔的应用前景[18-20]。
笔者对云南昆明采集的1株野生紫丁香蘑进行形态学和分子生物学种属鉴定,分离得到纯培养菌株,然后分别用其培养液体菌种和固体菌种制备栽培种,比较分析两种制种方式流程和制种周期,最终筛选出一套快速而有效的紫丁香蘑栽培种制备技术,为紫丁香蘑的人工驯化栽培提供参考。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株
2018 年11 月在云南昆明市阿子营采集到1 株野生紫丁香蘑(图1a),组织分离获得母种,保藏于昆明食用菌研究所菌种与资源研究中心,菌株编号为Z1。
1.1.2 培养基配方
PDA 培养基:土豆200 g(煮沸过滤取汁),葡萄糖20 g,琼脂15 g,加水至1 L。培养基121 ℃灭菌30 min。用于母种分离和保藏。
平皿菌种活化培养基:土豆200 g,胡萝卜50 g,葡萄 糖 15 g,蔗 糖 5 g,黄 豆粉 30 g,蛋白胨 3 g,KH2PO41 g,MgSO40.5 g,琼脂 15 g,加水至 1 L。土豆和胡萝卜煮沸过滤取汁。培养基121 ℃灭菌30 min。
液体综合培养基配方同菌种活化培养基,不加琼脂粉,用于一、二级液体菌种或者发酵罐菌种的发酵培养。培养基121 ℃灭菌30 min。
原种、栽培种培养料配方:小麦59%,锯末38%,蔗糖1%,石灰1%,普钙1%,含水量均为60%~65%。原种培养料用650 mL广口瓶装料灭菌;栽培种培养料用聚丙烯塑料袋(12 cm×24 cm×0.005 cm)装料灭菌。上述培养料121 ℃灭菌2 h。
1.2 试验方法
1.2.1 形态学鉴定
采集当天参考文献[2]和[7]完成对野生子实体(M1)的形态特征鉴定。
1.2.2 菌株分离
采用组织分离法在PDA 无菌平板上培养、纯化(培养条件为28 ℃恒温避光,单次培养时间为7~10 d)菌株,编号为Z1,于4 ℃冰箱中保存备用。将分离菌株Z1 接种于活化培养基上培养,7 d 后观察记录菌落特征、菌丝形态。组织分离的剩余新鲜子实体用硅胶干燥保存于无菌样品袋内,用于提取DNA。
1.2.3 分子鉴定
子实体M1 及其分离菌株Z1 总DNA 的提取均采用CTAB 提取法[21],引物采用上海生工生物工程技术公司合成的通用引物 ITS1 和 ITS4[22],50 μL 反应体系和ITS 反应条件参考文献[23]完成。PCR 产物送昆明硕擎生物科技有限公司测序。将测得的ITS 序列用DNAMAN 进行拼接,将ITS 序列提交GenBank 数据库进行BLAST 比对,获得多条参考序列进行多重对位排列,并手动去除排列结果中两端的非对位排列区。用MEGA5.1 进行系统发育树的构建。
1.3 栽培种制备
1.3.1 液体菌种扩繁栽培种
将菌株Z1 的试管母种从4 ℃冰箱中取出并转接到装有活化培养基的平皿(直径6 cm)中培养(培养条件为25 ℃恒温避光,单次培养时间为11 d)。待菌丝长满整个平皿,取10 块平皿菌落(直径为5 mm)转至含有200 mL 液体综合培养基的三角瓶(500 mL)中,置于摇床 160 r/min、25 ℃恒温培养8 d,得到一级液体菌种。取45 mL 的一级液体菌种转至含有800 mL 液体综合培养基的三角瓶(1 L)中,置于电磁摇床上25 ℃恒温继续培养6 d,得到二级液体菌种。冷却后取20 mL二级液体菌种接入固体栽培种培养料袋,培养箱中25 ℃恒温培养至菌丝满袋,观察记录菌丝生长情况。3 个重复,每个重复100袋。
1.3.2 固体菌种扩繁栽培种
母种扩繁同1.3.1。取3 块平皿菌落(约3 cm2)接入原种培养基,培养箱25 ℃恒温培养至满瓶,观察记录菌丝生长情况。再取20 g原种接入栽培种培养料中,培养箱中25 ℃恒温培养至菌丝满袋,观察记录菌丝生长情况。3个重复,每个重复100袋。
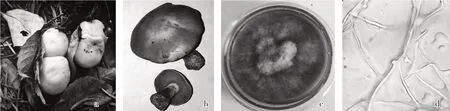
图1 M1子实体及分离培养菌丝形态特征
2 结果与分析
2.1 M1菌株的形态特征及分离培养结果
采集野生菌株M1 子实体中等大小,菌盖直径3.5~10 cm,半球形至平展,亮紫色、丁香紫色至紫色,光滑,湿润,边缘内卷,无条纹。菌肉淡紫色,较厚。菌褶紫色,直生至稍延生,边缘往往呈小锯齿状。菌柄长4~9 cm,粗0.5~2 cm,圆柱形,色同菌盖,初期上部有絮状粉末,下部光滑或具有纵条纹,内实,基部稍膨大(图1a、b)。分离菌株Z1菌丝在活化培养基上呈淡紫色,辐射状生长,后期会形成大量气生菌丝,大约11 d 左右菌丝可长满整个平皿(图1c);其菌丝壁薄,分枝较多,存在大量的锁状联合结构(图1d)。
综合以上特征,M1菌株具有显著香蘑属真菌特征,确定其为香蘑属真菌。
2.2 菌株分子鉴定结果
通过PCR 扩增和ITS 序列测定,获得子实体M1及其分离菌株Z1 的ITS 序列,其ITS 序列长度分别为610 bp、608 bp。ITS序列聚类分析结果表明,M1、Z1 与NCBI 库里的多个菌株共聚为4 个类群,其中M1、Z1 与L.nudaLC370442 菌株的序列相似性高达100%(图2),结合形态学和分子鉴定,将M1、Z1 鉴定为紫丁香蘑(Lepista nuda)。
2.3 液体菌种、固体菌种扩繁栽培种结果
试验结果表明,紫丁香蘑固体原种培养需30 d,从一级液体菌种到二级液体菌种共需14 d。将固体原种接入培养料后菌丝发满菌袋需要47 d,而将液体菌种接入培养料只需41 d 即可满袋。从制种周期来看,传统的固体菌种(图3)需要逐级扩繁母种、原种、栽培种,平均需88 d,而用液体菌种(图4)平均只需66 d,缩短22 d,制种效率显著提高。

图2 基于ITS序列构建的N-J系统发育树

图3 液体菌种扩繁栽培种

图4 固体菌种扩繁栽培种
3 小结与讨论
香蘑属真菌的种间形态相似性较高,单靠传统的分类学方法鉴定容易出现同名异物或同物异名的现象。因此目前多采用形态学分类和分子鉴定相结合的方法来确定菌株种属归类[10-11]。对M1 及其分离菌株Z1 形态学结合ITS 序列分析鉴定,两种方法的鉴定结果一致并相互印证,确定M1、Z1 为紫丁香蘑(Lepista nuda)。
菌种扩繁试验结果表明,采用液体菌种扩繁紫丁香蘑栽培种,相比用固体原种扩繁,制种周期明显缩短。因此,液体转固体制种的方法对紫丁香蘑人工驯化栽培具有较好的实用价值。
今后应扩大试验规模,并进行紫丁香蘑覆土栽培试验。

