lncRNA HOXA11-AS抑制骨关节炎大鼠软骨细胞凋亡与基质降解的作用研究
钱亮,李宏军,施源,邓新超
(武汉市第八医院骨科,湖北 武汉 430010)
骨关节炎(osteoarthritis,OA)是一种退行性关节疾病,其主要特征是关节软骨退化、软骨细胞减少、软骨下硬化重塑和滑膜炎[1],会导致关节疼痛和僵硬,严重时引起关节畸形甚至身体残疾。每年全球有数百万人受到OA的影响,据估计到2020年OA将成为第四大最致残的疾病[2]。OA的发病机制涉及多个因素,其中肥胖、机械压力、性别和衰老是其发生发展的关键因素。目前,控制关节炎引起的疼痛和症状是两个主要的治疗目标。而软骨细胞主要负责软骨的合成-分解代谢平衡,在关节软骨的调节中起着关键作用[3]。越来越多的证据表明,骨关节炎的发生与软骨细胞死亡、凋亡或程序性细胞死亡有关[4-7]。据报道,软骨细胞凋亡在OA的软骨细胞外基质降解中也起着关键作用[6,8]。
长链非编码RNA(long-nocoding RNA,lncRNA)是一类长度200 nt的非编码RNA,有研究表明,许多lncRNA在不同组织中以及在各种发育和病理条件下差异表达,并在肿瘤细胞的恶性生物学行为如增殖、凋亡、迁移和侵袭中具有重要调控作用[9-11]。lncRNA HOXA11-AS是最近发现的lncRNA分子,在胃癌、宫颈癌、卵巢癌等中均发挥着重要的功能[12-15],但其在骨关节炎软骨组织和细胞中的研究尚未见报道。本研究通过检测lncRNA HOXA11-AS在骨关节炎软骨细胞中的表达,来探究其对软骨细胞凋亡、基质降解以及相关通路的影响,以阐明lncRNA HOXA11-AS在骨关节炎进程中的作用。
1 资料与方法
1.1 主要试剂与材料 主要试剂:弗氏完全佐剂、青霉素钠/庆大霉素、青霉素/链霉素、胰蛋白酶、杜氏改良Eagle培养基(dulbecco's modified eagle medium,DMEM)/特性F12培养基(ham's F12 nutrient medium,F12)购于美国Sigma公司;Lipofectamine2000、Annexin V-FITC试剂盒、细胞计数试剂盒(cell counting kit-8,CCK-8)、酶联免疫吸附测定法(enzyme-linked immune sorbent assay,ELISA)试剂盒购于碧云天生物技术研究所;RNAiso Plus试剂盒和All-in-OneTMcDNA第一链合成试剂盒购于美国GeneCopoeia公司;SYBR Premix Ex TaqⅡ试剂盒购于日本Takara公司;抗Ⅱ型胶原(CollagenⅡ)、聚集蛋白聚糖(aggrecan)、基质金属蛋白酶13(matrix metallo protein-13,MMP-13)、血小板结合蛋白基序的解聚蛋白样金属蛋白酶5(a disintesrin and metalloprotease with thrombospondin type 5 motifs,ADAMTS-5)、抗肌动蛋白(β-non-muscle,β-actin)、抗核因子κB抑制蛋白(anti-nuclear factor kappa B inhibitory protein,IκBα)、抗磷酸化核因子κB抑制蛋白(anti-phosphorylated nuclear factor kappa B inhibitory protein,p-IκBα)、抗核因子κB(nuclear factor kappa B,NF-κB)、抗磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)购于美国Abcam 公司。其他试剂为进口分装或国产分析纯。
材料:清洁级健康雄性Sprague-Dawley(SD)大鼠(100±10)g购于武汉大学动物实验中心。
1.2 方 法
1.2.1 OA模型建立 将44只清洁级健康雄性SD大鼠随机分成两组:正常组与模型组,每组22只。参照Panicker法[16]制作大鼠的OA模型:大鼠进行备皮与75%酒精消毒后,将100μL弗氏完全佐剂注射到右前侧膝关节内,分别于第1、3、7天注射1次,每日强制大鼠进行活动60 min。7 d后如果观察到大鼠右前侧膝关节出现红肿热痛,同时伴有软组织肿胀,出现积液以及右前侧膝关节僵硬与活动程度受限等现象,说明模型制作成功。正常组大鼠右后肢内膝骨关节周围组织中与造模大鼠同步注射等容积0.9%氯化钠注射液。造模成功后处死两组大鼠,解剖得到关节软骨组织。
1.2.2 软骨细胞分离与培养 将切下的软骨组织剪碎,用含1%青霉素钠/庆大霉素双抗液的磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,用0.25%胰蛋白酶充分消化,37℃震荡孵育40 min,离心弃上清液,加入0.2% Ⅱ型胶原酶在37℃下震荡孵育6 h,200目滤网过滤,收集滤液,离心弃上清液,得到原代软骨细胞,将其置于含有10%胎牛血清和1%青霉素/链霉素抗生素的DMEM/F12培养基中,在37℃、5% CO2的培养箱中培养,每2天更换1次培养基。当细胞融合度达到80%~90%时,使用0.25%胰蛋白酶消化并收集细胞。取第3代的软骨细胞用于实验。
1.2.3 细胞转染 将软骨细胞按照每孔5×104个的密度接种到6孔板中,培养24 h后进行转染。分别在两个无酶离心管中加4 μg HOXA11-AS小干扰RNA(small interfering RNA,siRNA)(或4 μg阴性对照,NC siRNA)+250 μL opti minimal essential medium(OPTI-MEM)、5 μL Lipofectamine 2000+250 μL OPTI-MEM无血清培养基,室温孵育5 min,将稀释后的siRNA和Lipofectamine 2000充分混匀,室温静置20 min。将培养的细胞用PBS洗涤,添加新鲜培养基,每孔加入上述混合物培养6 h后,弃去上清,PBS清洗后加新鲜培养基继续培养。
1.2.4 CCK-8检测 将转染的软骨细胞以1×104个/孔均匀铺于96孔板中,在37℃、5% CO2培养箱中孵育。分别于0、6、12、24、48、96 h时,每孔加10 μL CCK-8溶液,再将培养板放在培养箱中孵育2 h,在酶标仪上450 nm处检测各组吸光光度值。
1.2.5 流式细胞术检测 软骨细胞转染48 h后,收集悬浮细胞,离心弃去培养基,用不含乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)的胰蛋白酶消化,预冷的PBS洗涤两次,加入500 μL 1×Binding Buffer重悬细胞,在细胞悬浮液加入5 μL Annexin V-FITC,接着加入10 μL碘化丙啶(propidium iodide,PI),室温避光孵育20 min,立即用流式细胞仪进行检测,数据用CELL QUEST软件分析处理。
1.2.6 ELISA检测 软骨细胞转染48 h后收集并离心,得到细胞上清液。加入上清液于96孔板,在37℃下孵育2 h,PBS去除板内液体,洗涤后用滤纸印干;每孔加入抗Bcl-2相关X蛋白(Bcl 2-associated X protein,Bax)、抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、抗半胱氨酸蛋白酶3(caspase-3)一抗工作液(稀释为1︰1 000),37℃孵育1 h,去除板内液体,再次洗涤并用滤纸印干;每孔加入辣根过氧化物酶(horse radish peroxidase,HRP)标记山羊抗兔免疫球蛋白抗体(immunoglobulin G,IgG抗体)(1︰5 000),置37℃孵育1 h,洗板后印干;每孔加入底物工作液,置37℃暗处反应10 min,加入终止液,酶标仪检测490 nm处光密度值(optical density,OD)。
1.2.7 实时荧光定量聚合酶链式反应 用RNAiso Plus提取转染48 h后的软骨细胞总核糖核酸(ribonucleic acid,RNA),根据Gene Copoeia逆转录试剂盒合成互补脱氧核糖核酸(complementary DNA,cDNA),以cDNA为模版,采用SYBR Premix Ex TaqⅡ试剂盒检测基因表达,以GAPDH作为为内参照进行扩增。扩增体系:上游引物1μL、下游引物1 μL、cDNA 2 μL、SYBR Premix Ex TaqⅡ 12.5 μL、无酶水8.5 μL。反应条件:95℃预变性3 min,95℃变性15 s,60℃退火15 s,72℃延伸40 s,共40个循环。实验重复3次,采用2-△△Ct法计算各检测目的基因的相对表达量,使用的引物序列见表1。

表1 实时荧光定量PCR引物序列
1.2.8 蛋白质印迹法 使用RIPA裂解缓冲液(radio immuno precipitation assay lysis buffer,RIPA lysis buffer)提取转染48 h后软骨细胞总蛋白,用聚氰基丙烯酸正丁酯(bicinchoninic acid,BCA)测定蛋白质浓度。将蛋白样品上样到10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)进行电泳,切胶并转移至聚偏二氟乙烯膜(polyvinylidene fluoride,PVDF),5%脱脂奶粉室温封闭2 h。加入抗Collagen-Ⅱ、抗aggrecan、 抗MMP-13、抗ADAMTS-5、抗β-actin、抗IκBα、抗p-IκBα、抗NF-κB p65 4℃过夜。洗膜,加HRP标记的山羊抗兔 IgG抗体(1∶5000),室温孵育2 h;洗膜后,采用ECL化学发光液(electrochemiluminescence,ECL)显影,使用Image-Pro Plus 6.0分析蛋白质灰度值。
1.2.9 细胞免疫荧光染色 将转染48 h后软骨细胞用PBS清洗后,加4%多聚甲醛中固定15 min,在含有0.5%TritonX-100的PBS中通透15 min,PBS清洗。在室温下用10%山羊血清封闭细胞2 h,随后加入NF-κB一抗(1︰200),4 ℃孵育过夜。第2天用PBS洗涤后,滴加FITC标记的荧光二抗(1︰250)室温避光孵育1 h,然后加4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)避光孵育5 min,PBS清洗3次后使用荧光显微镜捕获图像。
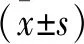
2 结 果
2.1 HOXA11-AS在OA软骨细胞中的表达情况 使用qRT-PCR检测HOXA11-AS在OA大鼠的表达是否发生变化。通过检测OA大鼠和正常组大鼠的软骨细胞发现,与正常组大鼠软骨细胞相比,OA大鼠软骨细胞中HOXA11-AS的表达水平显著上调(P<0.01,见图1)。
注:*与正常组相比,P<0.01
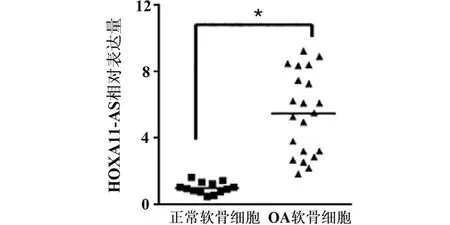
2.2 HOXA11-AS对软骨细胞凋亡的影响 为进一步揭示HOXA11-AS对OA软骨细胞的影响,使用siRNA技术来沉默HOXA11-AS在软骨细胞中的表达。经过RT-PCR检测发现,与阴性对照组(NC siRNA)对比,转染HOXA11-AS siRNA 48 h后,软骨细胞中HOXA11-AS的表达呈显著下降(见图2a,P<0.01)。通过CCK-8检测不同转染时间(0、6、12、24、48、96 h)软骨细胞的活力,与NC siRNA组相比,软骨细胞转染HOXA11-AS siRNA后,在转染12、24、48、96 h后细胞的活性显著下降(见图2b,P<0.01),结果表明HOXA11-AS能提高软骨细胞活性。
a qRT-PCR检测转染48 h后细胞中HOXA11-AS的表达水平 b CCK-8检测不同转染时间软骨细胞的活力
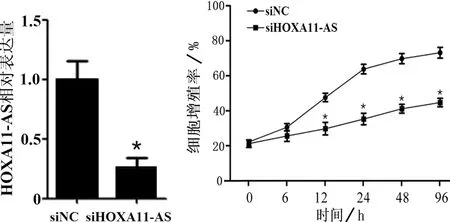
通过流式细胞术检测转染siRNA后软骨细胞的凋亡情况,结果显示:与NC siRNA相比,转染HOXA11-AS siRNA的软骨细胞,其凋亡率明显提高(P<0.01),说明HOXA11-AS能够抑制软骨细胞的凋亡(见图3)。
注:*与正常组相比,P<0.01
通过ELISA检测转染后细胞上清液中大鼠软骨细胞凋亡标志物发现,与NC siRNA相比,转染HOXA11-AS siR-NA的软骨细胞Bax、Caspase-3的表达量显著上升(P<0.05),而Bcl-2的表达量显著低于NC siRNA组(P<0.05,见表2)。
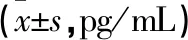
表2 两组大鼠软骨细胞凋亡标志物表达量比较
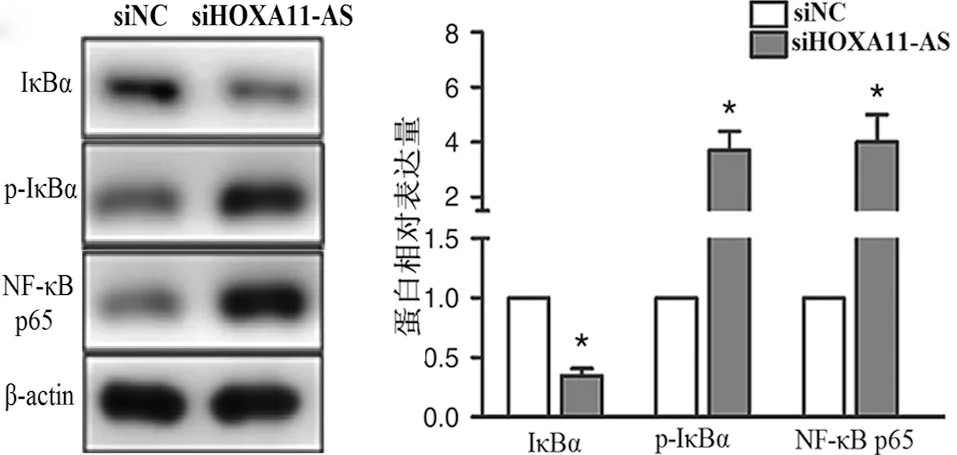
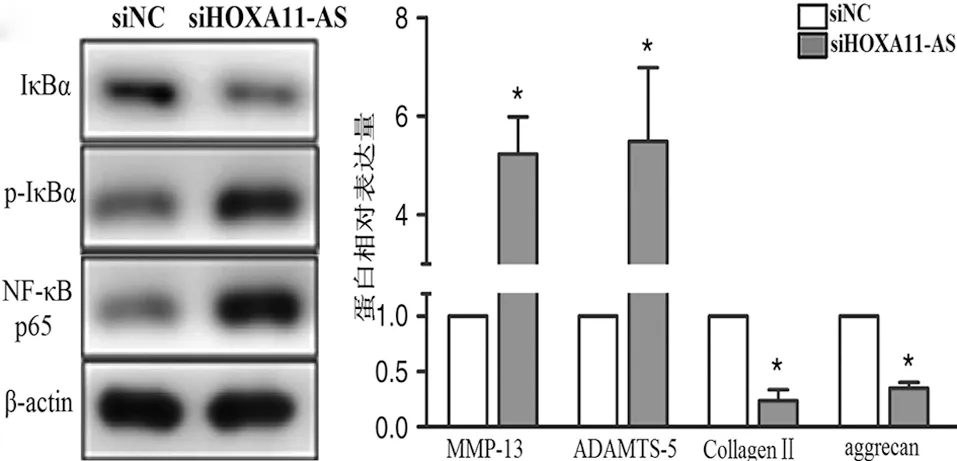
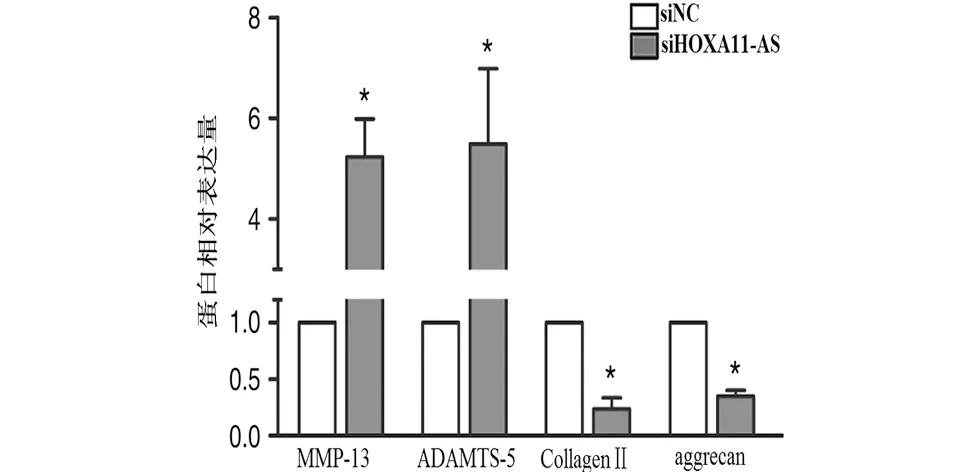
2.3 HOXA11-AS对软骨细胞基质降解的影响 接着我们研究了HOXA11-AS对软骨细胞基质降解的影响,与NC siRNA相比,转染HOXA11-AS siRNA的软骨细胞中MMP-13、ADAMTS-5 mRNA及蛋白表达水平显著上调(P<0.01),而Collagen Ⅱ、aggrecan的mRNA和蛋白表达水平均显著下调(P<0.01,见图4),这一结果表明HOXA11-AS能抑制软骨细胞外基质的降解。
2.4 HOXA11-AS对NF-κB信号通路的影响 与NC siRNA组比较,转染HOXA11-AS siRNA组的软骨细胞中IκBα蛋白表达水平明显降低(P<0.01),p-IκBα和NF-κB p65的蛋白表达水平均明显升高(P<0.01,见图5a)。与此结果一致,通过细胞免疫荧光检测发现HOXA11-AS siRNA组中NF-κB p65在软骨细胞核中的表达水平较高(见图5b)。由此说明沉默HOXA11-AS的表达后激活了NF-κB信号通路,可见HOXA11-AS可抑制NF-κB信号通路的激活。
a Western blot检测转染后软骨细胞中基质降解相关基因蛋白表达情况
b Western blot检测转染后软骨细胞中基质降解相关基因蛋白表达情况
a qRT-PCR检测转染后软骨细胞中基质降解相关基因mRNA表达情况
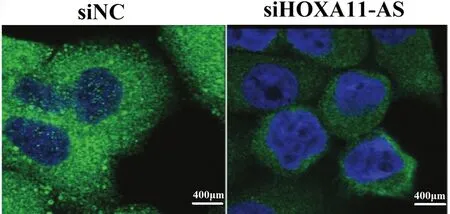
b 免疫荧光检测转染后软骨细胞核中NF-κB p65的表达情况(免疫荧光检测,400 μm)
3 讨 论
软骨细胞是关节软骨中存在的唯一一种细胞类型,它能够调节软骨基质合成与分解之间的平衡。当关节受到过度的机械压力或炎症刺激时,软骨细胞会就发生变性和凋亡,从而导致软骨基质的合成与分解失衡,诱发骨关节炎的不可逆病理过程[17]。越来越多的证据表明,软骨细胞的凋亡极大地促进了骨关节炎的发生与发展[18-20]。
通过近年来的研究发现,lncRNA参与了多种生物学过程,如控制细胞周期、调节免疫应答调节、调控细胞分化和维持胚胎干细胞多能性等[21]。同时,越来越多的证据表明,多种lncRNA与OA的发病机制有关。例如,Steck等[22]证明lncRNA H19是软骨细胞中合成代谢的标志物;Su等[10]发现,与正常对照相比,OA软骨样品中的lncRNA MEG3表达明显下调,并可能通过调节血管生成来促进OA的发展进程;Song等[11]的研究表明,与正常软骨细胞相比,在OA患者的软骨细胞中发现了lncRNA GAS5高表达,而GAS5的过表达还诱导了一些MMPs家族成员的表达,如基质金属蛋白酶2(matrix metallo protein-2,MMP-2)、基质金属蛋白酶3(matrix metallo protein-3,MMP-3)、基质金属蛋白酶9(matrix metallo protein-9,MMP-9)和MMP-13。由此说明,lncRNA在骨关节炎软骨细胞中起到一定的作用,有希望作为OA治疗的靶标。然而,关于HOXA11-AS在骨关节炎中的研究至今却未见报道。通过本研究,我们建立了骨关节炎的大鼠模型,并检测了HOXA11-AS在软骨细胞中的表达情况,发现与正常组相比,HOXA11-AS在OA大鼠的软骨细胞中高表达。
为了进一步确认HOXA11-AS在OA中的功能作用,通过siRNA技术抑制了HOXA11-AS的表达,在不同时间段测定软骨细胞的存活率后发现,从转染HOXA11-AS siRNA 12 h后开始,细胞活力显著下降。同样,在转染HOXA11-AS siRNA的软骨细胞中,细胞凋亡率高于转染NC siRNA对照组,相关细胞凋亡标志物的表达也发生了变化,促凋亡因子Bax、Caspase-3的表达量显著上升,而抑凋亡因子Bcl-2的表达量显著下降,这些结果均从侧面反映了HOXA11-AS能够抑制软骨细胞的凋亡。
而在骨关节炎的发展中,细胞外基质降解起着至关重要的作用,降低软骨细胞基质降解水平可以抑制骨关节炎的进展[23]。aggrecan和Collagen Ⅱ是细胞基质的重要成分,MMP和ADAMTS的过表达能够促进细胞外基质的降解,从而加速软骨组织的破坏[24],当MMP-13和ADAMTS-5过度表达时,促进Collagen Ⅱ和aggrecan的分解。通过研究发现,转染HOXA11-AS siRNA组的软骨细胞中,MMP-13、ADAMTS-5基因和蛋白表达水平均明显升高,同时,Collagen Ⅱ和aggrecan的基因和蛋白表达水平明显下降[25]。由此说明,HOXA11-AS可以抑制软骨细胞中MMP-13和ADAMTS-5的过表达以及Collagen Ⅱ和aggrecan表达下降,从而抑制细胞外基质降解。
NF-κB通路作为调控炎症反应的经典通路,被激活后会引起一系列炎症级联反应,从而诱导细胞凋亡和软骨细胞外基质降解,促进软骨组织退化[26]。通过本研究检测发现,转染HOXA11-AS siRNA组软骨细胞中IκBα蛋白表达水平明显降低,同时p-IκBα和NF-κB p65均明显升高,进而通过细胞免疫荧光检测得到NF-κB p65在HOXA11-AS siRNA组软骨细胞核中的表达水平较高。IκBα是NF-κB活化的抑制剂,但其活化后能显著促进NF-κB活化,NF-κB转移入核并表达为NF-κB p65[27]。结合实验结果表明,HOXA11-AS可抑制NF-κB信号通路的激活。
通过本研究我们首次明确了lncRNA HOXA11-AS在OA软骨细胞中高表达,HOXA11-AS的表达会抑制软骨细胞凋亡、基质降解和抑制NF-κB通路的激活,由此说明HOXA11-AS在骨关节炎进程中起着重要的作用,可作为骨关节炎预防与治疗的靶点。

