血浆HoxD10启动子甲基化监测胃癌的价值
陈丽莉 吴素娜 杨晓敏 陆振斌 刘乐伟 徐焕海
胃癌(GC)是最常见的恶性肿瘤之一,病死率占居我国肿瘤死因的第二位[1]。由于GC的预后与疾病的诊断阶段密切相关,因此迫切需要针对早期阶段的新诊断方法和新疗法。GC的发生发展与癌基因的激活和抑癌基因的失活直接相关;表观遗传学改变常发生在人类GC中,基因启动子区域甲基化过高,基因组整体甲基化过低,组蛋白修饰和非编码RNA改变是GC的主要表观遗传学变化[2]。Homeobox D10(HoxD 10)是同源盒超家族基因之一,在胚胎细胞的分化和GC的进展中起关键作用[3]。Hox D10是一个候选GC抑癌基因,其CpG岛发生异常甲基化,故明确其细胞信号转导、细胞周期和凋亡等多个方面的表达调控机制,有助于加深认识对GC进展等机制[4]。因此,本文探讨血浆中HoxD 10启动子甲基化对GC表达调控作用,分析其在GC组织的关系。现报道如下。
1 资料与方法
1.1 临床资料 选择2014年1月至2015年6月本院收治的门诊及住院患者,签署知情同意书。以胃镜病理诊断为诊断标准,肠上皮化生(IM)组、不典型增生(IN)组、GC组各30例。另收集健康志愿者样本为正常对照组(NC)10例。排除其他胃肠疾病,排除合并其他系统肿瘤或胃转移瘤情况,单纯胃癌患者排除已经接受外科手术或术前化学疗法或放射疗法者,而术后复发者为经内镜下或外科病灶切除治疗,除外放化疗。收集研究对象的全血5ml,并通过以2500r/min离心血液15min分离血浆,并转移至1.5ml EP管中,置于-80℃冰箱保存。然后,根据组织病理学诊断将样品分组。如在一种情况下发生多种病理变化,则诊断应以更高级别的病变为准。根据美国癌症联合委员会(AJCC)分期手册对GC的肿瘤分期进行分类[5]。
1.2 方法 (1)血浆标本收集及处理:全血5ml经离心获取上层血浆并转移至1.5ml EP管中,置于-80℃冰箱保存。集中送本院消化细胞和分子生物实验室进行检测血浆样本HoxD10的甲基化状态。(2)血浆游离DNA的提取:用QIAamp DNA Blood Mini Kit试剂盒提取血浆中游离的DNA,检测提取DNA的纯度和浓度。尽量保证纯化的DNA OD260/OD280在1.6~1.8。提取DNA于-20℃下保存备用。(3)血浆游离DNA的修饰与纯化:根据QIAamp DNA Blood Mini Kit(Qiagen,Hilden,Germany)的说明从血浆样品(400μl)中提取DNA。将提取的DNA溶解在50μl洗脱缓冲液中,并保存在-20℃以下。用EZ DNA MethylationGold™ Kit试剂盒(美国加利福尼亚州奥兰治的Zymo Research)对上述提取的DNA进行重亚硫酸盐处理,未甲基化的胞嘧啶(C)转化为尿嘧啶(U),并且通过柱层析一步完成DNA的纯化和脱硫,回收的DNA可用于甲基化特异性PCR反应。纯化的DNA重悬于10μl洗脱缓冲液中,于-20℃冰箱保存,于2d内进行PCR操作。(4)甲基化特异性PCR[5]:甲基化和非甲基化特异PCR引物,进行甲基化特异性PCR(methylation-Specific PCR,MSP,简称M)。用M进行PCR时,甲基化的DNA能产生特异PCR条带,而未甲基化的DNA则不能产生MSP条带(PCR,UMSP,简称U)。用U扩增时,未甲基化的DNA能产生特异性PCR条带,甲基化的DNA不能产生PCR条带。启动子区发生部分甲基化时,甲基化和非甲基化特异引物都将出现PCR扩增,由此可评估血浆游离DNA中HoxD10启动子区的甲基化水平。配置与设置MSP反应体系与反应程序,PCR产物经1.5%琼脂糖凝胶电泳,Gelred染色,观察产物条带。
1.3 评定指标 (1)评估外周血HoxD10启动子甲基化情况,根据PCR扩增的条带来判断HoxD10的甲基化水平。甲基化结果判断:完全甲基化阳性:M有特异产物,U无产物;部分甲基化阳性:M、U均有特异产物;甲基化阴性:U有特异产物,M无产物。其中甲基化阳性:完全与部分甲基化阳性。(2)评估血清胚抗原(CEA),糖类抗原(CA19-9)和幽门螺杆菌感染状态与通过酶联免疫吸附测定法评估血清CEA和CA19-9水平。CEA和CA19-9分别被认为是阳性标准 :CEA ≥ 5ng/ml和 CA19-9 ≥ 40U/ml[6]。当快速尿素酶实验(RUT)和13C尿素呼气试验(UBT)或组织学分析均呈阳性结果时,诊断为幽门螺杆菌感染。(3)记录性别、年龄、Karnofsky功能状态评分标准(KPS评分)、肿瘤直径、幽门螺杆菌感染、病理分期分型和胃癌预后等详细临床资料,统计分析HoxD10甲基化水平与胃癌前期病变以及胃癌分型,患者预后等相关性。
1.4 随访 患者随访时间40个月,末次随访时间截至2019年12月。记录患者手术之日起至肿瘤复发、转移或死亡时间。其中总生存期(OS),即手术之日起至患者死亡为止,以末次随访时间计算。
1.5 统计学方法 采用SPSS 16.0统计学软件。计数资料以n(%)表示,用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组患者的临床资料比较 见表1。
表1 各组患者的临床资料比较()

表1 各组患者的临床资料比较()
组别 n 性别(男/女) 年龄(岁) Hp(+/-/缺少)NC组 10 6/4 62.11±5.26 6/4/0 IM组 30 18/12 63.36±4.85 8/22/0 IN组 30 20/10 61.74±5.23 5/25/0 GC组 30 21/9 63.25±5.77 5/10/15
2.2 各组患者血浆中检测HoxD10启动子甲基化的琼脂糖凝胶电泳结果比较 不同组患者血浆中检测HoxD10甲基化与非甲基化特异性引物的琼脂糖凝胶电泳结果。见图1。

图1 血浆HoxD10启动子中MSP反应测定的代表性琼脂糖凝胶电泳结果
2.3 各组患者血浆中检测HoxD10启动子甲基化频率比较 在NC→IM→IN→GC发生过程中,HoxD10启动子甲基化频率均明显增加(P<0.01)。NC组血浆DNA中无HoxD10基因被甲基化,表明每个单独的生物标记物对于区分GC和癌前病变与NC的特异性均为100%。见图2。
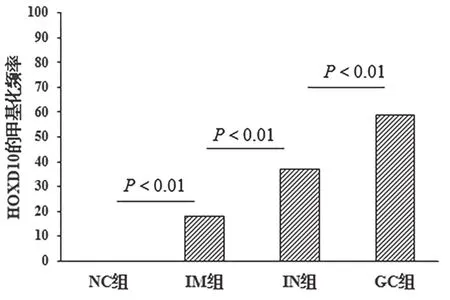
图2 不同组患者血浆中检测HoxD10启动子甲基化频率
2.3 HoxD10启动子甲基化状态与GC患者临床病理特征的相关性 HoxD10启动子甲基化状态与GC患者性别、年龄、KPS评分无相关(P>0.05)。肿瘤直径>5cm与病理分级为高级别(III~IV级)患者HoxD10启动子甲基化阳性率均明显较高(P<0.05);幽门螺杆菌感染、血清CA19-9与血清CEA阳性患者的HoxD10启动子甲基化水平明显更高(P<0.05)。见表2。

表2 HoxD10启动子甲基化状态与GC患者临床病理特征关系
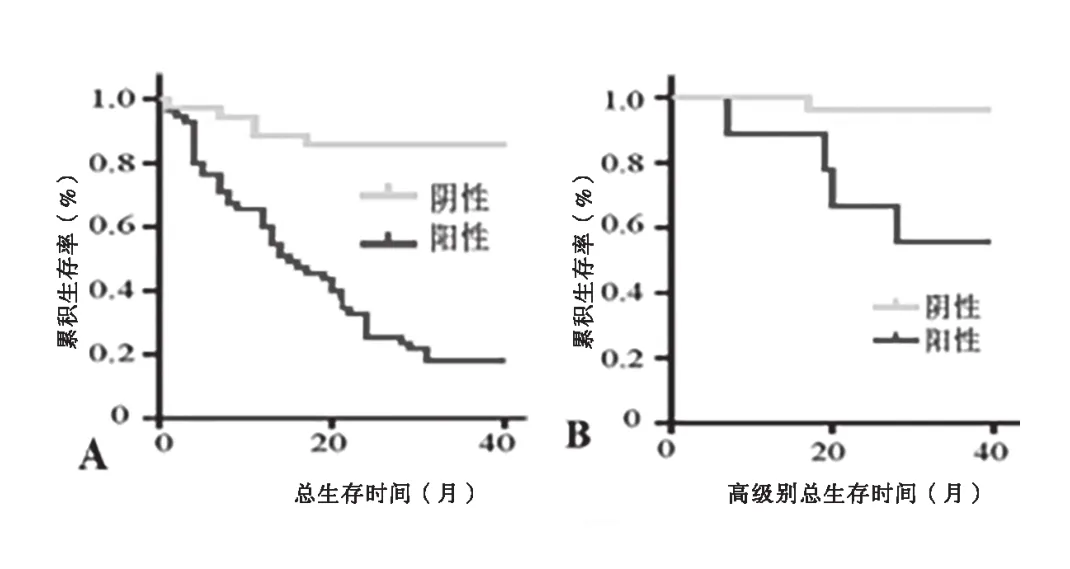
2.5 GC及其不同病理分级患者HoxD10启动子甲基化的Kaplan-Meier生存分析比较 Kaplan-Meier生存曲线表明,HoxD9启动子甲基化阳性GC患者比HoxD9启动子甲基化阴性GC患者的40个月生存率明显降低(P<0.05)。在高级别(III~IV级)GC患者中,HoxD9启动子甲基化阳性者的生存率明显更低(P<0.01)。在低级别(I~II级)GC患者中,HoxD9启动子甲基化阳性者的生存率也明显降低(P<0.05)。见图3。
3 讨论
目前GC单纯通过病理组织形态学早期诊断胃癌较为困难,导致早期诊断率较低、检出率低[7]。慢性胃炎,萎缩,肠上皮化生(IM)和上皮内瘤变(IN)最终发展为GC,而胃IM和IN是癌前病变,会触发至少10倍的发展GC风险[8]。常规血清学肿瘤生物标记物,如碳水化合物抗原19-9(CA19-9)和癌胚抗原(CEA),可能会帮助但缺乏特异性,且对于早期或伴癌前病变的GC识别不敏感,较难将其作为胃癌诊断的硬性指标[9]。目前,胃镜检查和活检仍是确认GC的最有效方法。然而,侵入性检查过程,引起受试者不适。通常,患者不愿进行胃镜检查,这导致治疗延迟。因此,迫切需要寻求一种简便、无创、有效且特异性高的检测方法对GC的早期诊断、治疗和预后随访有着极其重要的意义。
遗传和表观遗传学改变均有助于胃癌的发生。通过异常DNA甲基化使肿瘤抑制基因(TSG)转录沉默被认为是各种癌症起源中的关键表观遗传事件[10-11]。研究表明,在癌症诊断之前可以检测到体液中的甲基化DNA[12-13]。基于患者体液中循环的无细胞DNA(cfDNA)技术代表GC筛选有希望替代的方法。前期研究筛选的可能与胃癌相关的新的候选基因HoxD10基因,在胚胎发育过程中细胞分化和形态发育控制起重要作用[3-4]。近年来研究发现,Hox家族基因与多种恶性肿瘤的发生、发展及预后密切相关,在GC中以及表观癌前病变中被表观沉默[14]。同时,在来自GC和IN患者的血液样本中检测到HoxD10的异常DNA甲基化,表明其潜在以无创方式早期检测GC和癌前病变[15]。但单个基因甲基化的敏感性仍然不令人满意,对多个基因的联合检测可能是一个不错的解决方案。现发现血浆中存在HoxD10甲基化与更深的肿瘤浸润有关,这与以前的发现一致,即HoxD10的异位表达损害GC细胞的侵袭,且在GC组织中检测到HoxD10启动子过度甲基化与TNM分期有关,并表明预后不良[16]。同样,HoxD10可能是晚期的标志物,在晚期GC中显示出高水平的甲基化,而在早期GC中显示出低得多的水平[17]。本研究结果显示,对于HoxD10基因,从NC→IM→IN→GC的发生过程中,HoxD10启动子甲基化频率均明显增加(P<0.01)。对于NC组,血浆DNA中无HoxD10基因被甲基化,即表明每个单独的生物标记物对于区分GC和癌前病变与NC的特异性均为100%。

图3 Kaplan-Meier生存分析
大量研究显示,约90%的DNA片段在肿瘤患者中发生不同程度的甲基化改变,且较多研究提示在GC前病变患者外周血中也存在甲基化现象[18-19]。通过检测从NC→IM→IN→GC等不同时期患者血浆中HoxD10启动子区的甲基化频度变化,并结合患者临床与病理数据,有助于分析血浆HoxD10启动子甲基化水平与GC进展是否存在关联[20]。进一步研究显示,HoxD10启动子甲基化状态与GC患者性别、年龄、Karnofsky功能状态评分标准(KPS评分)无相关。肿瘤直径>5cm、病理分级为高级别(III~IV级)、幽门螺杆菌感染、血清CA19-9与血清CEA阳性患者的HoxD10启动子甲基化阳性率明显更高。Kaplan-Meier生存曲线表明,HoxD9启动子甲基化阳性GC患者比HoxD9启动子甲基化阴性GC患者的40个月生存率明显降低。在高级别(III~IV级)GC患者中,HoxD9启动子甲基化阳性者的生存率明显降低,在低级别(I~II级)GC患者中,HoxD9启动子甲基化阳性者的生存率也明显降低。本研究明确了血浆HoxD10启动子甲基化在GC早期诊断中的作用,则可将上述项目作为临床检测指标进行推广,指导临床早期筛选高危人群,早期诊断、早期干预治疗,延缓GC进展,最终达到提高患者生活质量,提高医疗质量,扩大医疗服务范围,节约卫生资源的目的,同时提高医院的经济和社会效益。
综上所述,HoxD10基因在GC中表达均下降,外周血中游离DNA HoxD10甲基化阳性率能够反映GC组织中的甲基化水平以及GC患者的生存情况。HoxD10启动子甲基化水平有可能为GC的早期诊断提供重要依据。

