岩白菜素抑制AOM/DSS诱导小鼠炎症相关性结直肠癌的作用
张鸿晨 陈杰民 沈红璋 杨建锋 张筱凤
近年来,炎症性肠病(IBD)的发病率在我国及其他亚洲国家呈逐年上升趋势。我国IBD中溃疡性结肠炎(UC)的比例显著高于克罗恩病[1]。炎症相关性结直肠癌(CAC)是导致IBD患者死亡的主要原因之一[2]。肿瘤相关巨噬细胞(TAM)是肿瘤微环境中含量最多的免疫细胞,通过分泌大量炎性因子、生长因子等诱导肿瘤细胞及血管生长,进而促进肿瘤转移和侵袭[4]。研究发现,针对TAM的干预治疗能有效改善结直肠癌预后[5]。岩白菜素(Bergenin)是从岩白菜属植物中提取的异香豆素类化合物,既往发现岩白菜素具有一定的抗炎、抗肿瘤作用,但其具体机制目前尚不清楚[6]。本研究通过对CAC模型小鼠预防性给予岩白菜素,探讨岩白菜素对CAC的保护作用及相关机制。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级雄性C57BL/6小鼠32只(6~8周龄,体质量19~25g)采购自维通利华公司[SCXK(浙)2019-0001],在浙江大学实验动物中心分笼饲养。实验前清洁环境饲养1周,室温22~24℃,相对湿度40%~55%,光照12h/d。自由饮水、进食。实验时间2018年10月至2019年11月。
1.2 主要试剂 葡聚糖硫酸钠(dextransodiumsulfate,DSS)分子量36000~50000,购买自MP Biomedicals公司。岩白菜素(Bergenin,BG)购买自南京景竹生物科技有限公司。氧化偶氮甲烷(Azoxymethane,AOM)购买自Sigma-Aldrich公司。Trizol和逆转录试剂盒均购买自Lifetechnology公司。cDNA反转录试剂盒和SYBR Green实时定量PCR预混液试剂盒购买自美国Applied Biosystems公司。BrdU,CD8和CD68抗体均购买自美国Abcam公司。HE染色液,即用型免疫组化染色试剂盒和二抗均购买于上海碧云天科技有限公司。STAT3和pSTAT3抗体购买自Cell Signaling Technology公司。
1.3 主要仪器 Nanodrop 2000分光光度计购自美国Thermo公司。7500型实时荧光定量PCR仪购买自美国Applied Biosystems公司。光学显微镜(CX31型)购买自日本Olympus公司。Western-blotting检测显色成像仪购自美国Bio-Rad公司。LEICA DFC300 FX图像采集系统购买自德国LEICA公司。
1.4 实验方法 (1)模型建立:将小鼠随机分为3组,即空白组、AOM/DSS组和岩白菜素+AOM/DSS组(BG+AOM/DSS)。CAC造模方法:给腹腔注射AOM(剂量10mg/kg)1周后开始,给予小鼠自由饮用含2%DSS的纯净水1周,继而饮用1周正常纯净饮用水,反复3个循环。岩白菜素给药组小鼠从第1周至第13周,用岩白菜素50mg/(kg·d)灌胃,空白组和模型组每日灌服纯净水作为对照。实验过程中每3d记录小鼠体质量和死亡情况,13周结束后处死小鼠,打开腹腔,从盲肠末端至肛门处取下整段结直肠。沿结肠端纵向剖开肠管,记录肿瘤数目和肿瘤大小和肿瘤负荷(每条结直肠中肿瘤直径之和)。造模方法见图1。(2)结肠成瘤判断和病理检查:计算结肠肉眼可见的成瘤数,实验中使用游标卡尺测定肿瘤平均直径,进而计算肿瘤负荷(即所有肿瘤的直径之和),记录各组小鼠直径≥2mm的肿瘤比例。结肠组织样本用 10%甲醛固定后,进行脱水、石蜡包埋、切片,采用H&E染色,并在光镜下观察组织染色情况,结肠切片请病理科医生判断是否形成肿瘤和评估。(3)RT-qPCR检测:将结肠组织放置在Trizol中研磨提取总RNA,然后使用Nanodrop分光光度计测定提取RNA的浓度与纯度。使用Applied Biosystems反转录与扩增试剂盒进一步合成cDNA,进而进行RT-qPCR扩增(引物见表1)。设置反应条件为:95℃ 5min,(95℃ 15s,56℃15s,72℃ 5s)40个循环。选择18S mRNA 为内参,采用2-ΔΔCt法计算分析目的基因mRNA的相对转录水平。(4)Western blotting检测:液氮冷冻后研磨结肠组织,加入RIPA蛋白裂解液充分裂解细胞。离心后收集上清液,采用BCA试剂盒定量总蛋白浓度。加样,使用SDS-PAGE电泳分离蛋白,将胶上的蛋白转移到甲醇活化的PVDF膜上。然后使用5%脱脂牛奶浸泡PVDF膜室温封闭,洗涤,再与特异性一抗(STAT3,pSTAT3,GAPDH抗体)室温孵育4℃过夜,洗涤,然后将PVDF膜放入使用辣根过氧化物酶的二抗中室温孵育1h。最后使用化学发光试剂与PVDF 膜作用后进行显影和定影,检测STAT3,pSTAT3,GAPDH蛋白表达量。(5)免疫组化和免疫荧光染色:首先将石蜡切片进行二甲苯,酒精,蒸馏水梯度浸泡脱蜡后复水。使用柠檬酸钠抗原修复液置于水浴槽中100℃水浴修复20min,置于室温中进行自然冷却。去离子水清洗后浸泡于含有3%的H2O2溶液中置于4℃冰箱中10min封闭组织中的内源性过氧化物酶。使用5%的BSA溶液室温封闭30min。使用一抗孵育4℃冰箱中过夜。复温清洗后使用辣根过氧化物酶或荧光标记的二抗置于室温中孵育1h后清洗。免疫组化染色使用DAB显色后,苏木素染色后封片;免疫荧光染色使用DAPI然后封片。
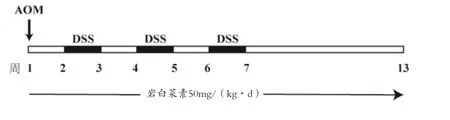
图1 动物模型的造模和给药方法
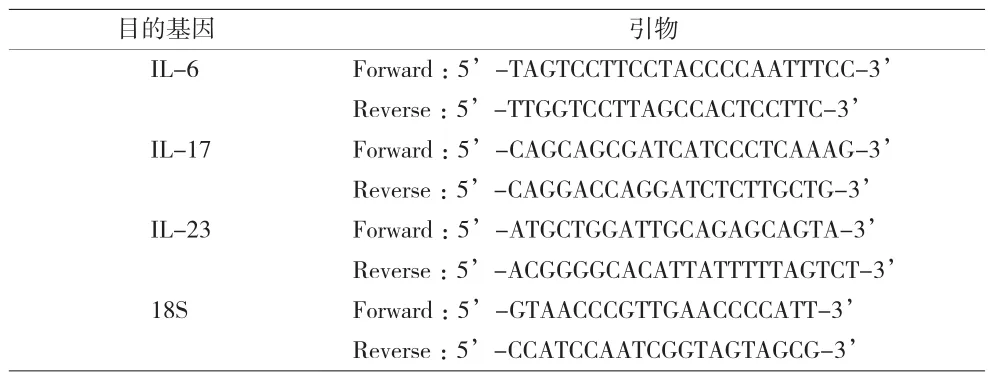
表1 RT-qPCR引物
1.3 统计学方法 采用GraphPad Prism 5.0软件。计量资料以()表示,多组间比较采用单因素方差分析,组间两两比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结果
2.1 岩白菜素对CAC小鼠模型体重、死亡率和成瘤率影响 CAC小鼠模型体重与小鼠的病情发展程度相关,因此在实验过程中对小鼠体重进行记录以监测小鼠状况及岩白菜素的疗效。空白组小鼠体重逐渐上升,生长状态良好。给予AOM/DSS的造模组小鼠,在给予DSS后开始出现便软、便血及脱肛等症状,逐渐出现毛发不顺、精神萎靡不振等表现。而给予岩白菜素+AOM/DSS(BG+AOM/DSS)组小鼠,在给予DSS后体重下降减少。与AOM/DSS组比较,岩白菜素能够明显改善AOM/DSS造模对小鼠体质量的影响(见图2A)。对照组小鼠结直肠中未见异常增生组织;AOM/DSS组小鼠结直肠中可见大小不等的肿瘤,数量为(7.6±2.3),肿瘤负荷为(15±2.9);岩白菜素治疗组小鼠结直肠中存在少量增生和肿瘤,数量为(4.8±1.3),肿瘤负荷为(7.4±2.5),较AOM/DSS造模组显著下降(P<0.01)(见图2B、C)。比较结肠肿瘤大小组成比例发现,BG+AOM/DSS组小鼠直径≥2mm的肿瘤比例显著低于AOM/DSS组(P<0.001)(见图2D)。给予AOM/DSS造模之后,结肠癌模型组小鼠在第4周开始出现死亡,93d时整体死亡率为41.7%,给予岩白菜素组小鼠第9周才开始出现死亡,93d时整体死亡率为8.3%,岩白菜素治疗组能够提高CAC模型小鼠的存活时间,改善生存率(见图2E)。

图2 岩白菜素对CAC模型小鼠结肠肿瘤的影响
2.2 岩白菜素对CAC小鼠模型组织病理学的影响 空白组小鼠结肠隐窝结果排列整齐,且结肠黏膜层及黏膜肌层结构完整;AOM/DSS组小鼠黏膜层部分破坏,隐窝分支呈树状生长,且背靠背腺体生成,肿瘤恶性程度较高,岩白菜素治疗组病理表现明显较模型组减轻,上皮细胞损伤较轻,黏膜层和肌层结构完整。进一步使用BrDU评估结肠上皮细胞异常增殖情况,与AOM/DSS组比较,岩白菜素治疗能使肿瘤区域增殖细胞数量降低51.4%[(35.5±6.9) vs. (17.3±4.3),P<0.001],而非肿瘤区域隐窝增殖细胞数量无显著差别(见图3)。
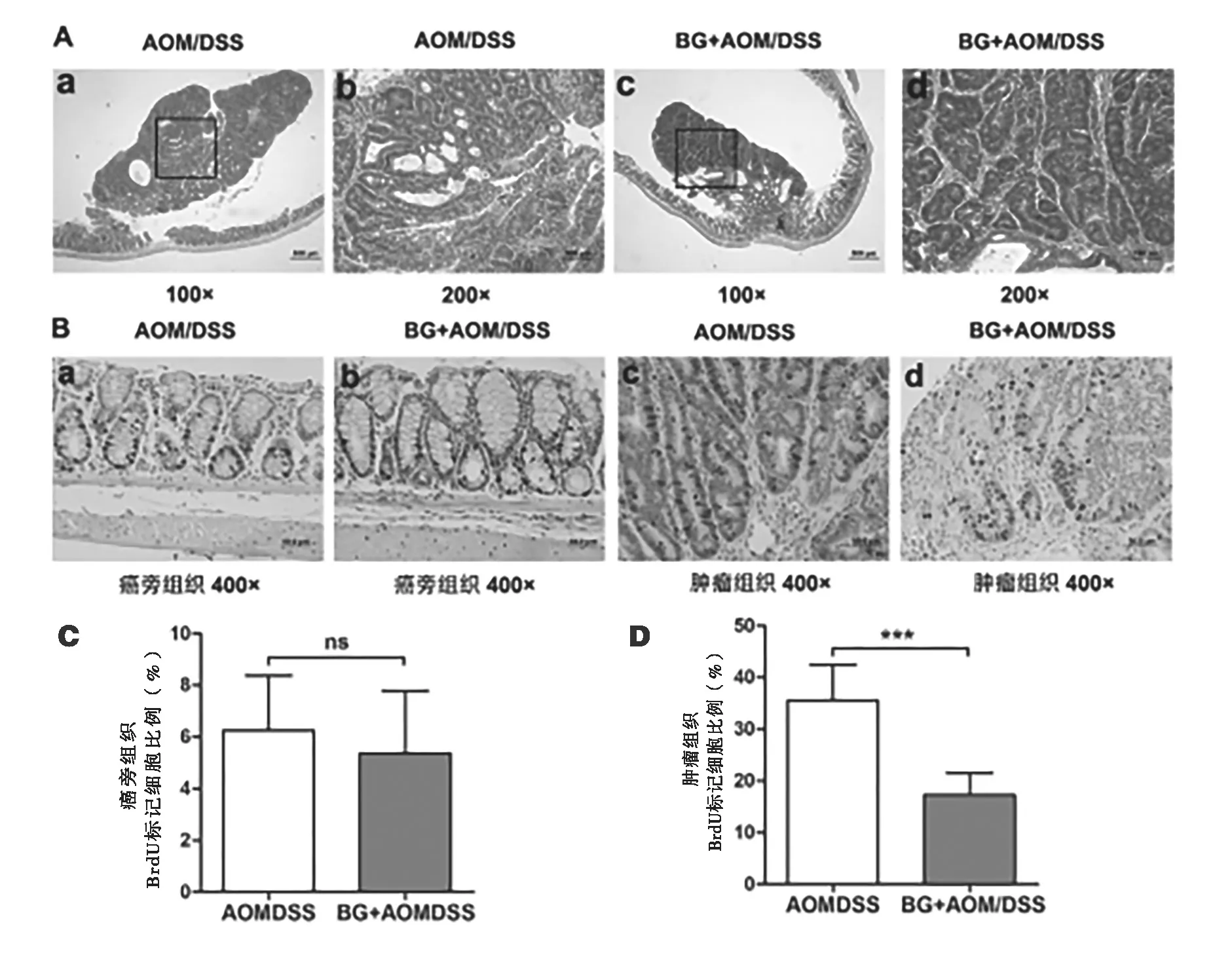
图3 岩白菜素对CAC模型小鼠结直肠组织病理与细胞增殖的影响
2.3 岩白菜素对CAC小鼠结肠炎症因子和pSTAT3表达的影响 BG+AOM/DSS组小鼠结肠中促炎因子IL-6,IL-17和IL-23 mRNA表达显著低于AOM/DSS组(见表2)。在CAC炎症肿瘤进程中,多种炎性因子通过激活转录因子STAT3参与促癌进程。BG+AOM/DSS组结肠中pSTAT3表达量显著降低(P<0.001)(见表3、图 4)。
2.4 岩白菜素对CAC小鼠肿瘤微环境中TAM和CD8+T细胞的影响 BG+AOM/DSS组结肠肿瘤中TAM细胞数量较AOM/DSS组降低[(77.2±11.1) vs.(33.2±6.1),P<0.001],具有抗肿瘤免疫功能的CD8+T细胞数量增多[(20.5±7.1) vs. (50.7±18),P<0.01](见图 5)。

表2 各组大鼠结肠组织IL-6,IL-17和IL-23 mRNA表达水平
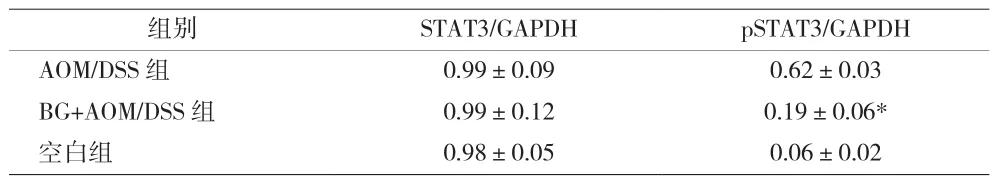
表3 各组大鼠结肠组织STAT3和pSTAT3表达水平
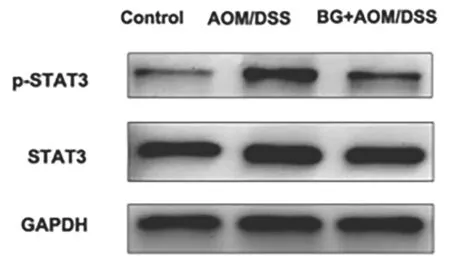
图4 AOM/DSS组与BG+AOM/DSS组小鼠结肠STAT3和pSTAT3蛋白表达的电泳图

图5 岩白菜素对CAC模型小鼠肿瘤微环境中TAM和CD8+T细胞的影响
3 讨论
岩白菜素是从从岩白菜属植物中提取的异香豆素类化合物,临床上目前应用于治疗慢性支气管炎患者,既往发现岩白菜素具有一定的抗炎、抗肿瘤作用,但其具体机制目前尚不清楚[6]。本研究显示,岩白菜素能有效缓解AOM/DSS模型小鼠体重减低,减少小鼠结直肠内肿瘤的发生,降低肿瘤细胞增殖,增加小鼠生存率。同时,岩白菜素能够降低AOM/DSS模型小鼠肿瘤微环境中炎性促癌因子及pSTAT3转录因子表达,增加CD8+T细胞比例,其机制可能与降低TAM浸润相关。
目前研究共识认为慢性炎症在肿瘤的发生发展中发挥重要作用,参与肿瘤的发生、生长、转移及治疗耐受作用[7]。CAC是导致IBD患者死亡的主要原因之一。与散发性结直肠癌不同,CAC的发病机制中更多依赖肿瘤微环境中的大量炎性因子和免疫细胞。既往研究发现,岩白菜素具有多种抗炎功能,并且通过激活PPAR-γ缓解结肠炎的严重程度,但尚无其对于炎症相关性结肠癌作用的研究[8]。AOM/DSS诱导CAC小鼠模型是目前最常用的肠炎相关结直肠癌动物模型之一,其具有成瘤率高、周期短的优点[9]。本研究使用AOM/DSS诱导CAC小鼠模型,在第13周留取小鼠组织,模型成瘤率100%。本研究显示,与AOM/DSS组比较,岩白菜素治疗组小鼠生存率明显增高,结肠肿瘤数量和负荷明显下降,提示岩白菜素在CAC中具有显著的抑制肿瘤的作用。
当下共识认为,局部促炎微环境通过激活促癌基因在结直肠肿瘤的发病机制中占主导地位。既往研究发现多种促炎因子包括IL-6,IL-17和IL-23的高表达与结直肠肿瘤的不良预后密切相关[10]。以IL-6为主的多种促炎因子通过激活致癌转录因子STAT3促进肿瘤细胞的增殖、存活。研究证实,阻断IL-6-STAT3通路能够有效抑制多种肿瘤细胞的生长,包括结直肠肿瘤、皮肤肿瘤等[11]。本研究结果显示,岩白菜素治疗能够显著降低结肠中IL-6,IL-17和IL-23等促炎因子mRNA表达,同时能够抑制STAT3磷酸化,提示岩白菜素在CAC模型中可能通过拮抗IL-6-STAT3信号通路抑制肿瘤生长。
肿瘤微环境是肿瘤细胞赖以生存和发展的内环境,近年来肿瘤微环境中的免疫细胞和其他细胞或因子的相互作用逐渐被人们所认识。其中,CD8+T细胞是肿瘤微环境中公认的抗肿瘤免疫细胞,其能够通过释放γ-干扰素、穿孔素和颗粒酶B等肿瘤毒性细胞因子达到杀死肿瘤细胞的作用[12]。本研究显示,岩白菜素治疗后CAC模型小鼠结肠中CD8+T细胞升高,表明岩白菜素的抗癌作用依赖其对于肿瘤微环境的影响。TAM是肿瘤微环境中含量最多的免疫细胞,其在肿瘤的发生发展中通过促进肿瘤细胞的增殖、侵袭和迁移,促进血管生成起重要作用[13]。同时,TAM的浸润能够降低抗肿瘤药物敏感性。本研究显示,岩白菜素能够显著降低CAC模型结肠肿瘤中的TAM细胞,对癌旁组织无显著影响,提示岩白菜素可能通过抑制TAM调节肿瘤微环境抑制肿瘤生长。

