丛毛单胞菌对邻甲酚及对甲酚的降解特性*
张立志 余思彤 袁 欣 王 钰 宋兆健 包永明 张旭旺
(大连理工大学海洋科学与技术学院,辽宁 盘锦 124221)
随着工业化进程的推进,我国对煤炭资源的消耗日益严重,产生了大量含有油、酚、氨等污染物的工业废水[1-3]。污水处理厂进水中的酚类物质可达300~800 mg/L[4]296。酚类废水中,以苯酚和甲酚造成的污染最严重。其中,邻甲酚和对甲酚同属于甲酚同分异构体,在日常生活中应用广泛。这两种同分异构体具有强烈的腐蚀性及毒性,被美国环境保护署列入环境优先控制污染物的黑名单,同时也是我国重点控制污染物之一[5]。
生物法因处理效率高、操作简单、成本低廉而受到广泛关注。BAYLY等[6]开展了利用假单胞菌(Pseudomonassp.)菌株突变体降解苯酚和甲酚的研究。RIHAM等[7]研究了固定在聚乙烯醇凝胶中的恶臭假单胞菌(Pseudomonasputida)降解对甲酚的能力,结果表明,对甲酚为200 mg/L时降解效果最佳。ELENI等[8]发现,嗜碱菌小球藻(Advenella)LVX-4在对甲酚为750 mg/L的高浓度条件下也具有降解对甲酚的能力。目前,已有较多关于甲酚降解菌特性的研究,已报道菌株资源还包括蜡状芽孢杆菌(Bacilluscereus)[9]、泛影杆菌(Diaphorobacter)[10]、农杆菌(Citrobacterfarmeri)[11]等;关于丛毛单胞菌(Comamonassp.)对甲酚降解的研究较少,大多是对染料废水、聚-β-羟丁酸(PHB)、氨氮、苯、苯酚及喹啉等污染物的去除[12-13]。甲酚好氧生物降解路径主要有两种:一种为龙胆酸途径[14]531-532;另一种为儿茶酚途径[15]373-376。两者均需在双加氧酶的作用下使苯环断裂,进而进入下游代谢。
本课题组自大连某污水处理厂活性污泥中分离出一株可降解喹啉的Comamonassp. Z1(以下简写为Z1),研究发现,Z1能降解邻甲酚与对甲酚。因此,设计实验考察其对邻甲酚和对甲酚的降解特性及路径。本研究在丰富可降解甲酚生物资源的同时,也可为实际含酚废水的生物处理提供理论依据。
1 材料和方法
1.1 实验菌株
Z1的16S rRNA基因序列的GenBank号为MF07332[16]。在100 mL的无机盐培养基中,分别加入一定浓度的邻甲酚与对甲酚作为唯一碳源与能源,接种量占5%(体积分数),在pH=7.0、30 ℃、150 r/min下振荡培养24 h。
1.2 培养基
无机盐培养基:Na2HPO4·12H2O 3.28 g/L,KH2PO42 g/L,(NH4)2SO42 g/L,FeCl30.25 mg/L,pH=7.0。
1.3 主要试剂与仪器
邻甲酚、对甲酚、丙酮、乙酸乙酯及各类金属盐等均为分析纯,甲醇为色谱纯。
紫外-可见分光光度计(UH5300,日本HITACHI公司);高效液相色谱(HPLC)仪(LC-2030C 3D,日本岛津公司);四级杆轨道离子阱高分辨质谱(MS)仪(Q Exactive,美国Thermo Fisher公司)。
1.4 生物降解实验
与微生物去除污染物这一过程密切相关的环境因素包括底物浓度、pH、金属离子、温度及溶氧量等。实验选择对生物去除底物影响较大且考察较普遍的环境因素进行研究,包括底物浓度、pH、金属离子。在已有关于Comamonassp.的研究报道中,其在29~35 ℃培养时,PHB的降解效果最好[17]。固定化水生丛毛单胞菌(Comamonasaquatica)LNL3降解氨氮的最适温度为30 ℃[18]。Comamonassp. JB降解苯、甲苯、二甲苯的实验,睾丸酮丛毛单胞菌(Comamonastestosteroni)ZD4-1降解苯酚的实验均以30 ℃为最适培养条件[19-20]。文献报道中以振荡培养的方式提供生物降解活动中需要的氧。因此,本研究也选择在30 ℃下振荡培养。
未特别说明,实验条件一般为:在装有25 mL无机盐培养基的锥形瓶中分别加入50 mg/L邻甲酚或100 mg/L对甲酚,不额外增加金属离子,在接种量5%、pH=7.0、30 ℃、150 r/min下振荡培养,定时取样监测Z1的生长情况及残留的邻甲酚或对甲酚浓度。
(1) 底物浓度影响:分别加入25~125 mg/L邻甲酚或25~300 mg/L对甲酚。
(2) pH影响:设置pH为5.0~9.0。
(3) 金属离子影响:选择环境中常见的金属离子(Zn2+、Cu2+、Mg2+、Ni2+、Mn2+、Co2+、Cd2+),均以0.5 mmol/L加入无机盐培养基中。
1.5 分析方法
(1) 菌株生长情况以660 nm下的吸光度表示,以紫外-可见分光光度计测定。邻甲酚与对甲酚的残留浓度采用HPLC分析,降解中间产物的鉴定采用HPLC/MS分析。
(2) HPLC分析:间隔一段时间,取反应液加入适量乙酸乙酯,振荡萃取10 min,取1.5 mL上清液过0.45 μm有机滤膜后进行HPLC分析。HPLC条件:Hypersil ODS2色谱柱(4.6 mm×250 mm×5 μm),流速1.0 mL/min,进样量5 μL,流动相为水/甲醇。梯度洗脱:0~15 min,40%(体积分数,下同)~80%甲醇;15~20 min,40%甲醇。
(3) HPLC/MS分析:选取菌株对数生长中期与末期,间隔一段时间,取反应液加入适量乙酸乙酯,振荡萃取10 min,取5 mL上清液,用氮吹至1 mL,经0.45 μm有机滤膜过滤后进行HPLC/MS分析。HPLC条件:流速0.5 mL/min,进样量10 μL,柱温40 ℃。梯度洗脱:0~1.0 min,5%~95%甲醇;1.0~7.0 min,95%甲醇;7.0~7.1 min,5%甲醇;7.1~8.0 min,5%甲醇。MS条件:采用电喷雾离子源,雾化室温度320 ℃,以氮气为保护气和干燥气,进行正、负模式扫描。
2 结果与讨论
2.1 底物浓度对Z1降解邻甲酚与对甲酚的影响
煤化工废水中可能含有多种酚类化合物,且因其具有生物毒性而对微生物的生长及代谢产生影响。实验探究了不同质量浓度邻甲酚与对甲酚对Z1的生长及其降解的影响,结果见图1。Z1可利用邻甲酚与对甲酚作为唯一碳源进行生长,36 h内能将25~75 mg/L邻甲酚、25~200 mg/L对甲酚完全降解。当邻甲酚为25~100 mg/L时,Z1最大生长量随着质量浓度的增大而提高。25 mg/L时Z1生长延滞期较短,其他浓度条件下延滞期均达12 h。随邻甲酚浓度的增大,Z1完全降解所需时间延长。25 mg/L时24 h可完全降解,125 mg/L时需48 h才能实现完全降解。与邻甲酚相比,Z1对对甲酚的耐受性更高。Z1在对甲酚为25~200 mg/L时表现出良好的降解性能,均可在36 h内完全降解。当对甲酚提高到300 mg/L时,Z1的生长受到明显抑制,但36 h内仍可降解43.46%的对甲酚。从石化污水处理厂的活性污泥中分离出的邻甲酚高效降解菌Pseudomonassp. JF2,可在20 h内将600 mg/L邻甲酚完全去除[21]266。在小球藻(Chlorellavulgaris)处理煤气化废水的研究中,其降解对甲酚的耐受质量浓度高达400 mg/L[4]300。从石油炼制废水中分离出的菌株芽孢杆菌(Bacillussp.)DBK4能在约2 d内将500 mg/L对甲酚完全降解[22]3。与它们相比,Z1对邻甲酚与对甲酚的耐受性相对偏低,但仍可作为酚类废水处理的有效候选菌株。

图1 Z1的生长及其对不同质量浓度邻甲酚与对甲酚的降解Fig.1 Growth of Z1 and degradation of o-cresol and p-cresol under different mass concentrations
2.2 pH对Z1降解邻甲酚与对甲酚的影响
参与生化降解反应的酶活易受环境pH影响。实验探究了不同pH对Z1生长及降解邻甲酚与对甲酚的影响,结果见图2。Z1以邻甲酚为碳源,当pH为5.0~8.0时,Z1生长延滞期较短(6 h);当pH为9.0时,Z1生长延滞期延长至30 h,且生长抑制明显。当pH为5.0、6.0时,Z1对邻甲酚的降解周期延长;当pH为7.0~9.0时,邻甲酚降解相对较快,pH为8.0时Z1可在24 h内将50 mg/L的邻甲酚快速降解。Z1以对甲酚为碳源,当pH为5.0时,Z1生长延滞期最长,可达12 h。当pH为6.0~9.0时,Z1可在24 h内将100 mg/L对甲酚降解完全;当pH为5.0时,降解受到严重抑制,虽仍能在36 h内完成降解,但降解周期相对较长。前期研究发现,印度胶质瘤(Gliomastixindicus)MTCC 3869降解对甲酚的最适pH为6.0[23],Bacillussp. DBK4降解对甲酚的最适pH为7.0[22]4,Pseudomonassp. JF2降解邻甲酚的最适pH为7.0~8.0[21]267。与之相比,本研究中Z1则可在pH为8.0时,分别将50 mg/L邻甲酚或100 mg/L对甲酚快速降解。

图2 不同pH下Z1的生长及其对邻甲酚与对甲酚的降解Fig.2 Growth of Z1 and degradation of o-cresol and p-cresol under different pH
2.3 金属离子对Z1降解邻甲酚与对甲酚的影响
废水中通常会含有Cu2+、Ni2+、Cd2+等金属离子,它们可能对微生物酶活性产生影响,从而影响微生物的生长及其生化降解过程[24]1035-1036。课题组在前期研究中发现,0.1~1.0 mmol/L不同金属离子对菌株生物降解过程的影响较显著[25-26]。已有关于不同金属离子对Comamonassp.生物合成及酶活影响的研究,如Comamonassp. IDO2合成靛蓝的特性研究中,考察0.5 mmol/L不同金属离子对其合成靛蓝的影响,结果表明,Ba2+和Ca2+对靛蓝的合成有明显的促进作用,Mg2+几乎无影响,而Cu2+、Mn2+、Ni2+、Zn2+的抑制效果最明显[27];Comamonassp. UVS胞内藜芦醇氧化酶的纯化与表征及其在纺织染料脱色中的作用研究结果表明,该酶活被0.5 mmol/L的Cu2+、Zn2+、Hg2+和Cd2+分别抑制了85%、65%、48%、35%[28]。结合文献,本研究选择0.5 mmol/L作为实验条件,结果如图3所示。降解过程中,Co2+、Ni2+、Cu2+对Z1生长、底物降解抑制作用明显,Zn2+、Mn2+、Cd2+也对Z1生长、底物降解有一定的抑制作用,而Mg2+对Z1生长、底物降解产生促进作用。研究表明,Mg2+对许多生物过程具有显著影响,并且在激活酶、调节代谢和稳定核苷酸结构方面具有不可或缺性[29]。Co2+、Ni2+、Cu2+等金属离子的加入,使甲酚类降解周期延长,这可能与金属离子能与酶的巯基结合使酶失活相关[24]1035-1036。
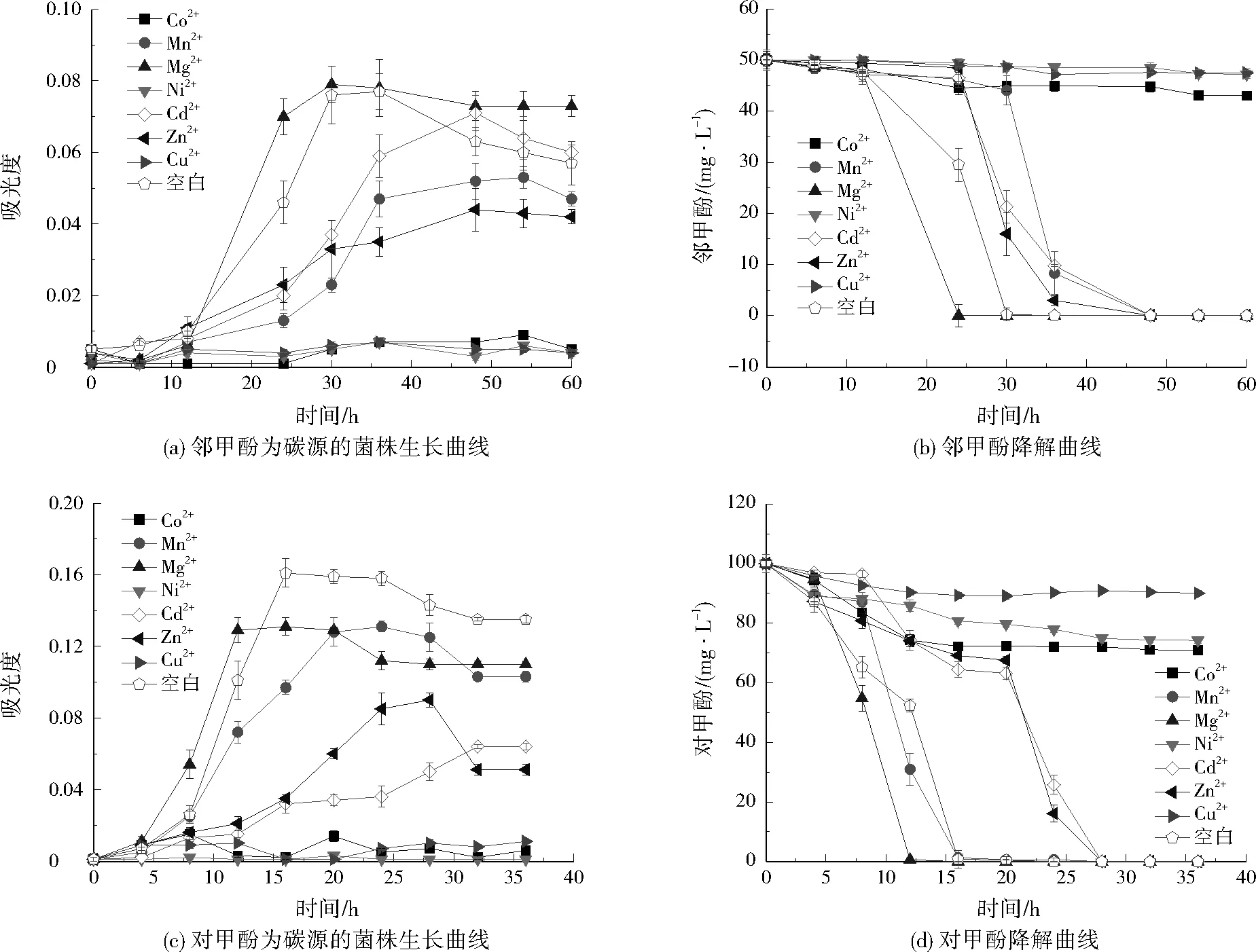
图3 不同金属离子对Z1生长及其对邻甲酚与对甲酚降解的影响Fig.3 Growth of Z1 and the effect on the degradation of o-cresol and p-cresol by different metal ions
2.4 降解产物分析
利用HPLC/MS对Z1降解邻甲酚的产物进行分析,检测到5种中间产物,分别为2-羟基苯甲醇(质荷比(m/z)=123.045 15)、2-羟基苯甲醛(m/z=121.029 50)、2-羟基苯甲酸(m/z=137.024 42)、2-羟基-6-酮庚-2,4-二烯酸(m/z=155.034 98)和2-羰基-4-烯戊酸(m/z=114.032 24)。在AHAMAD等[15]373-376所开展的利用Pseudomonassp. CP4降解邻甲酚的研究中,核磁共振氢谱分析也检测出2-羟基-6-酮庚-2,4-二烯酸和2-羰基-4-烯戊酸这两种中间产物。
对甲酚的降解过程中检测到4种中间产物,分别为4-羟基苯甲醇(m/z=123.04 515)、4-羟基苯甲醛(m/z=121.029 50)、4-羟基苯甲酸(m/z=137.024 42)和龙胆酸(m/z=153.019 33)。这几种中间产物在Bacillussp. PHN1降解对甲酚的过程中均被检测到[14]531-532。
2.5 降解路径分析
通常,邻甲酚首先被氧化生成3-甲基儿茶酚或4-甲基间苯二酚,然后进入儿茶酚降解途径进一步被降解[15]371-373。而微生物则可通过两种途径降解对甲酚:(1)通过与邻甲酚降解类似的苯环羟化过程,形成4-甲基儿茶酚,然后经儿茶酚途径进入下游代谢[30];(2)首先攻击甲基,然后甲基被氧化成羧基,生成龙胆酸,进入龙胆酸降解途径[31]4-5。
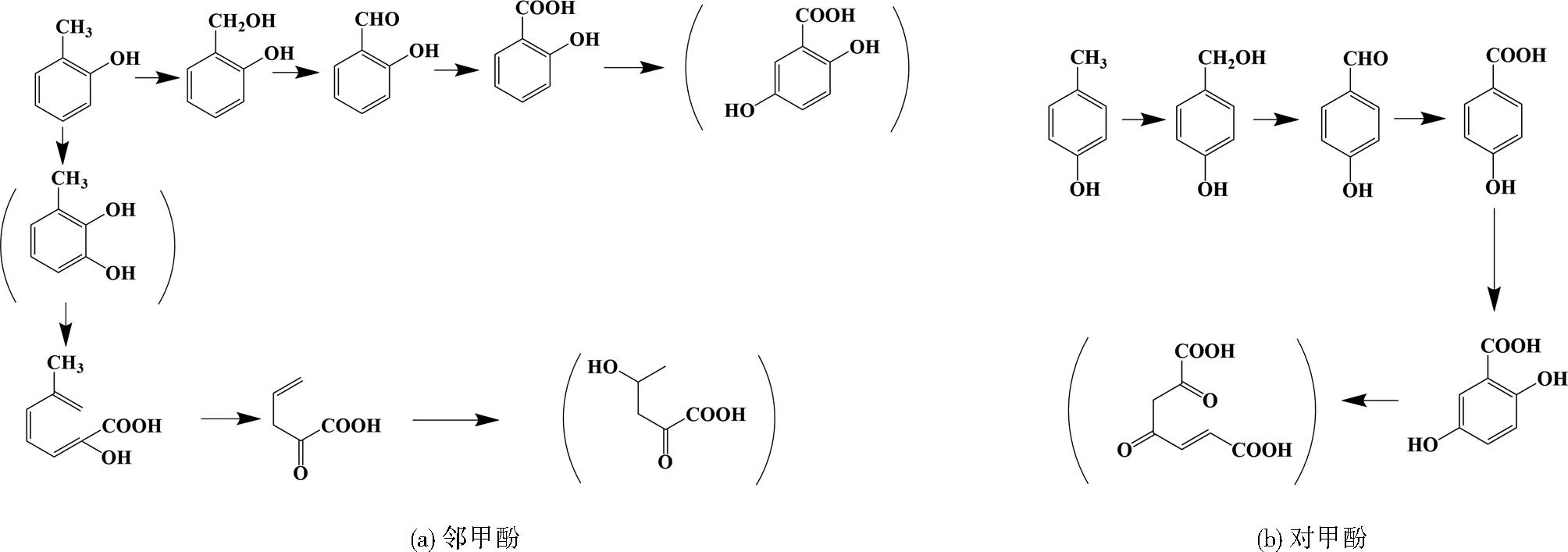
注:括号内物质表示实际未检测到而推测的物质。图4 Z1对邻甲酚与对甲酚的降解路径推测Fig.4 Possible pathways for the degradation of o-cresol and p-cresol by Z1
根据HPLC/MS分析结果,结合文献推测Z1降解邻甲酚可能存在两种途径(见图4(a)):(1)邻甲酚首先通过甲基位的羟化及羧化过程,依次被氧化为2-羟基苯甲醇、2-羟基苯甲醛及2-羟基苯甲酸(水杨酸),因降解方式与已知降解模式类似,所以猜测随后进入龙胆酸降解途径[31]4-5。(2)邻甲酚首先被氧化生成3-甲基邻苯二酚,随后进入儿茶酚降解途径,即经间位开环依次形成2-羟基-6-酮庚-2,4-二烯酸和2-羰基-4-烯戊酸,然后进一步被降解,最终矿化。这一途径与Pseudomonassp. CP4降解邻甲酚的过程相同[15]373-376。因此,推断Z1能利用龙胆酸与儿茶酚途径降解邻甲酚。
Z1降解对甲酚可能途径(见图4(b)):对甲酚首先被氧化生成4-羟基苯甲醇,而后经脱氢、氧化形成4-羟基苯甲醛、4-羟基苯甲酸、龙胆酸,最后进入龙胆酸降解途径。该路径与Bacillussp. PHN1降解对甲酚的过程相同[14]531-532,所以Z1通过龙胆酸途径降解对甲酚。
3 结 论
(1) Z1可利用邻甲酚与对甲酚作为唯一碳源进行生长,36 h内能将25~75 mg /L邻甲酚、25~200 mg/L对甲酚完全降解。
(2) Z1可在pH为8.0时将50 mg/L邻甲酚或100 mg/L对甲酚快速降解。
(3) Mg2+对Z1生长、底物降解产生促进作用,Co2+、Ni2+、Cu2+等金属离子则具有抑制作用。
(4) 推断Z1能利用龙胆酸与儿茶酚途径降解邻甲酚,通过龙胆酸途径降解对甲酚。

