定喘汤对哮喘模型小鼠肺组织炎性因子及NLRP3炎症小体的影响
李 江 颜延凤
支气管哮喘(哮喘)是呼吸内科常见的慢性非感染性气道炎症,发生机制常与变态反应有关,其病变特征为嗜酸性粒细胞和2型辅助型T细胞(T helper cell type 2,Th2)因子(包括白细胞介素3、4、5)产生增加,促进免疫球蛋白E(IgE)形成,导致Th2细胞和嗜酸性粒细胞发育、成熟和激活,引起气道高反应性、黏液产生和气道重塑[1]。中药汤剂定喘汤对轻、中、重度哮喘均有显著疗效,但机制尚不明确[2]。有研究显示,定喘汤能抑制炎症细胞在气道黏膜及周围组织浸润,抑制气道重塑[3]。
Nod样受体蛋白3(Nod-like receptor protein3,NLRP3)在Nod受体蛋白家族中较为独特,与其他Nod受体蛋白启动条件较为单一不同,它存在多种激活方式,参与影响多种疾病,具体激活机制尚未明确。有文献记载,NLRP3与多种肺部疾病发生和发展有密切关系,NLRP3的下游产物IL-1β能促IL-17分化及炎症细胞聚集,在哮喘的疾病进程中起重要作用[4]。本实验制备小鼠哮喘模型,通过检测其不同时期NLRP3的蛋白表达水平及相关产物(IL-1β,IL-17)含量的变化,同时观察气道黏膜及周围组织的形态,研究定喘汤能否有效抑制NLRP3及相关产物,肺组织炎症及气道重塑,探讨定喘汤治疗哮喘的作用机制。
1 材料与方法
1.1 材料
1.1.1 主要仪器石蜡包埋及切片机(德国Leica公司);正置显微镜(德国Leica公司);Image-Pro Plus 6.0图像分析系统(美国Media Cybernetics公司); 蛋白电泳仪及电泳槽(美国Bio-RAD公司),BIO-RAD ChemiDoc XRS+成像系统(美国BIO-RAD公司)。
1.1.2 主要试剂卵清蛋白(OVA,grade Ⅴ,美国Sigma公司),明矾佐剂(Imject Alum,美国Pierce公司),内毒素(LPS,美国Sigma 公司);细胞因子IL-1β、 IL-4、IL-17检测试剂盒(南京建成生物科技有限公司);免疫组化抗体rabbit anti-NLRP-3(上海Abways公司), rabbit anti-caspase-1(美国Proteintech公司),Elite ABC Kit(美国Vector 公司);蛋白电泳(western blot)抗体NLRP-3(上海Abways公司),caspase-1(美国Proteintech公司),IL-1β抗体(英国Abcam公司),多克隆兔抗β-actin抗体(美国Bioworld公司)。
1.1.3 主要药物定喘汤(Dingchuantang,DCT)由南京市中西医结合医院自制,根据《扶寿精方·痰门》制作定喘汤浓缩汤剂,处方组成:白果(去壳炒黄)9 g,麻黄9 g,紫苏子6 g,甘草3 g,款冬花9 g,杏仁9 g,桑白皮9 g,黄芩6 g,法半夏9 g(饮片来源:南京鹤龄药事服务有限公司)。按处方精确称取药材饮片,每次加水500 ml,浸泡30 min,煎煮1 h,煎煮2次,合并煎液,用8层纱布过滤汤液,浓缩至48 ml,配置成生药,浓度为1.43 g/ml的母液,装于无菌瓶中,存放至4 ℃冰箱,供小鼠灌胃给药。按体表面积换算公式计算得定喘汤小鼠灌胃剂量为9 g/kg。
1.2 方法
1.2.1 实验动物及分组本实验采用2月龄BALB/c小鼠(雌雄不拘)48只,均由南京医科大学动物实验中心提供,动物饲养、管理及使用均严格按照《南京医科大学实验动物管理规范》的要求进行,动物号SCXK(苏)2016-0002。将小鼠按体质量随机分为4组,分别为哮喘治疗组(OVA+DCT),哮喘观察组(OVA+NS),定喘汤对照组(NS+DCT),空白组(NS+NS),每组12只。
1.2.2 建模及给药OVA+DCT组及OVA+NS组小鼠在实验的第0、7天,用20 μg OVA溶于100 μl明矾佐剂腹腔注射,在第28、29、30天取100 μg LPS溶于40 μg生理盐水滴鼻,第31~37天,5% OVA溶液(1 g OVA溶解于20 ml生理盐水中)每日雾化吸入30 min,复制中性粒细胞为主的哮喘小鼠模型, NS+DCT组及NS+NS组同时间采用等量生理盐水替代[5]。OVA+DCT组及NS+DCT组在第31天至第37天,采用定喘汤灌胃液1 ml灌胃(用9 ml定喘汤母液与20 ml生理盐水混合,配置定喘汤灌胃液,用量为20 ml/kg,每只小鼠1 ml, 2 h内分3次灌注,注意防呛咳),每天1次;OVA+NS组及NS+NS组小鼠以生理盐水1 ml进行灌胃。
1.2.3 BALF中IL-1β、IL-4、IL-17水平检测末次灌胃结束24 h后,每组取6只动物,采用3%戊巴比妥钠(4 mg/100 g体质量)麻醉固定后,采集肺泡灌洗液(BALF),4 ℃,1500 r/min离心5 min,收集上清,采用ELISA试剂盒,具体步骤按检测试剂盒说明书操作。在酶标仪波长450 nm上读取吸光度值,通过标准曲线换算成相应浓度,检测BALF中IL-1β、IL-4、IL-17的表达。
1.2.4 肺组织NLRP3和caspase-1表达的免疫组化检测另取每组6只动物,取左肺中叶4%多聚甲醛固定、酒精梯度脱水、石蜡包埋切片(片厚5 μm)保存。采用ABC法:切片经脱蜡、水化,煮沸法行抗原修复后,一抗rabbit anti-Caspase-1(1:200);rabbit anti-NLRP3(1:200)4 ℃孵育过夜;生物素标记的羊抗兔IgG(1:200)室温孵育1 h, 滴加Elite ABC混合液室温孵育30 min,DAB底物室温5 min显色,常规梯度酒精脱水,二甲苯透明,中性树胶封片。镜下观察摄片,采用Image Pro Plus6.0半定量分析单位面积内NLRP3及caspase-1的积分光密度(IOD)值[6]。
1.2.5 western blot检测取左肺下叶称重,20 mg加入100 μl蛋白裂解液在匀浆器中研磨(全程冰上操作),13000 rpm,15 min,4 ℃离心。吸取上清,采用BCA方法进行蛋白定量。进行SDS-PAGE 电泳、转膜5%脱脂奶中室温封闭1 h。用封闭液稀释好NLRP-3抗体(1∶1000)、Caspase-1抗体(1∶2000)和IL-1β抗体(1∶2000)封入薄膜中,室温震摇过夜。PBST洗膜,10 min/次,3~4次。加入封闭液配制的二抗羊抗兔 (1∶2000)与膜一起封入薄膜中,室温摇床60 min。PBST洗膜,10 min/次,3~4次。现配显影液,均匀洒于膜上,成像。采用灰度分析软件Image Pro Plus 6.0软件分析、计算各蛋白条带的光密度值。
1.3 统计学方法采用SPSS 21.0统计软件进行数据分析,定性资料采用χ2检验,半定量数据采用非参数检验,定量资料采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 各组小鼠BALF中IL-1β、IL-4、IL-17比较BALF中,NS+NS组与NS+DCT组各炎症因子无显著差异。与NS+NS组相比,OVA+NS组与OVA+DCT组中IL-1β、IL-4和IL-17的表达均上升(P<0.05)。OVA+NS组与OVA+DCT组相比,OVA+DCT组中IL-1β(P<0.01)、IL-4(P<0.05)和IL-17(P<0.001)含量均显著下降。见表1,图1。
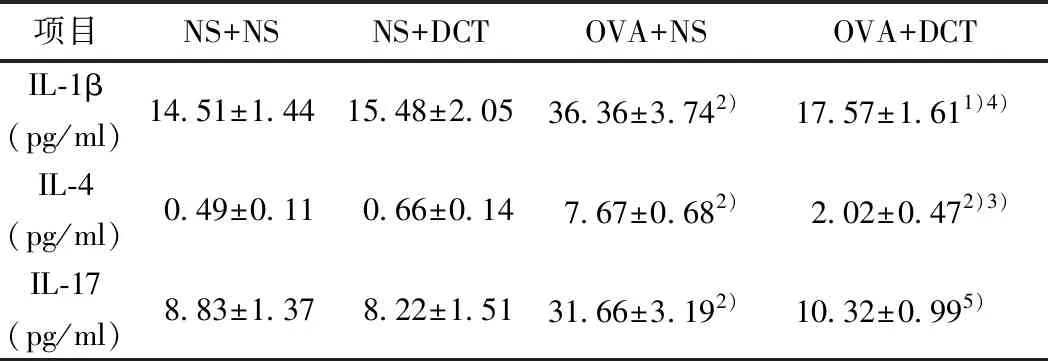
表1 肺泡灌洗液(BALF)中不同组动物炎性因子的含量
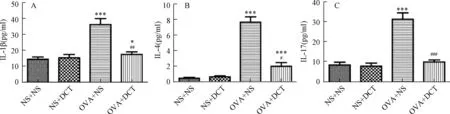
图1 肺泡灌洗液(BALF)中不同组动物炎性因子的含量
2.2 各组小鼠肺组织免疫组化比较NLRP3及caspase-1结果显示:NS+NS组与NS+DCT组小鼠气道上皮基本完整,无明显炎性因子浸润,积分光密度值(IOD)组间无显著差异(P>0.05,图2A-D)。与NS+NS组相比,OVA+NS组与OVA+DCT组小鼠气道上皮缺损,周围可见炎性因子浸润;2组NLRP3、caspase-1的IOD均显著升高(P<0.001),而相对较OVA+NS组,OVA+DCT组NLRP3的IOD显著降低(P<0.01),caspase-1的IOD也显著降低(P<0.001)(图2 A-D)。

注:A NLRP-3免疫组化;B caspase-1 免疫组化; C NLRP-3积分光密度值;D caspase-1积分光密度值图2 不同组炎性小体相关指标改变
2.3 各组小鼠肺组织内NLRP-3、caspase-1、IL-1β及β-actin表达比较Western blot 结果显示:与NS+NS组相比,OVA+NS组的IL-1β、NLRP3、caspase-1的蛋白表达均上调;相较于OVA+NS组,OVA+DCT组中IL-1β、NLRP3、caspase-1的蛋白表达均下调。见图3。
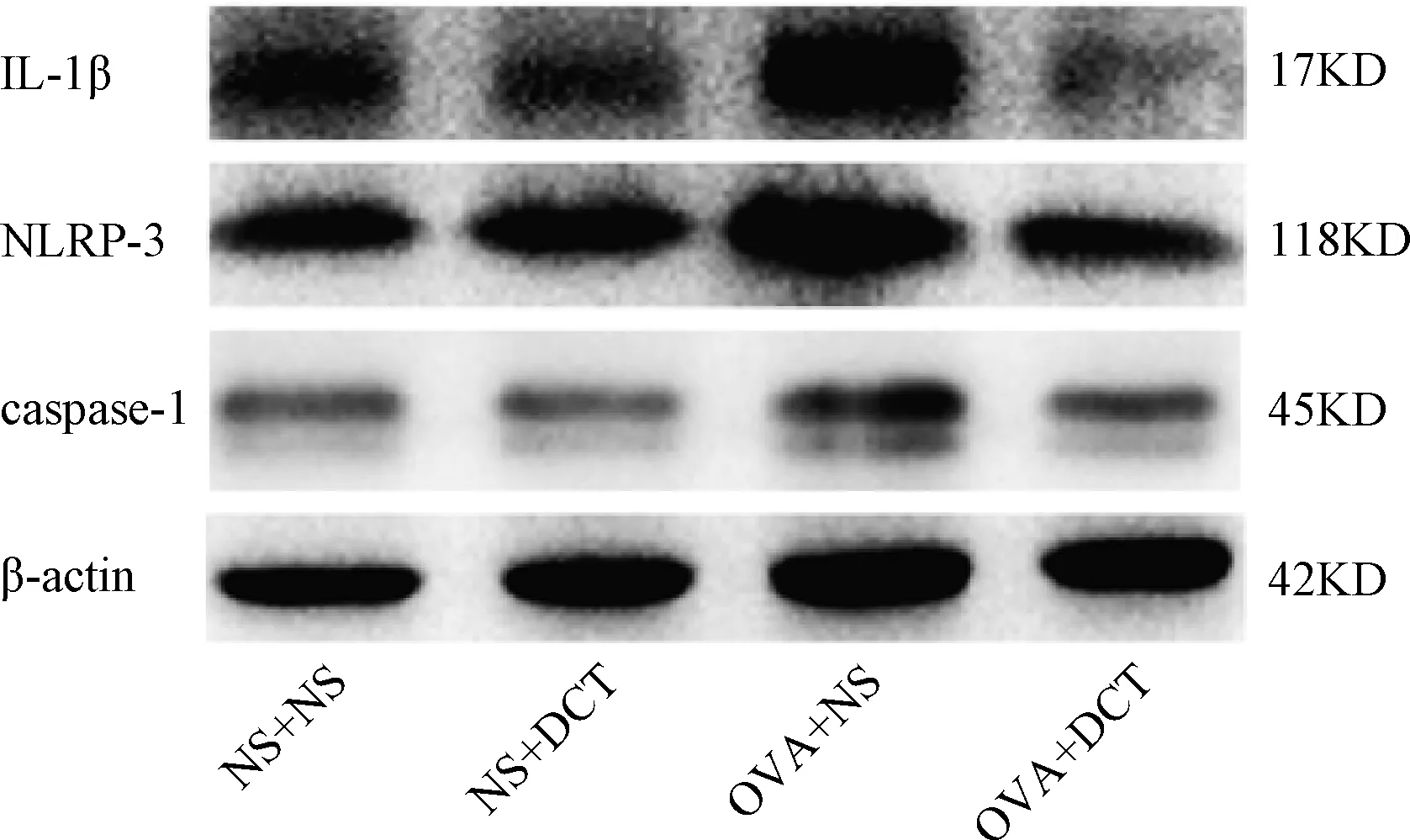
图3 IL-1β, NLRP-3, caspase-1的蛋白表达变化
3 讨论
哮喘属于中医学“哮病”范畴。患者因先天禀赋不足、疾病迁延、体虚失养或接触异物,致气血津液失司,痰宿于肺。每外邪束肺,阳气郁内,易化痰热,故应祛邪宣肺,化痰清热。定喘汤最早出自《扶寿精方·痰门》,治疗热哮效果显著,后在不同地区不同时代医家均有相似验方记载。定喘汤由白果、麻黄、紫苏子、甘草、款冬花、杏仁、桑白皮、黄芩及半夏组成,此方集辛、涩、苦、甘四味,合宣、降、清三法[7],邪去郁解,气畅痰消。临床研究表明定喘汤治疗不同程度哮喘均有疗效[2],本课题组前期研究表明,定喘汤能降低Th2细胞转录因子GATA-3,抑制Th2细胞亚群表达,从而扭转Th1/Th2细胞亚群失衡[8]。传统Th1/Th2平衡学说对哮喘机制解释尚有不足,Th1/Th2失衡造成嗜酸性粒细胞聚集性哮喘,但对以中性粒细胞为主的重症哮喘,难治性哮喘难以很好解释。近期研究发现Th17也参与了哮喘发病过程, Th17/Th2失衡与中性粒细胞哮喘、重症哮喘及难治性哮喘有密切联系[9,10]。
正常生理条件下,NLRP3在细胞质内处于自我抑制状态,为出现可被识别的微生物结构单元或病原相关分子模式或损伤相关分子时,NLRP3能够招募凋亡相关斑点样蛋白(ASC)和半胱天冬酶(caspase)-1组成的多蛋白复合物形成NLRP3炎症小体。活化的炎症小体可大量分泌IL-1β、IL-8及Caspase-1[11]。IL-1β可以与IL-6和趋化因子招募中性粒细胞,促进Th17淋巴细胞分化,进而增加IL-17,IL-22的分泌[12],在哮喘过程中起到重要作用,进而提示NLRP3炎症小体可能与哮喘病情严重程度正相关。
BALB/c小鼠具有遗传基因单纯,个体差异较小,价格较低,饲养场地适中,又有较好的炎症、免疫反应等优点[13],OVA联合LPS具备更强的免疫原性和抗原性,本研究采用OVA联合LPS致敏BALB/c小鼠作为评价模型。OVA联合LPS致敏的OVA+NS组及OVA+DCT组与NS+NS组及NS+DCT相比,小鼠肺组织炎性指数显著上升,肺泡周围出现大量炎性因子聚集,BLAF中IL-1β、IL-4、IL-17含量显著上升,上述结果说明OVA-LPS-OVA小鼠造模成功,并且出现Th17/Th2失衡。定喘汤干预治疗的OVA+DCT组BLAF中炎性因子IL-1β、NLRP3、caspase-1的蛋白表达较生理盐水干预的OVA+DCT组均下降。同时,NS+NS组与NS+DCT组小鼠在BLAF中炎性因子水平、肺组织中蛋白水平均无显著差异,表明定喘汤对于正常生理状态下小鼠肺组织炎症及相关因子无影响。本实验结果提示定喘汤能抑制NLRP3炎症小体,降低IL-1β、IL-17含量,减少炎性因子募集,减轻气道及肺组织中炎症反应和提高抗炎作用,改善气道结构反应,缓解哮喘症状。此外,定喘汤可以同步降低IL-4及IL-1β、IL-17的表达,改善Th1/Th2和Th2/Th17平衡,也从侧面解释了临床应用中定喘汤不论对于嗜酸性粒细胞哮喘还是中性粒细胞哮喘等轻、中、重度哮喘均有良好疗效。
本研究主要集中探索成方“定喘汤”对于NLRP3炎症小体及相关炎性因子在肺组织中的机制研究,此外,NLRP3炎症小体异常激活的影响不局限于肺组织,常能引发或加重某些全身性疾病,例如2型糖尿病炎症性肠病和阿尔兹海默病等[15]。后续研究中,我们继续以中医理论整体观念为指导,如肺与大肠相表里等经典论述出发,结合基础科学研究,探讨分析,扩大定喘汤的治疗适应范围,更好地体现中医整体论治的特点。

