高氧铌粉的镁还原降氧工艺
刘芳,李庆奎,罗俊锋,徐国进,张巧霞
高氧铌粉的镁还原降氧工艺
刘芳1, 2,李庆奎1,罗俊锋2,徐国进2,张巧霞2
(1. 郑州大学 河南省资源与材料工业技术研究院,郑州 450001;2. 有研亿金新材料有限公司,北京 102200)
采用真空烧结炉对氧含量为4.1×10−3的工业铌粉进行镁热还原,然后酸洗,以降低铌粉的氧含量。通过研究还原温度、还原时间和镁粉用量对铌粉氧含量的影响,优化铌粉的镁还原降氧工艺。结果表明,在还原温度为1 133 K、镁添加量足够的条件下还原2~6 h,铌粉的氧含量随还原时间延长先降低而后趋于稳定。在镁添加量为理论用量的4倍、还原时间为4 h条件下,随还原温度从953 K升高至1 133 K,脱氧铌粉的氧含量从8.90×10−4下降至3.56×10−4;继续升高还原温度至1 203 K,铌粉的氧含量反而升高。铌粉的最佳镁还原脱氧工艺为还原温度1 133 K、镁用量为理论用量的4倍、还原4 h,脱氧后铌粉的氧含量为3.56×10−4,铌粉形貌基本不变。
高氧铌粉;降氧;镁还原;还原温度;还原时间
铌及铌合金因耐腐蚀、延展性好、密度小、熔点高、比强度高、导电导热能良好、以及热中子俘获截面小等特性,在电子、航空航天、钢铁工业等领域得到广泛应用[1−2]。市场上销售的工业铌粉主要由铌条破碎经氢化脱氢后得到,粉末粒径小,极易吸附氧[3−4]。铌粉中过高的氧含量会严重影响铌的物理性能、力学性能和电性能,制约铌及铌合金的应用。镁热还原降氧具有工艺简单、耗能小且反应产物易分离等优点,降氧的原理主要是镁与铌粉颗粒表面的氧化物发生反应[5−12]。有关利用镁还原Nb2O5粉末制备低氧铌粉的研究已成为热点。ORLOV[13]在1 123 K下利用镁蒸气还原Nb2O5粉末5 h,所得铌粉的氧含量约为8%;KUMAR[14]通过镁蒸汽两步还原法,使铌粉氧含量降至0.65%。OKABE[15]采用预成形还原工艺(preform reduction process)将含有助焊剂和粘合剂的Nb2O5粉末制成板状坯体,在1 073~1 273 K下镁蒸汽还原6 h,得到纯度为99%的铌粉。王兴庆[16]将Nb2O5粉在10 MPa压力下压制成形,然后1 200 ℃烧结12 h制备成Nb2O5阴极片,熔盐电脱氧后得到氧含量较低的铌粉。LIU和NIIYAMA等[17−18]从理论上研究了当铌与Ca-CaO或Mg-MgO共存时,金属铌中氧的平衡浓度与镁蒸汽压的关系。但到目前为止,对于实际工业生产中的高氧铌粉镁还原脱氧的温度、时间和镁添加量等对铌粉氧含量的影响缺少研究,降氧后铌粉氧含量仍然偏高。本文作者利用真空烧结炉,对氧含量为4.1×10−3的工业高氧铌粉进行镁还原降氧,研究镁还原工艺对铌粉氧含量的影响,对于工业生产低氧铌粉具有指导作用。
1 实验
1.1 铌粉的镁还原降氧
本研究用的工业铌粉由宁夏钽业股份有限公司提供,氧含量为4.1×10−3,费氏粒度为9.8 μm,比表面积为0.2 m2/g。
含氧铌粉的镁热还原过程为镁粉和铌颗粒表面的Nb2O5反应生成铌和MgO。由于镁在升温过程中因饱和蒸汽压较大,易挥发损失,且还原气氛及操作过程中不可避免地引入氧,因此,镁需要过量,镁热还原完成后,残留的镁和氧化镁一起通过酸洗和水洗除去。根据前期探索实验,本文选择的镁添加量分别为镁热还原所需理论镁用量的2倍、3倍、4倍、5倍和6倍。例如,15 g铌粉的氧含量大约为0.061 5 g,镁热还原所需镁粉的理论用量为0.615 g,本文选择的镁粉实际添加量分别为1.23,1.845,2.46,3.075和3.69 g)。取15 g铌粉和相应量的镁粉在A4纸上进行折混,混合均匀后,放入石墨坩埚中,在真空烧结炉内氩气气氛下进行还原,之后将HCl,H2O2和HF按一定比例混合成酸洗液,采用适当的固液比、酸洗时间、磁力搅拌速度和酸洗温度对还原后的粉末进行酸洗,然后超声水洗至废液为中性。抽去铌粉表面的水,用无水酒精洗涤2次,使水分快速蒸发,再放在玻璃皿中于真空烘箱内333 K干燥6 h,得到镁热还原降氧后的铌粉。
1.2 性能检测
用AXIS Supra型X射线光电子能谱仪(XPS)对原始高氧铌粉表面氧的存在状态进行分析。采用WLP- 208粒度测定仪测定粉末的粒度。用ONH-3000型氧氮氢含量分析仪测定铌粉中的氧含量。利用日本岛津6100 X射线衍射仪(XRD)对还原粉末进行物相分析。用美国FEI Quant 250 FEG型场发射扫描电镜(SEM)观察粉末的表面形貌。
2 结果与讨论
2.1 脱氧可行性
2.1.1 铌粉表面的化学组成
常温下金属铌在空气中较稳定,加热至573 K以上铌粉开始逐步被氧化。在773 K下铌中的氧含量(质量分数,下同)为0.13%,当温度从1 273 K升高到2 188 K时,氧在铌中的溶解度从0.72 %增大到1.6 %,由此可知氧在铌基体中的溶解度随温度升高而增大。铌粉表面的氧可能以NbO,NbO2和Nb2O5形式存在。为了确定氧的具体存在形式,为铌粉的镁热还原降氧提供理论依据,本研究采用XPS对铌粉表面氧的化学存在状态进行定性分析,结果如图1所示。在图1(b)中结合能为207.35 eV和210.07 eV处出现2个峰,这2个峰分别对应Nb3d5/2和Nb3d3/2,说明铌粉表面有Nb5+存在;在结合能为202.1 eV和204.82 eV处出现2个尖锐的峰,分别对应Nb3d5/2和Nb3d3/2,说明铌粉表面存在单质铌。由图1(c)可知,在结合能530.34 eV和532.14 eV处出现尖锐的峰,531~532.8 eV之间的峰表明铌粉表面有—OH官能团;528.1~531 eV区间的峰表明铌粉表面存在金属氧化物。结合Nb3d和O1s的XPS谱可知,铌粉表面氧的存在形式主要为Nb2O5和—OH,可通过镁与铌粉表面的Nb2O5反应来降低金属铌粉的氧含量。
2.1.2 镁还原降氧热力学
铌粉的镁还原降氧过程为镁与铌粉表面Nb2O5中的氧结合形成氧化镁,之后氧化镁及残余的镁通过酸洗除去。由图1可知,铌粉表面的氧以Nb2O5和—OH形式存在。由分析软件FactSage得到镁与Nb2O5反应的化学方程式及反应吉布斯自由能变Δ如下[19]:
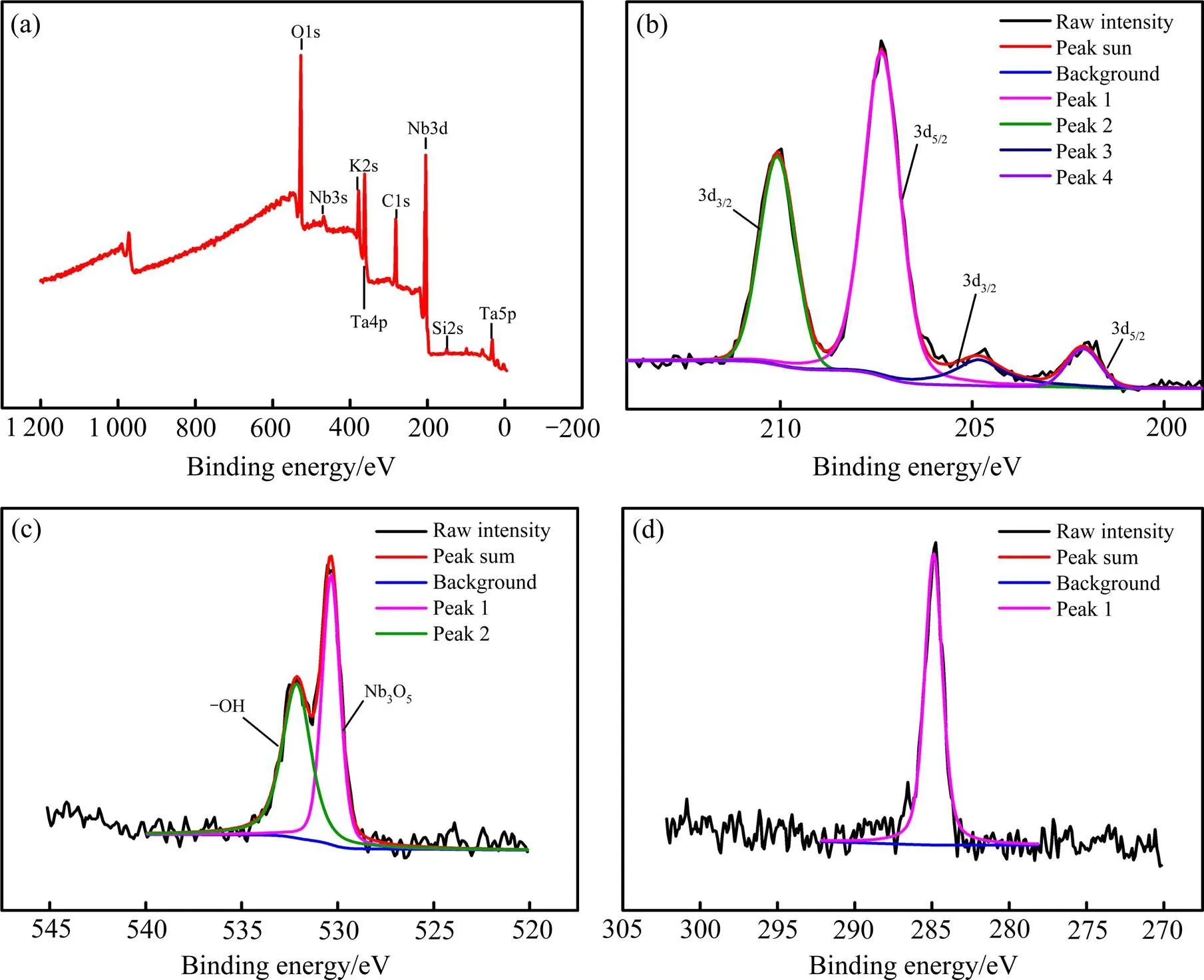
图1 高氧铌粉表面的XPS光谱
(a) Nb full spectrum; (b) Nb3d narrow spectrum; (c) O1s narrow spectrum; (d) C1s narrow spectrum
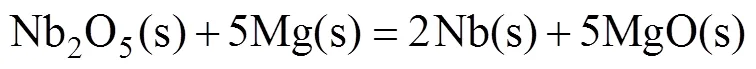
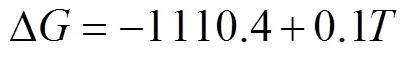
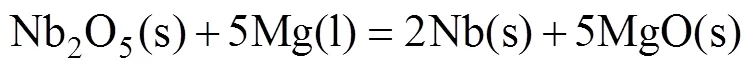
式中:Δ为反应吉布斯自由能变,kJ/mol;为热力学温度,K。在923 K以下,铌粉表面的Nb2O5与固态的镁发生固−固反应;923 K以上发生液−固反应或固−气反应,此时物质扩散速度较快。图2所示为密闭容器内镁饱和蒸汽压随温度的变化[20]。由图可知,当温度大于923 K时,镁的饱和蒸气压迅速增大,此时有大量的镁蒸气生成,可有效促进式(2)所示镁热反应的进行。
计算镁与Nb2O5反应的吉布斯自由能的公式 如下[21]:
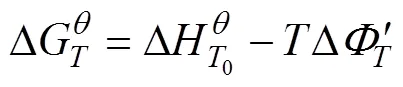
式中:

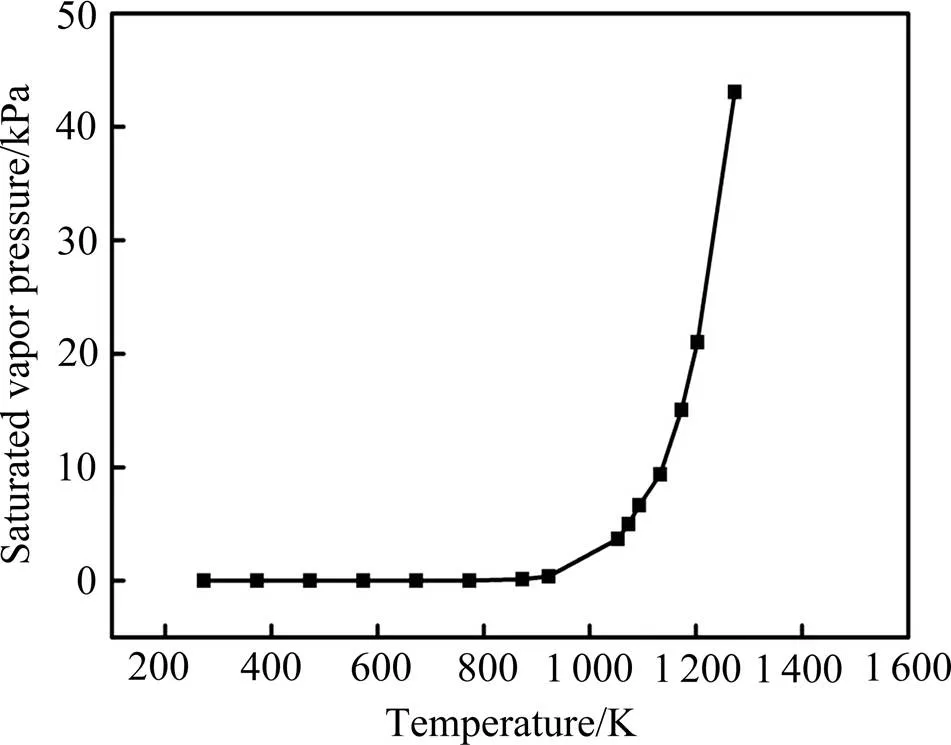
图2 密闭容器内镁饱和蒸汽压随温度的变化[20]

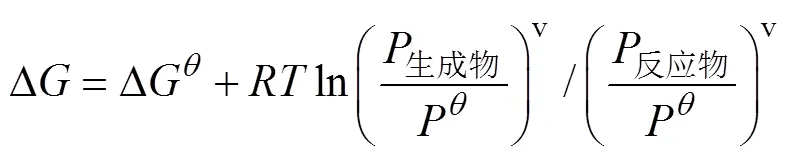
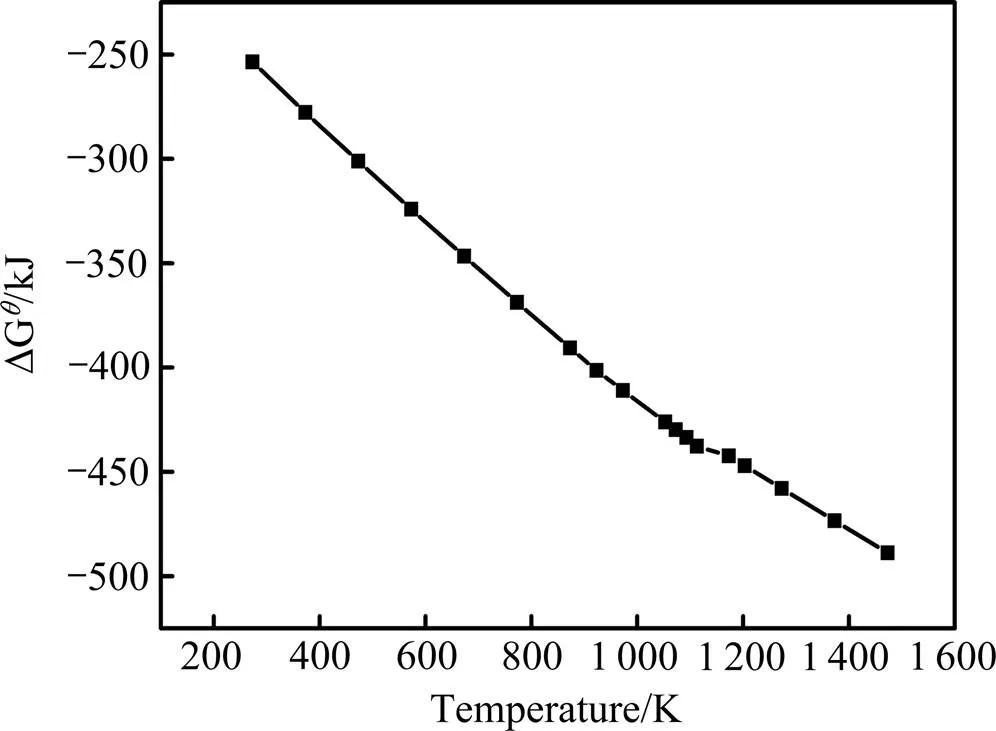
图3 Nb2O5镁热还原反应的ΔGθ-T关系曲线
2.2 镁添加量和还原时间
表1所列为1 133 K下镁添加量和还原时间对脱氧铌粉氧含量的影响。由表1看出,在还原温度1 133 K、还原时间4 h条件下,随镁添加量增加至理论用量的4倍,所得脱氧铌粉的氧含量明显降低。这是因为随镁添加量增多,镁与铌中更多的氧形成氧化镁,镁热还原反应更充分,故酸洗之后铌粉的氧含量明显降低。继续将镁添加量增加至理论用量的5倍和6倍时,铌粉氧含量基本不变,这是因为镁添加量为理论用量的4倍时已足够镁热还原反应的消耗,且过多的镁残留在还原产物中,易出现结块现象。从表1还看出,在镁添加量为理论用量的4倍时,随还原时间从2 h延长至4 h,脱氧铌粉的氧含量从4.45×10−4降低至3.56×10−4,这是因为还原时间越长,镁还原反应越来越充分,粉末表面更多的Nb2O5被还原,因此,氧含量减少;随还原时间进一步延长至6 h,铌粉的氧含量趋于稳定不变,这是因为在还原4 h时铌粉表面的Nb2O5已被充分还原。
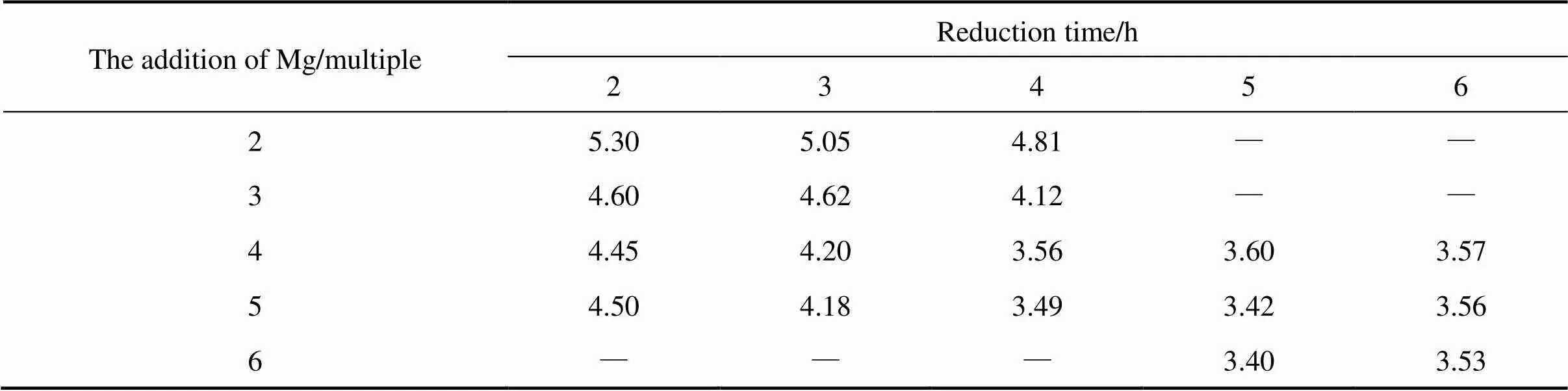
表1 镁用量(理论用量的倍数)与还原时间对脱氧铌粉氧含量的影响
2.3 还原温度
表2所列为在镁粉添加量为理论用量的4倍、还原时间4 h条件下,还原温度对铌粉氧含量的影响。由表2可见,随还原温度从953 K升高到1 133 K,脱氧铌粉的氧含量从8.95×10−4降低至3.56×10−4,这是因为随还原温度升高,镁融化形成镁蒸汽,镁热还原反应速率加快,反应更充分,因而铌粉的脱氧效果更好。但当还原温度升高至1 203 K,脱氧铌粉的氧含量反而略有升高。图4所示为1 203 K镁还原2 h后的铌粉XRD谱,由图4可知在此温度下还原后生成了不溶于任何酸的Mg3NbO11,在后续的酸洗过程中不会被除去。因此,1 203 K还原的铌粉氧含量比1 133 K还原的铌粉氧含量高。综合上述研究结果,得到铌粉的镁还原降氧最佳工艺参数为:还原温度1 133 K,镁粉用量为理论用量的4倍,还原时间4 h。在此工艺条件下得到的铌粉氧含量为3.56×10−4,远低于国内通过氢化脱氢工艺制备低氧铌粉工业水平的1.0×10−3~ 2.5×10−3,显著降低了工业铌粉的氧含量。

表2 还原温度对脱氧铌粉氧含量的影响(还原4 h)
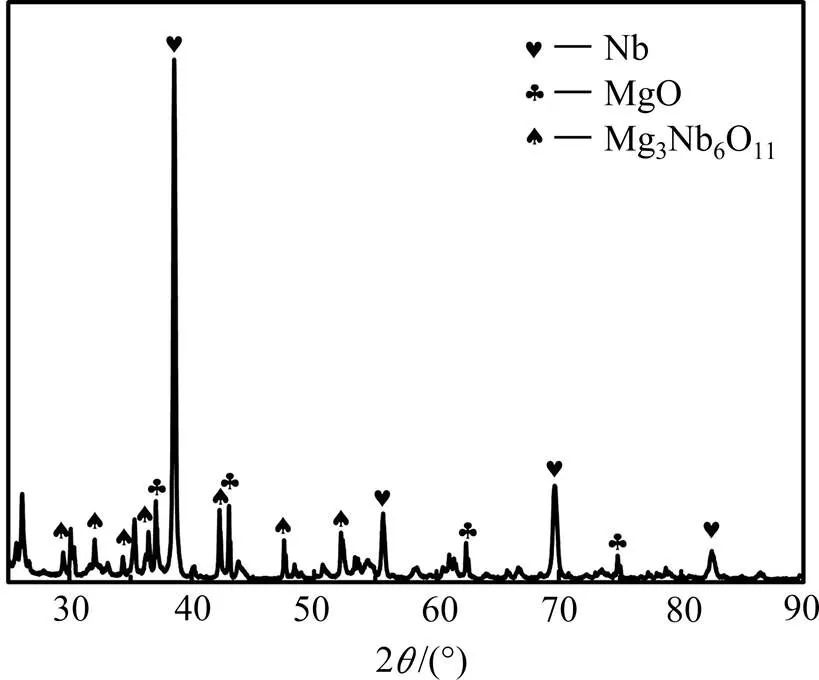
图4 铌粉在1 203 K镁还原2 h后的XRD谱
2.4 物相组成与形貌
图5所示为在4倍的理论镁添加量、还原温度和还原时间分别为1 133 K和4 h的最佳还原工艺条件下镁还原及酸洗后的铌粉与原始工业铌粉的XRD谱,粉末形貌如图6所示。由图看出,镁还原降氧后未生成新的物相,只有单一的铌相。衍射峰的峰形基本不变,没有明显的宽化。然而,降氧铌粉的(110),(200),(211)和(220)晶面间距相对于降氧前略微减小,如(110)晶面间距由2.338 7 nm减小至2.335 7 nm,峰位角向右偏移约0.8°,表明降氧处理使铌晶格畸变程度减小,这是因为铌中固溶的氧降低了。
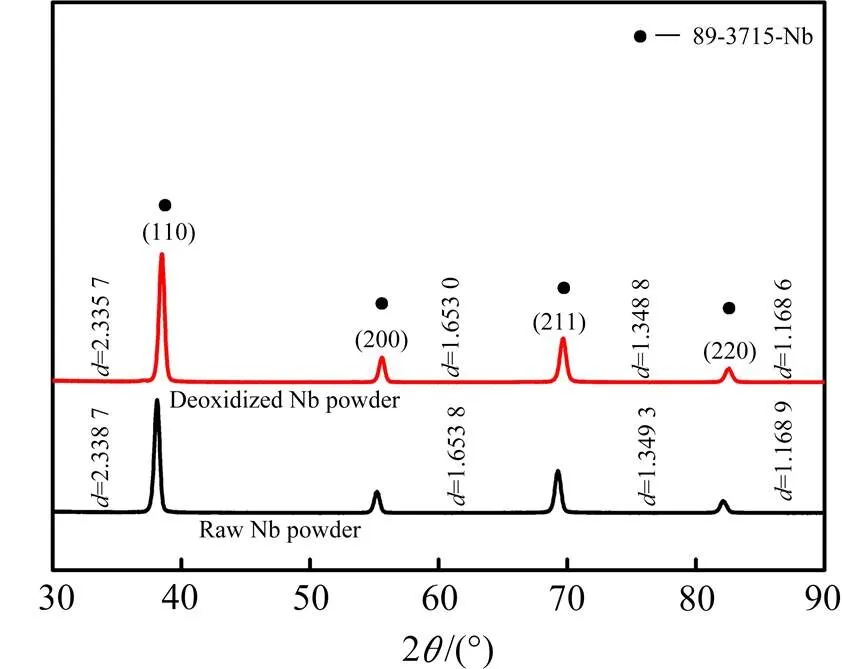
图5 工业铌粉及其镁还原降氧后的XRD谱

图6 降氧前后铌粉的SEM形貌
(a), (c) Raw niobium powder; (b), (d) Deoxidized niobium
实验测得原始铌粉和降氧后铌粉的费氏粒度分别为9.8 μm和10.2 μm。从图6(a)和(c)看出,降氧前较大的铌粉颗粒尺寸为40 μm左右,较小的颗粒尺寸在0.5 μm左右,铌粉形状不规则、棱角较尖锐,且大颗粒表面吸附许多粒径约0.2~2 μm的细小颗粒。由图6(b)和(d)看出,降氧后,铌粉的最大颗粒尺寸仍为40 μm左右,但最小颗粒尺寸在5 μm左右,细小的铌粉微粒显著减少,这是由于在酸洗和水洗过程中细小颗粒被酸溶解或洗掉。降氧后铌粉形貌未发生明显改变。
3 结论
1) 对氧含量为4.1×10−3、费氏粒度为9.8 μm的工业铌粉进行高温镁还原,降低铌粉的氧含量,在保证镁添加量足够的前提下,优化出的最佳镁还原工艺参数为还原温度1 133 K、镁添加量为理论用量的4倍、还原时间4 h。在此工艺下进行镁还原脱氧后,铌粉的氧含量从4.1×10−3显著降低至3.56×10−4,这远低于国内工业水平的1×10−3~2.5×10−3。
2) 随镁粉用量增加,脱氧铌粉的氧含量先减小,然后趋于稳定。在保证镁粉足够的前提下,脱氧铌粉的氧含量随还原温度升高先减小后增大,随还原时间延长先减小后趋于稳定。
3) 对高氧工业铌粉进行镁热还原降氧,可减少铌粉内部的固溶氧,铌粉的粒度和形貌不发生改变。
[1] 王肇信, 幸良佐, 曾芳屏. 钽铌冶金学[M]. 北京: 冶金工业出版社, 1998: 12−15. WANG Yixin, XING Liangzuo, ZENG Fangping. Tantalum and Niobium Metallurgy[M]. Beijing: Metallurgical Industry Press, 1998: 12−15.
[2] ECKERT J. Niobium and Niobium Compounds[M]. Germany: Ullmann’s Encyclopedia of Industrial Chemistry, 2000: 44−59.
[3] 汪琳, 曹鹏, 熊翔. 金属粉末表面稳定化处理的研究[J]. 粉末冶金工业, 1997, 7(3): 11−13. WANG Lin, CAO Peng, XIONG Xiang. Study on surface stabilization of metal powder[J]. Powder Metallurgy Industry, 1997, 7(3): 11−13.
[4] Florêncio O, Silva P S, Grandini C R. Diffusion phenomena of the oxygen and nitrogen in niobium by mechanical spectroscopy[J]. Defect and Diffusion Forum, 2010, 297/301: 1346−1353.
[5] HONG C I, LIM J W. Efficacy of acid cleaning on the deoxidation of titanium powder using calcium[J]. Korean Journal of Metals and Materials, 2018, 56(3): 205−209.
[6] Orlov V M, Kryzhanov M V. Deoxidation of the tantalum powder produced by self-propagating high-temperature synthesis [J]. Russian Metallurgy, 2014, 2014(3): 191−194.DOI:10.1134/ S0036029514030057.
[7] Delheusy M, Stierle A, Kasper N, et al. X-ray investigation of subsurface interstitial oxygen at Nb/oxide interfaces[J]. Applied Physics Letters, 2008, 92(10): 123−125.
[8] Luidold S, Antrekowitsch H, Ressel R. Production of niobium powder by magnesiothermic reduction of niobium oxides in a cyclone reactor[J]. International Journal of Refractory Metals and Hard Materials, 2007, 25(5/6): 423−432.
[9] Nico C, Monteiro T, Gra m p f. Niobium oxides and niobates physical properties: review and prospects[J]. Progress in Materials Science, 2016, 80: 1−37.
[10] Pukazhselvan D, Otero-Irurueta G, Pérez J, et al. Crystal structure phase stoichiometry and chemical environment of MgNbyO+nanoparticles and their impact on hydrogen storage in MgH2[J]. International Journal of Hydrogen Energy, 2016, 41(27): 1709−1715.
[11] Yuan B, Okabe T H. Production of fine niobium powder by preform reduction process using Mg-Ag alloy reductant[J]. Journal of Alloys and Compounds, 2007, 443(1/2): 71−80.
[12] Mueller R, Bobeth M, Brumm H, et al. Kinetics of nanoscale structure development during Mg-vapour reduction of Niobium oxide[J]. International journal of Materials Research, 2007, 98(11): 1138−1145.
[13] Orlov V M, Sukhorukov V V. Magnesium-thermal preparation of niobium powders[J]. Russian Metallurgy, 2010, 2010(3): 168−173. DOI:10.1134/S0036029510030043.
[14] KUMAR T S. Preparation of niobium metal powder by two- stage magnesium vapor reduction of niobium pentoxide[J]. Journal of Metallurgy, 2013, 80: 1−8.
[15] Okabe T H, Iwata S, Imagunbai M, et al. Production of niobium powder by preform reduction process using various fluxes and alloy reductant[J]. ISIJ International, 2004, 44(2): 285−293.
[16] 王兴庆, 王振颖, 谢大海. 华东五省一市粉末冶金技术交流大会论文集[C]. 上海: 上海大学, 2010: 87−93. WANG Xingqing, WANG Zhengying, XIE Dahai. Preparation of high purity niobium powder by electrodeoxidation of molten salt[C]// 2010 the 13th East China Five Provinces and One City Powder Metallurgy Technology Exchange Conference Proceedings. Shanghai: Shanghai University, 2010: 87−93.
[17] Liu S, Suzuki R O, Ono K. Solid state deoxidation of niobium by calcium and magnesium[J]. Journal of Alloys and Compounds, 1998, 266(1/2): 251−254.
[18] Niiyama H, Tajima Y, Tsukihashi F, et al. Deoxidation equilibrium of solid titanium zirconium and niobium with calcium[J]. Journal of the Less Common Metals, 1991, 169(2): 209−216.
[19] Choi k, Choi h. Effect of magnesium on the phase equilibria in magnesio-thermic reduction of Nb2O5[J]. Materials Letters, 2016, 183: 151−155.
[20] 梁英教, 车荫昌. 无机热力学数据手册[M]. 沈阳: 东北大学出版社, 1993: 226−236. LIANG Yingjiao, CHE Yinchang. Inorganic Thermodynamics Data Handbook[M]. Shenyang: Northeastern University Press, 1993: 226−236.
[21] 叶大伦. 实用无机物热力学数据手册[M]. 北京: 冶金工业出版社, 2002: 8−30. YE Dalun. Practical Inorganic Thermodynamics Data Handbook[M]. Beijing: Metallurgical Industry Press, 2002: 8−30.
Deoxygenation process of high oxygen niobium powders by magnesium reduction
LIU Fang1, 2, LI Qingkui1, LUO Junfeng2, XU Guojin2ZHANG Qiaoxia2
(1. Henan Province Industrial Technology Research Institute of Resources and Materials,Zhengzhou University, Zhengzhou 450001, China; 2. Grikin Advanced Materials Co., Ltd, Beijing 102200, China)
Hydrogen-dehydrogenation and oxygen reduction equipment was used to reduce the oxygen content of the industrial niobium powder with an original oxygen content of 4.1×10−3by magnesium reduction. The effects of reduction temperature, reduction time and magnesium powder amount on the oxygen content of niobium powder were studied. The magnesium reduction and oxygen reduction process of niobium powder was optimized. The results show that when the reduction temperature is 1 133 K and the amount of magnesium is enough, the oxygen content of niobium powder decreases first and then tends to be stable with the increase of reduction time. The oxygen content of deoxidized niobium powder decreases from 8.90×10−4to 3.56×10−4with the increase of reduction temperature from 953 K to 1 133 K at 4 times of theoretical magnesium addition and 4 h of reduction time. With increasing the temperature to 1 203 K, the oxygen content of niobium powder increases instead. The best magnesium reduction process of niobium powder is that the reduction temperature is 1133k, the amount of magnesium is 4 times of the theoretical amount, the reduction time is 4 h, and the oxygen content of niobium powder after deoxidization is 3.56×10−4. The morphology of niobium powder is basically unchanged.
high oxygen niobium powders; deoxygenation; magnesium reduction; reduction temperature; reduction time
TG146.4+16
A
1673-0224(2020)03-227-07
2019−12−16;
2020−03−25
李庆奎,教授。电话:18310299062;E-mail: 18236138640@163.com
(编辑 汤金芝)

