肝异位脾脏五例诊治体会
龙新 张磊 赵健萍 程琪 朱鹏 张必翔 陈孝平
肝异位脾脏十分罕见,通常无明显的症状,亦无特异性的影像学表现,无创性检查诊断十分困难,易与原发性肝癌、转移性肝癌、肝腺瘤、局灶性结节增生(FNH)、肝血管瘤及其他良性肿瘤相混淆[1]。为了提高肝异位脾脏诊断准确率,让病人及时正确的接受治疗,我们回顾性分析5例肝异位脾脏的病例资料。
对象与方法
一、对象
1.2013~2018年我院收治的肝异位脾脏5例,均为男性,年龄33~52岁,平均年龄45岁。均经病理检查证实。所有病人均无特殊不适,均由体检发现肝脏肿块入院。入院时身体状态(PS)评分0~1分,体质指数(BMI) 18.0~28.7kg/m2,平均23.0kg/m2。吸烟史2例,饮酒史2例。无高血压及糖尿病史。乙型肝炎、甲型肝炎病史各1例,均无肝硬化病史。均有外伤脾切除史,病史10~20年,平均16.4年。除腹部陈旧性手术瘢痕外,均无阳性体征。
2.实验室检查:白细胞(5.6~8.4)×109/L,平均6.7×109/L;血红蛋白130~146 g/L,平均138 g/L;血小板(176~372)×109/L,平均282×109/L。丙氨酸氨基转移酶11~136 U/L,平均51 U/L;门冬氨酸氨基转移酶15~99 U/L,平均45 U/L,总胆红素5.9~21.5 μmol/L,平均12.3 μmol/L;白蛋白39.0~48.6 g/L,平均42.7 g/L;肝功能Child分级均为A级(5分)。肿瘤标志物,甲胎蛋白(AFP)1.5~6.9 ng/ml,平均4.4 ng/ml,癌胚抗原(CEA)0.8~3.1 ng/ml,平均2.0 ng/ml,糖链抗原19-9(CA19-9)5.3~23.8 U/ml,平均12.8 U/ml。凝血酶原时间(PT)12~14秒,平均13秒;活化部分凝血活酶时间(APTT)29~43秒,平均35秒;凝血酶原活动度(PTA)85%~124%,平均104%;国际标准化比值(INR)0.9~1.1,平均1.0。吲哚氰绿15分钟滞留率(ICG R-15)3.4%~8.5%,平均6.4%。
3.影像学检查:所有病人胸片、心电图检查均无异常。3人接受肝脏超声检查,所有病人均行CT检查,3例病人行MRI(平扫+灌注PWI+弥散DWI)检查。病例1病灶CT表现:平扫为低密度,动脉期增强,门脉期持续强化,延迟期密度降至与肝实质相当,病灶内部存在纤维疤痕,诊断为肝细胞癌或者FNH或者肝血管瘤。病例2病灶超声检查表现为低回声;CT平扫为匀质低密度;MRI为T1低信号,T2高信号,动脉期可见轻度强化,DWI明显弥散受限;诊断为原发性肝癌。病例3病灶超声表现低回声区,形态尚规则,边界尚清,周边可见强回声,内部回声不均;CT表现动脉期强化,延迟期强化减弱;MRI表现呈稍长T1长T2信号,动脉期可见边缘见斑点状强化,延迟期强化范围扩大,延时扫描主体呈等信号,其内散在点状低信号,DWI未见明显弥散受限;诊断为肝良性肿瘤或肝血管瘤。病例4病灶平扫为低密度,边界清楚,动脉期轻度强化,静脉期及延迟期等密度改变;MRI表现为稍长T1长T2信号,动脉期中度强化,静脉期及延迟期呈等信号改变,DWI见轻度弥散受限;考虑肝良性肿瘤,FNH可能。病例5病灶超声图像为等回声,形态尚规则,边界清楚,内部回声均匀;CT为等密度,动脉期明显强化,静脉期呈相对高密度;富血供病灶考虑为肝良性肿瘤或不典型血管瘤。
4.术前诊断:2例术前诊断原发性肝癌可能,其余3例诊断为肝良性肿瘤:FNH或血管瘤。
5.治疗及病理:所有病人均接受手术治疗,4例为腹腔镜肝部分切除术,术中探查发现,4例为单发病灶,1例为2个病灶,均位于肝包膜下,位于S2段病灶1个,S4段2个,S6段2个,S8段1个,包膜均完整,最大直径约5 cm,最小直径约1.5 cm。4例行腹腔镜下肝部分切除术,1例开腹肝部分切除术。手术时间118~303分钟,平均186分钟。失血量0~200 ml,平均100 ml,均未输血。术中未行肝门阻断,肿块无破裂,手术切缘0.5~2 cm,平均1.2 cm。术后恢复顺利,未出现并发症,术后住院5~9天,平均7天。术后病理检查证实肝脏肿块均为脾脏组织,考虑肝异位脾脏。见表1。
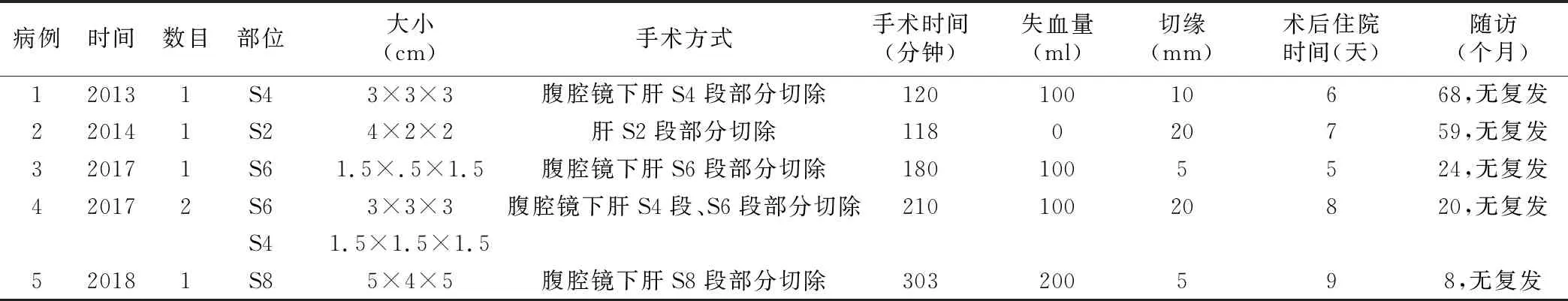
表1 治疗和术后随访
6.转归:术后病人随访8~68个月,平均35.8个月,均未出现复发病灶。
讨 论
1896年Albrecht首次描述异位脾脏,1939年Buchbinder 和 Lipkoff首次命名。异位脾脏常源于外伤性脾破裂或者脾切除术后脾组织的种植。外伤性脾破裂导致的异位脾脏发生率为26%~67%,可以发生于身体任何一个部位,最常见的部位是小肠、大网、肠系膜、膈下和盆腔的浆膜表面,也有脾脏火器伤导致胸腔和皮下异位脾脏的报道[2]。肝异位脾脏十分罕见,目前国内外文献均为个案报道,总共不超过50例。关于肝异位脾脏的发生机制和临床特点所知甚少,诊断异常困难。
大多数情况下,与其他腹腔种植脾脏一样,肝异位脾脏来源于外伤性脾破裂或者脾切除术后脾组织,种植于肝包膜表面或者肝包膜有破口而种植于肝内,这种情况常发生于肝左叶,是由于肝左叶离脾区较近的缘故[3-5]。我们的资料显示,一半的病灶位于肝左叶。另外一种学说认为,外伤导致红系造血祖细胞经门静脉进入肝内,低氧环境诱导其增殖生成肝内异位脾脏[3]。
肝内异位脾脏通常无症状和阳性体征,少数病人由于病灶压迫引起腹痛或肠梗阻的表现,极少数病人有消化道出血的表现[1]。本组病例均无症状,由体检发现肝脏肿块而入院。约80%的病人有外伤所致的脾切除病史,脾切除病史平均25年,我们的结果基本与此一致。本组所有病人都有外伤脾切除病史,脾切除平均时间间隔16.4年。
肝内异位脾脏在超声、CT、MRI上的表现无特异性。也有报道认为,CT平扫表现为与肌肉密度相当,动脉期强化不一,门脉期和延迟期持续强化[6]。本组CT结果与之类似,总体上呈富血供表现,易与肝细胞癌、肝腺瘤、FNH和肝血管瘤相混淆。本组病例中有2例术前CT和MRI检查提示脾区和结肠周围多发结节,考虑种植脾。然而,没有一例肝脏肿块术前怀疑为异位脾脏,误诊率100%,可见该疾病的诊断及其困难。常规的影像学检查不能给于准确的诊断。采用超顺磁氧化铁(SPIO)MRI和放射性核素99mTcHDRS检查,可对异位脾脏作出特异性诊断[4,7],然而,99mTcHDRS的诊断准确率不足60%[3]。在实际临床工作中,由于条件限制,很少用到这两项检查。另外,肝脏种植脾脏还需与副脾鉴别。副脾先天性存在,常分布于靠近脾脏的胰脾和胃脾韧带区域,通常单发,脾动脉分支供血,存在脾门;而种植脾是后天获得的,可在身体任意部位,通常分布于左膈下,数目不定,大小不一,由周围组织供血,无脾门结构[1,8]。
通过本组病例,我们总结误诊漏诊原因如下:(1)肝异位脾脏罕见,重视程度不够;(2)病人通常无明显症状,体检偶然发现肝脏肿块;(3)实验室检查无特异性;(4)影像学检查呈富血供表现,但无特性,易误诊为原发性肝癌、肝腺瘤、FNH和肝血管瘤,特别是有乙型肝炎、丙型肝炎、肝硬化病史者,极易误诊为原发性肝癌;(5)SPIO-MRI和99mTcHDRS检查实际工作中不常开展。对以下情况的肝肿块应引起的重视:外伤脾破裂或脾切除病史;影像学检查提示脾区、结肠区域或者腹腔其他部位种植脾脏。若SPIO-MRI和99mTcHDRS诊断肝异位脾脏有困难,判断良性病变,可行经皮肝穿刺活检;怀疑恶性变者,则可考虑剖腹探查。肝异位脾脏一经证实,多数情况下只需定期随访,若为血液病脾切除者,则需根据病情是否切除病灶。

