血脂、血糖代谢水平及血压水平与糖尿病视网膜病变的相关性分析
周卓琳, 毕春潮, 邵 娟, 许治国, 刘 静
(陕西省西安市第四医院, 陕西 西安, 710004)
糖尿病视网膜病变(DR)是一种糖尿病常见微血管并发症,患者的血糖长时间处于较高的水平会损伤其视网膜血管内皮,引起眼底病变[1], 新生血管、硬性渗出、微血管瘤及玻璃体增殖等均为常见的视网膜病变表现,严重时可导致患者视网膜脱落[2]。血糖水平升高极易导致DR, 因此将血糖控制在合理的范围是预防DR的重要手段。研究[3]表明, DR的发生、发展与血糖波动、血脂变化和血压波动之间也存在紧密联系。本研究分析了血脂、血糖代谢水平及血压水平与糖尿病视网膜病变的相关性,旨在为临床防治该病提供参考。
1 资料与方法
1.1 一般资料
本研究纳入本院2018年11月—2019年11月分泌科160例DR患者,将其按照WHO制定的盲和低视力分级标准分为3组。盲组30例,其中男10例,女20例,平均(56.30±8.10)岁,平均病程(10.30±3.20)年。低视力组(即视力较好,眼最佳矫正视力<0.05)50例,其中男20例,女30例,平均(56.50±8.20)岁,平均病程(10.20±3.00)年。低视力以上组80例,其中男35例,女45例,平均(56.40±8.00)岁,平均病程(10.10±3.10)年。3组性别比例、年龄、病程等基线数据资料比较无显著差异(P>0.05)。本研究经过医院伦理委员会审核后批准实施。纳入标准: ① 均签署知情同意书; ② 均经脑部CT、MRI诊断; ③ 均符合1999年WHO制定的糖尿病诊断标准,且符合2002年悉尼国际眼科学术会议制定的DR相关标准。排除标准: ① 近期服用过影响血脂代谢的药物、糖皮质激素等; ② 眼外伤、青光眼等其他病因引起的眼底病变; ③ 自身免疫性疾病、急慢性感染及肿瘤疾病; ④ 合并严重心脑血管疾病。
1.2 方法
记录患者的性别、年龄、糖尿病病程; 测量患者的收缩压(SBP)和舒张压(DBP)。抽取患者清晨空腹静脉血4 mL, 每人2份,离心分离10 min, 转速为3 000转/min, 取上层血清。采用HK法检测空腹血糖(FPG); 采用离子交换高效液相色谱法检测糖化血红蛋白(HbAlc), 检测设备和试剂分别为Bio-Rad公司(美国)提供的D-10糖化血红蛋白仪(编号200308S36)及原装试剂; 采用一步法检测高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)。
1.3 统计学方法
2 结 果
2.1 3组血脂、血糖及血压水平比较
盲组的SBP、FPG、HbAlc、LDL-C、LDL-C/HDL-C显著高于低视力组(P<0.05), 且HDL-C水平显著低于低视力组(P<0.05)。盲组和低视力组的SBP、FPG、HbAlc、LDL-C、LDL-C/HDL-C显著高于低视力以上组(P<0.05), 且HDL-C水平显著低于低视力以上组(P<0.05)。见表1。
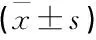
表1 3组血脂、血糖及血压水平比较
2.2 相关因素与DR视力损害的相关性分析
SBP、FPG、HbAlc、LDL-C/HDL-C与DR的视力损害均呈正相关,均是DR视力损害的独立影响因素。见表2。
3 讨 论
DR是常见的糖尿病微血管并发症,患者的血糖长期升高会引起视网膜血管内皮损害,进而导致眼底发生病变[4]。HbAlc属于血红蛋白非酶促糖基化的早期产物,通常与血糖升高有关,是判断高血糖变化的重要指标。同时, HbAlc也参与了微血管损害的过程,也是引起微血管损害的重要因子[5]。本研究中盲组的HbAlc高于低视力组和低视力以上组,提示盲组患者血糖长期处于较高状态,增进了与氧亲和能力,使氧解离下降,以至放氧过低。相关学者[6]指出,糖尿病患者的HbAlc比正常人高2~3倍,这就极易导致视网膜组织发生缺氧,加快DR的发生和发展,且HbAlc水平越高提示糖尿病视网膜病变程度越严重。因此,定期对糖尿病患者行检查眼底,并监测其HbAlc变化,对早期诊断糖尿病微血管病变和指导临床治疗有重要意义,能够降低视力丧失危险,延缓糖尿病并发症发展[7]。
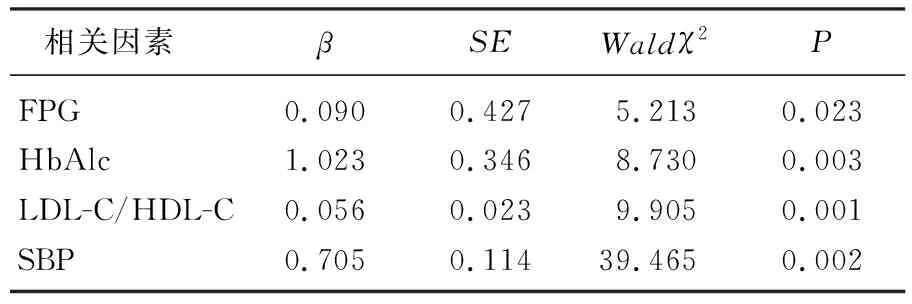
表2 相关因素与DR视力损害的相关性分析
DR患者的微小血管受损和微循环障碍是其主要特征[8]。糖尿病患者常伴有胰岛素抵抗(IR), 对脂肪分解的抑制作用下降,易出现血脂代谢异常[9]。LDL-C是重要的致动脉粥样硬化性脂蛋白,易穿过动脉内膜,与糖尿病患者发生微血管病变有关。HDL-C颗粒从周围组织摄取总胆固醇(TC)的能力降低,导致大量TC积聚在周围组织,引起HDL-C水平下降[10]。相关研究[11]表明,增殖型视网膜病变患者比背景型视网膜病变患者和无视网膜病变患者的三酰甘油(TG)、TC、LDL-C水平显著较高,且HDL-C水平显著较低。本研究发现盲组和低视力组的LDL-C、LDL-C/HDL-C显著高于低视力以上组(P<0.05), 且HDL-C水平显著低于低视力以上组(P<0.05), 这也与以往研究结果一致。视力损害的独立危险因素分析发现, 高水平FPG、HbAlc均是DR患者血脂代谢异常视力损害的独立危险因素,与DR的发生、发展有密切关系。李会琳等[12]指出,高水平LDL-C与DR的黄斑硬性渗出总面积相关,提示高水平LDL-C是DR的独立危险因素。此外相关性分析发现,高水平LDL-C、LDL-C/HDL-C是DR患者血脂代谢异常视力损害的独立危险因素,与DR的发生、发展有密切关系,且可有效反映DR的病程进展。分析其原因为糖尿病患者发生血脂代谢异常后,会引起机体血流动力学改变,导致血液黏度增加,引起视网膜组织缺血、缺氧,进而引起眼底发生一系列的微血管病变[13]。同时,血脂升高会通过非酶促糖基化通路引起脂质过氧化,进而损害血管壁,引起内皮功能紊乱[14]。此外,高血脂可促进微血栓形成,引起视网膜屏障被破坏,造成血浆脂蛋白、晶状体等渗出,导致视网膜水肿和渗出等病变[15]。
高血压常常会引起视网膜小动脉损害,诱发小动脉痉挛、硬化,出现动静脉交叉处压迫,进而导致毛细血管渗漏和视神经乳头水肿等病理改变[16]。因此,当糖尿病和高血压病并存时极易发生眼底出血[17], 发生DR的概率也比较高。本研究发现,各组收缩压升高程度比舒张压升高更加明显,且盲组和低视力组的SBP显著高于低视力以上组(P<0.05), 提示高血压与DR的产生和发展有一定关系。相关报道[18]指出, DR的严重程度与舒张压的升高有关,而年龄偏大(50岁左右)者则与收缩压有密切关联。
综上所述, SBP、FPG、HbAlc、LDL-C/HDL-C与DR患者的视力损害有密切关联,监测以上指标能够预测DR患者的视力损害并及时采取有效的治疗措施。

