TAT修饰短肽LVKEI抑制黑色素瘤B16细胞增殖及促凋亡作用
王 迪, 徐 楠, 郭家妍, 宋 跃, 唐明睿
(中国医科大学附属第一医院 整形外科, 辽宁 沈阳, 110001)
黑色素瘤是一种极具侵袭性的皮肤恶性肿瘤,虽然黑色素瘤的发病率仅占所有恶性肿瘤的3%左右,但约80%的皮肤癌相关死亡是由黑色素瘤导致的[1-2]。黑色素瘤易发生淋巴和血行转移,治疗手段有限且预后极差。程序性细胞死亡蛋白4(PDCD4)是一种翻译抑制蛋白,可在体内外抑制肿瘤细胞增殖与侵袭[3-4]。1995年,Shibahara K等[5]在凋亡小鼠细胞系中发现了PDCD4基因。人类的PDCD4基因定位于染色体10q24, 互补DNA(cDNA)全长约3.5 kb, 其中编码区约1.4 kb[6]。PDCD4编码蛋白约含469个氨基酸,包含1个N端功能域(残基1-140)和2个串联MA3域,其中2个MA3域分别称为nMA3结构域(残基164-275)和cMA3结构域(残基327-440)[7], 而nMA3结构域、cMA3结构域与真核翻译起始因子4A(eIF4A)表面结构非常相似[8]。突变分析及核磁共振波谱(NMR)分析表明, PDCD4的2个MA3结构域均可与eIF4A结合,抑制核糖体复合物的形成,抑制RNA解旋酶活性,从而抑制信使RNA(mRNA)的翻译及蛋白质的合成[8-9]。
作为DEAD-box蛋白家族的典型成员, eIF4A具有RNA解旋酶活性,可解开5′非翻译区和mRNA帽的二级结构,从而促进核糖体扫描[10]。当eIF4A被PDCD4的2个MA3结构域结合后,其RNA解旋酶活性丧失[7]。研究[11-12]表明,单独的cMA3结构域足以抑制RNA解旋酶活性和mRNA翻译进程。短肽是由3~9个氨基酸构成的肽链,是蛋白质或多肽消化分解后的片段,部分片段仍具有蛋白质或多肽的生物活性。短肽类药物具有高度选择性和有效性,且安全性高、耐受性强[13]。相较于传统小分子靶向药,短肽类靶向药物的研发更容易,制造成本更低[14]。研究[15-17]表明,PDCD4在黑色素瘤中表达下调,而过表达PDCD4将抑制黑色素瘤增殖及侵袭。本课题组前期研究[18]发现,PDCD4的cMA3结构域可以对B16黑色素瘤细胞的增殖产生强大的抑制作用,而nMA3结构域的抗肿瘤作用在B16黑色素瘤细胞中相对较弱。本研究在前期研究基础上继续研究PDCD4的cMA3结构域,将cMA3结构域分解为多个五肽氨基酸序列,其中短肽LVKEI在计算机模拟分子对接中参数较优,被定为研究对象。本研究探讨TAT修饰短肽LVKEI(TAT-LVKEI)抑制B16黑色素瘤细胞系增殖及促进其凋亡的机制,现报告如下。
1 材料与方法
1.1 细胞系和细胞培养
黑色素瘤细胞系B16购自美国典型培养物保藏中心(ATCC,Bethesda,MD)。该细胞系于含有10%胎牛血清及抗生素(100 U/mL青霉素和100 μg/mL链霉素)的Dulbecco′s Modified Eagle′s培养基(Hyclone, Logan, UT)的37 ℃、5% CO2的细胞培养箱中培养。
1.2 细胞活力测定
将黑色素瘤细胞系B16细胞按每孔2×103个细胞密度接种于96孔板中,并在37 ℃下与二甲基亚砜(DMSO)及短肽LVKEI、TAT肽、TAT-LVKEI(5、50、500 μmol/L)共培养48 h。处理后48 h, 更换培养基并加入CCK-8溶液(碧云天),继续在37℃下再孵育4 h。采用全波长酶标仪测定450 nm下各孔吸光度值。
1.3 细胞周期检测
将黑色素瘤细胞系B16细胞按每孔5×105个细胞密度接种于6孔板中,并在37 ℃下与DMSO及短肽LVKEI、TAT肽、TAT-LVKEI(5、50、500 μmol/L)共培养48 h。此后将细胞消化为单细胞悬液,离心弃上清,使用预冷70%体积比(V/V)乙醇固定过夜,按照细胞周期试剂盒(碧云天)说明配制碘化丙啶(PI)染色液,之后用染色液在37 ℃水浴锅内孵育细胞,最后采用流式细胞仪(FACSCanto Ⅱ, BD)检测细胞周期,使用Modfit LT软件进行绘图及统计分析。
1.4 细胞凋亡测定
将黑色素瘤细胞系B16细胞按每孔5×105个细胞密度接种于6孔板中,并在37 ℃下与DMSO及短肽LVKEI、TAT肽、TAT-LVKEI(5、50或500 μmol/L)共培养48 h。之后用无乙二胺四乙酸(EDTA)胰蛋白酶将细胞消化为单细胞悬液,使用Annexin V-PI凋亡试剂盒(碧云天)对细胞进行染色标记,最后采用流式细胞仪(FACSCanto Ⅱ, BD)检测细胞凋亡情况,使用Flowjo VX软件进行绘图及统计分析。
1.5 Western-blotting检测蛋白表达
将对照组与处理组的黑色素瘤细胞系B16细胞按每孔5×105个细胞密度接种于6孔板中,并用含DMSO或100 μmol/L氮烯唑胺(DTIC)的培养基处理48 h。之后于冰上使用RIPA蛋白裂解液[含苯甲基磺酰氟(PMSF)]提取细胞蛋白,使用BCA法进行蛋白定量配平,加入上样缓冲液进行热变性, -20 ℃保存。配置SDS-PAGE凝胶,每孔上样20 μL,电泳后转印至聚偏二氟乙烯膜(PVDF膜), 5%脱脂奶粉封闭1 h后加一抗室温孵育1 h后4 ℃过夜,一抗体浓度分别为Cleaved Caspase-3(CST,#9661) 1∶1 000, Bax(CST,#2772) 1∶1 000, Bcl2(CST, #3498) 1∶1 000, β-actin(proteintech) 1∶5 000, 次日复温2 h后加二抗室温孵育1 h, 最后加ECL发光液于Bio-Rad成像仪获取条带照片并使用Image J软件进行分析。
1.6 统计学分析
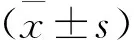
2 结 果
2.1 短肽LVKEI与eIF4A的计算机模拟分子对接
短肽LVKEI与eIF4A蛋白的模拟对接见图1, 其中白色分子为eIF4A蛋白,黄色分子为单链RNA, 红色为eIF4A抑制剂Rocaglamide, 蓝色为短肽LVKEI。此时LVKEI与eIF4A蛋白处于最佳对接位置,此位置的对接亲和力为-4.4 kcal/mol, 可推测短肽LVKEI可发挥与eIF4A抑制剂Rocaglamide相同的干扰eIF4A与RNA相互作用的功效。

白色为eIF4A蛋白; 黄色为RNA; 红色为eIF4A抑制剂; 蓝色为短肽LVKEI。图1 短肽LVKEI与eIF4A的计算机模拟分子对接
2.2 TAT-LVKEI抑制黑色素瘤细胞系B16细胞增殖
CCK-8测定结果显示,单独五肽LVKEI及穿膜肽TAT几乎不影响细胞增殖活力,而TAT-LVKEI可显著抑制B16细胞的增殖活力,且抑制方式是呈剂量依赖性的。在细胞周期检测中,作者选用500 μmol/L TAT-LVKEI进行实验,发现TAT-LVKEI可将B16细胞的细胞周期阻滞于G0/G1期,这与CCK-8的结果一致。见图2。

B: 流式细胞仪检测DMSO、500 μmol/L LVKEI、500 μmol/L TAT、500 μmol/L TAT-LVKEI处理B16细胞48 h的细胞周期结果;
2.3 TAT-LVKEI诱导黑色素瘤细胞系B16细胞
研究结果显示, 500 μmol/L TAT-LVKEI处理后可显著增加B16细胞的凋亡率(P<0.0001), 而500 μmol/L的短肽LVKEI及TAT穿膜肽处理并未增加B16细胞的凋亡率。见图3。


A: 各组B16细胞凋亡流式图(n=4); B: 各组流式凋亡分析柱状图,与DMSO比较, ****P<0.0001。图3 TAT-LVKEI诱导黑色素瘤细胞系B16细胞凋亡
2.4 TAT-LVKEI对B16细胞凋亡、增殖相关蛋白的影响
研究结果显示, TAT-LVKEI处理增加了B16细胞Bax、Cleaved Caspase-3的表达水平,降低了Bcl2、Ki-67的表达水平,而DMSO、LVKEI、TAT处理组并未显著影响凋亡相关基因,证明TAT-LVKEI具有促凋亡作用。见图4。

图4 TAT-LVKEI影响B16细胞凋亡、增殖相关蛋白的印迹图
3 讨 论
黑色素瘤是严重的恶性肿瘤。本研究结果表明,TAT-LVKEI能显著抑制黑色素瘤B16细胞的增殖活力,将B16细胞的细胞周期阻滞于G0/G1期,并能诱导B16细胞凋亡。
在各种人类癌症中,PDCD4的表达均有不同程度缺失或减少,如胶质瘤[19]、口腔癌[20]、食管癌[21]、肺癌[22]、乳腺癌[23]、肝细胞癌[24]、胃癌[25]和大肠癌[26]。PDCD4是一种新型的肿瘤抑制因子[3]。过表达PDCD4可抑制增殖相关基因Ki-67的表达,从而抑制肿瘤细胞增殖[20,27]; 同时,过表达PDCD4可激活Bcl-2/Bax/Caspase-3通路,促进肿瘤细胞凋亡[28-29]。本研究课题组前期研究[18]证实,黑色素瘤组织中的PDCD4表达水平显著低于正常组织,过表达PDCD4基因或过表达PDCD4基因的cMA3结构域可以促进黑色素瘤B16细胞的凋亡。本研究结果证实TAT-LVKEI对B16细胞具有增殖抑制及促凋亡作用。
基于抑癌基因活性片段合成的短肽已被报道可抑制乳腺癌细胞[30-31]、前列腺癌细胞[32]、卵巢癌细胞[33]增殖,本研究提取了抑癌基因PDCD4中cMA3结构域的有效短肽片段LVKEI用于测试其抗肿瘤活性,但短肽类药物普遍存在穿膜性差、半衰期短等缺点[34]。采用穿膜肽、聚乙二醇等修饰手段,短肽药物可以达到理想的穿膜性及半衰期[34-35]。本研究对LVKEI短肽进行TAT穿膜肽修饰,结果表明TAT-LVKEI具有一定的抗肿瘤活性,但其是否能够用于临床还需要进一步的验证。

