血清凝集素样氧化型低密度脂蛋白受体-1表达水平与颈动脉斑块稳定性的相关性研究
周 冰, 秦雅红, 焦云根
(扬州大学附属医院, 1. 检验科; 2. 心内科, 江苏 扬州, 225000)
动脉粥样硬化在临床上主要表现为急性冠脉综合征(ACS), ACS发病机制为不稳定的动脉粥样硬化斑块纤维帽破裂,引起血小板聚集和血栓形成。由于这种斑块破损具有突发性和难预测性,早期识别不稳定斑块对ACS危险性评价和改善患者预后非常重要,特别是对无症状患者发生急性血管闭塞性心血管事件的评估具有重要意义[1-3]。传统的斑块检测方法多为有创性检查,不易在临床普及,而无创检测手段将成为临床应用的趋势[4]。凝集素样氧化低密度脂蛋白受体-1(LOX-1)是一种E类清道夫受体,调节血管细胞摄取氧化型低密度脂蛋白(ox-LDL)。LOX-1参与内皮功能障碍,单核细胞黏附、增殖、迁移和平滑肌细胞凋亡,泡沫细胞形成,血小板活化以及斑块不稳定等过程[5]。本研究比较了颈动脉粥样硬化不同性质斑块患者中LOX-1水平的差异,旨在探讨颈动脉粥样硬化斑块稳定性和血清LOX-1的相关性。
1 资料与方法
1.1 一般资料
选择2019年1—12月本院心血管内科收治的78例ACS患者作为观察组。另选择同期来本院体检的52例心、肝、肾功能各项指标正常,经彩色多普勒超声证实颈动脉无斑块者纳入对照组。2组研究对象年龄、性别比较,差异无统计学意义(P>0.05)。观察组纳入标准: ① ACS的诊断符合中华医学会心血管分会制定的ACS诊断标准; ② 经颈动脉超声检测证实有斑块者。排除标准: ① 各种急慢性感染、恶性肿瘤患者,近期有创伤、手术史、烧伤史者; ② 近1个月内发生脑梗死或心肌梗死者; ③ 自身免疫性疾病,严重肝、肾疾病等。
1.2 方法
1.2.1 颈动脉超声检查: 采用美国GE公司LOGIQ7超声仪检查,由2名经验丰富的专业医师共同判断颈动脉斑块性质,将观察组78例分为不稳定斑块组(n=41)、稳定斑块组(n=37)和无斑块组(对照组,n=52)。
1.2.2 资料收集: 记录受试者的一般资料,包括年龄、性别、吸烟史、饮酒、既往病史,测量身高、体质量,计算体质量指数(BMI)等。在清晨空腹条件下抽取受试者静脉血5 mL,采用雅培C16000全自动生化分析仪检测空腹血糖(GLU)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、超敏C反应蛋白(hs-CRP)、尿酸(UA)、肌酐(Cr)等指标水平。
1.2.3 血清LOX-1测定: 采用双抗体夹心酶联免疫吸附法检测血清LOX-1水平,试剂盒由上海酶联生物公司提供,仪器为奥地利TECAN公司Sunrise酶标分析仪,严格按试剂使用说明书操作。
1.3 统计学处理
采用SPSS 19.0统计软件进行分析,计量资料以均数±标准差表示,两样本均数比较采用t检验,多组间均数比较采用单因素方差分析,分类变量采用Spearman相关分析,连续变量采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 不稳定斑块组、稳定斑块组与对照组一般情况比较
3组间饮酒、BMI、舒张压、TG、TC、UA、Cr、GLU情况比较,差异无统计学意义(P>0.05); 不稳定斑块组、稳定斑块组的吸烟、收缩压、HDL-C、LDL-C情况与对照组比较,差异有统计学意义(P<0.05)。见表1。
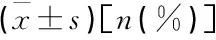
表1 3组一般情况比较
2.2 不稳定斑块组、稳定斑块组与对照组LOX-1、hs-CRP水平比较
不稳定斑块组、稳定斑块组LOX-1、hs-CRP水平高于对照组,且不稳定斑块组LOX-1、hs-CRP水平高于稳定斑块组,差异均有统计学意义(P<0.05), 见表2。
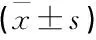
表2 3组LOX-1、hs-CRP水平比较
2.3 观察组颈动脉斑块稳定性与LOX-1、hs-CRP水平的相关性
相关性分析发现,观察组患者颈动脉斑块稳定性与LOX-1、hs-CRP水平均呈负相关(r=-0.673、-0.554,P<0.05), 表明斑块越不稳定, LOX-1、hs-CRP水平越高。
3 讨 论
动脉粥样硬化是一种慢性炎症性疾病,不稳定斑块的破裂和随后形成的闭塞性血栓是ACS重要的病理基础[6]。在疾病过程中,强烈的氧化应激导致活性氧(ROS)的产生和抗氧化防御力不足的失衡,多余的氧化力导致LDL向ox-LDL的转化。Yamada Y等[7]研究发现, ox-LDL是促进斑块形成和不稳定的关键步骤, ox-LDL引起内皮功能障碍,导致ROS的生成、一氧化氮合成的抑制和增强单核细胞与活化内皮细胞的黏附。另外, ox-LDL参与诱导平滑肌细胞的迁移和巨噬细胞募集和极化,导致泡沫细胞的形成。
本研究中,观察组患者LOX-1、hs-CRP水平显著高于对照组健康人群,且不稳定斑块组LOX-1、hs-CRP水平均显著高于稳定斑块组(P<0.05)。同时, LOX-1、hs-CRP水平的高低与颈动脉粥样斑块稳定性呈负相关, LOX-1、hs-CRP水平越高,斑块稳定性越差,风险越高,表明LOX-1、hs-CRP水平的高低有助于判断ACS患者粥样硬化斑块的稳定性,是不稳定斑块形成的独立危险因素。
大多数ox-LDL效应是由ox-LDL及其主要受体相互作用介导的, ox-LDL通过几种不同的清道夫受体发挥作用,其中最重要的是LOX-1, 为多配体血管清道夫受体,是一种Ⅱ型膜蛋白,属于C型凝集素家族。LOX-1由4个结构域组成,是内皮细胞摄取ox-LDL的主要受体,可由多种细胞表达[8-9]。LOX-1在动脉粥样硬化的整个过程起重要作用,特别是在斑块不稳定中起重要作用: ox-LDL激活LOX-1刺激p38丝裂原活化蛋白激酶细胞内信号转导途径,增强内皮基质金属蛋白酶的表达活性; ox-LDL还可诱导平滑肌细胞凋亡和LOX-1过度表达,激活Bax/Bcl-2途径,参与平滑肌细胞和内皮细胞的程序化细胞死亡。此外, LOX-1的激活与抑制性凋亡蛋白-1(IAP-1)的下调以及caspase-3和caspase-9活性的上调有关,促进细胞凋亡。LOX-1的胞外结构域在细胞表面被裂解,产生可溶性LOX-1, 后者通过增加金属蛋白酶,降低动脉粥样硬化斑块稳定性[10]。
LOX-1与ox-LDL相互作用,诱导内皮功能障碍、白细胞黏附、巨噬细胞源性泡沫细胞形成、平滑肌细胞增殖和迁移,血小板活化。LOX-1活化导致动脉粥样硬化斑块破裂和急性心血管事件。LOX-1还在调节泡沫细胞的形成中起重要作用,通过早期促进促炎细胞因子以及基质金属蛋白酶的释放促进动脉粥样硬化的形成,后期导致斑块破裂和血栓形成[11]。此外,LOX-1可被裂解产生可溶性LOX-1, 对动脉粥样硬化相关疾病的诊断和预后有重要意义。
血清hs-CRP是经典的血管炎症标记物,属于急性炎症时相反应蛋白,主要由肝细胞合成,可以促进巨噬细胞摄取LDL-C,形成泡沫细胞,同时激活补体系统,导致内皮组织损伤,促进血栓形成,参与动脉粥样硬化发生、发展,最后斑块破裂的全过程。研究[12-14]发现, hs-CRP对粥样斑块的形成有促进作用,且hs-CRP在不稳定斑块中显著增加,提示hs-CRP对ACS不稳定斑块的进展有特殊作用。
作为生物标志物, LOX-1的一个越来越重要的用途是与心血管疾病危险因素(即糖尿病、高血压、吸烟和高脂血症)相关。最近研究表明动脉粥样硬化不再是衰老的必然结果,而是一种多因素病因的复杂疾病。本研究确定了吸烟、高血压、HDL-C、LDL-C与斑块稳定性的相关性,未发现血糖与斑块稳定性的关系,可能与本研究病例数较少有关。
吸烟是ACS发生的独立危险因素,研究[15-17]发现吸烟能促进机体肾上腺素分泌增加,致血脂异常,血黏度增大,促进粥样斑块形成,导致ACS的发生。高血压是ACS发生的独立危险因素。高动脉压由于血流动力学发生改变,使血管内皮细胞受损,血管壁通透性增加,促进脂蛋白浸润,炎性细胞黏附在损伤的部位吞噬脂质形成泡沫细胞,后期导致斑块破裂和血栓形成[18-21]。血脂异常也是ACS发生的独立危险因素。LDL-C水平与ACS的发生呈正相关,而HDL-C水平与ACS的发生呈负相关,主要是因为后者可将脂质外运从而降低血中TC及其转化物水平,同时通过减少ROS的产生,从而使Ox-LDL生成减少,预防或延缓ACS的发生和发展。
综上所述, ACS发病机制为动脉粥样硬化不稳定斑块破裂,随后引起血小板聚集和血栓形成。LOX-1、hs-CRP水平与颈动脉斑块的稳定性密切相关,可作为评价ACS斑块稳定性的血清学指标,早期监测LOX-1、hs-CRP水平对ACS危险性评价和改善患者预后非常重要,特别是对无症状患者发生急性血管闭塞性心血管事件的评估具有重要意义。

