全身炎症反应指数与动脉瘤性蛛网膜下腔出血术后症状性脑血管痉挛的关系及Nomogram预测模型的建立
张 振, 张恒柱, 李育平, 严正村, 董 伦, 王晓东, 王杏东
(1. 扬州大学, 江苏 扬州, 225000; 2. 扬州大学临床医学院 神经外科, 江苏 扬州, 225000)
症状性脑血管痉挛(SCVS)作为动脉瘤性蛛网膜下腔出血(aSAH)的常见且严重的并发症之一,易引发脑缺血、脑梗死等,是导致患者预后不良和死亡的主要原因。目前, SCVS的发病机制尚不明确,但国内外研究[1-3]指出,神经炎症反应活动在SCVS病理、生理过程中发挥关键作用。一般来说,炎症反应首先主要体现为外周血炎症细胞及因子的变化; 同时,作为炎症水平的反映,外周血炎症细胞计数及其衍生指标已被广泛用于脑肿瘤、脑卒中及aSAH等疾病的预测分析[4-6]。全身炎症反应指数(SIRI)是基于外周血中性粒细胞、单核细胞和淋巴细胞绝对值的综合指标,代表了体内不同的炎症、免疫途径,能更为全面地反映机体炎症状态[7-8]。本研究回顾性分析本院收治的aSAH患者资料,探讨SIRI对SCVS的评估价值,并基于SIRI水平共建简便、可靠的Nomogram预测模型,现报告如下。
1 资料与方法
1.1 一般资料
回顾性分析2015年1月—2017年12月江苏省苏北人民医院收治的125例aSAH病例资料,其中男45例,女80例,年龄24~86岁,平均(56.00±12.00)岁。纳入标准: ① 发病24 h内入院; ② 入院后确诊为aSAH并在3 d内行早期手术者。排除标准: ① 伴有严重内科疾病和/或其他中枢神经系统疾病; ② 术前提示有脑血管痉挛; ③ 住院期间死亡或退出研究者。本研究得到医院伦理委员会批准。
1.2 方法
依据孙久君等[9]研究提出的SCVS诊断标准,将患者分为SCVS组和非SCVS组。收集2组患者的年龄、性别、个人史(吸烟: 近1年平均每天吸烟≥1支; 饮酒: 平均每日饮酒≥1次)、合并症(高血压、糖尿病)、体质量指数、入院时Hunt-Hess分级、动脉瘤参数(动脉瘤直径、位置、数量)、手术时机[10](超早期: ≤24 h; 早期: >24~72 h)、手术方式(开颅夹闭、血管栓塞)等资料。基于初次CT特征对患者进行改良Fisher分级,并记录有无合并脑室积血(IVH)。同时,所有患者入院后采集静脉血6 mL行相关实验室检查,详细记录血液样本化验时间、甘油三酯(TG)水平、白细胞计数、中性粒细胞计数、淋巴细胞计数及单核细胞计数等各项化验指标,并计算SIRI[7]。SIRI=单核细胞计数×中性粒细胞计数/淋巴细胞计数。
1.3 统计学方法
采用SPSS 23.0进行数据分析。首先对所有计量资料行正态性检验,符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验; 不符合正态分布的计量资料以[M(Q25,Q75)]表示,比较采用Mann-WhitneyU非参数检验。计数资料以[n(%)]表示,比较采用χ2检验。将P<0.01的变量纳入多因素Logistic回归分析,确定SCVS发生的危险因素。根据多因素分析结果,采用R 3.4.0 软件中的rms安装包建立Nomogram预测模型。最后,绘制受试者工作特征(ROC)曲线评估SIRI及预测模型对SCVS发生的预测价值。检验水准α=0.05, 双侧检验。
2 结 果
2.1 2组患者基本资料比较
19例aSAH患者术后并发SCVS, 发生率为15.20%(19/125)。SCVS组与非SCVS组吸烟、高血压、入院时Hunt-Hess分级、动脉瘤数目、合并IVH、改良Fisher分级、TG、单核细胞计数及SIRI水平有显著差异(P<0.01), 见表1。

表1 SCVS组与非SCVS组患者一般资料比较
2.2 多因素分析
多因素Logistic回归分析显示,合并高血压、入院时Hunt-Hess分级(Ⅳ~Ⅴ级)、合并IVH、改良Fisher分级(IV~V级)、高TG水平和SIRI水平是aSAH患者发生SCVS的独立危险因素(P<0.05), 见表2。
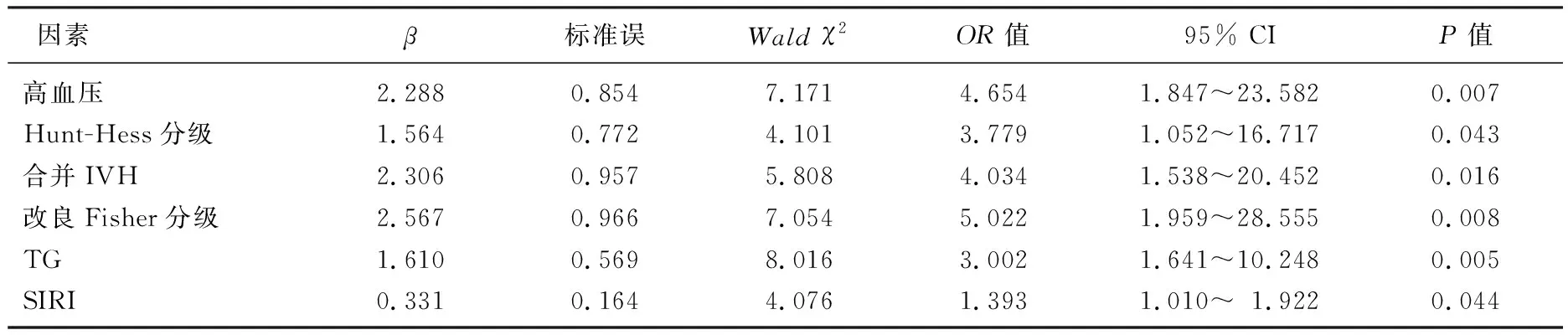
表2 aSAH患者术后发生SCVS的多因素分析
2.3 ROC截断值
绘制ROC曲线确定指标截断值,将连续性变量(TG、SIRI)转化为二分类变量。结果显示,当TG=2.24 mmol/L、SIRI=3.63×109/L时,其约登指数最大(0.312、0.296), 是预测SCVS发生的最佳截断值,同时其预测准确度[ROC曲线下面积(AUC)]、敏感性、特异性、阳性预测值及阴性预测值分别为0.743、72.70%、80.10%、77.53%、94.24%和0.725、70.60%、76.90%、73.49%、93.59%。
2.4 Nomogram预测模型建立及评估
结合多因素分析结果共建个体化 Nomogram预测模型。见图1。经验证该模型具有良好的预测一致性[一致性指数(C-index)=0.685,P<0.01]。ROC分析结果显示,结合SIRI和其他标准变量的模型(AUC=0.896, 95%CI为0.803~0.929,P<0.001)比未结合SIRI的模型(AUC=0.859, 95%CI为0.759~0.912,P<0.001)和仅基于SIRI的模型(AUC=0.725, 95%CI为0.586~0.793,P=0.001)对SCVS具有更佳的预测价值。见图2。进一步行AUC假设检验,发现AUC结合/不结合SIRI模型与AUC仅基于SIRI的模型的差异均有统计学意义(Z=4.029,P<0.001;Z=3.734,P=0.003), 但AUC结合SIRI模型与AUC不结合SIRI模型差异无统计学意义(Z=1.629,P=0.1033)。
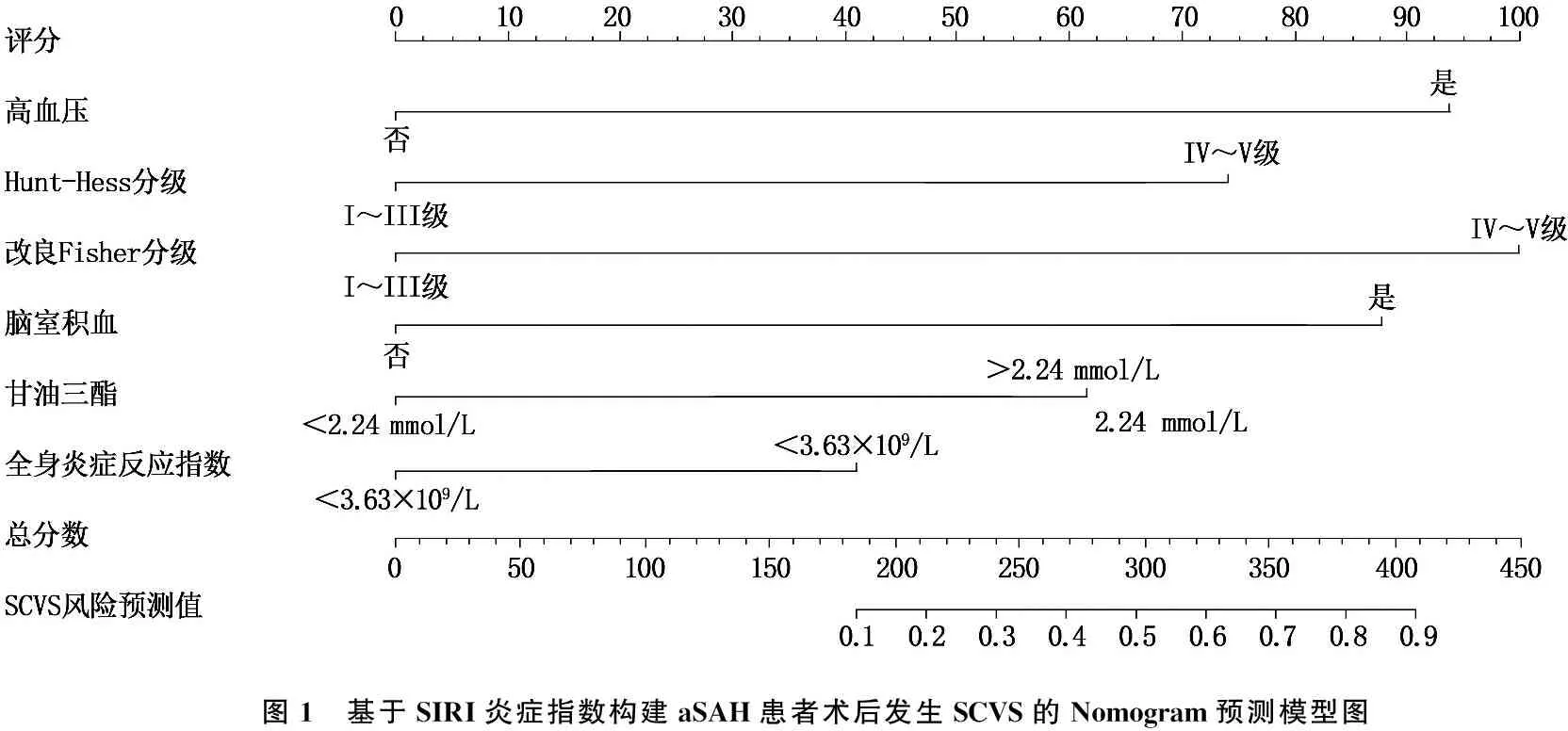
图1 基于SIRI炎症指数构建aSAH患者术后发生SCVS的Nomogram预测模型图
3 讨 论
在SCVS发生、发展过程中,神经炎症反应活动是其重要的第一推动力[1-2, 11]。因此,通过检验各种炎症指标及其动态变化,对了解患者病情、预判SCVS发生具有重要意义。Ma CX等[12]发现Toll样受体4(TLR4)水平是预测aSAH患者发生不良事件的独立危险因素。随着研究的不断深入,核转录因子-кB(NF-кB)、白细胞介素-6(IL-6)等的关键作用也逐步被强调[13]。但这些检测项目需要特殊的仪器设备,且价格较为高昂,临床应用受到限制。
SIRI是基于传统炎症细胞计数的新型复合炎症标志物,能更为全面地反映机体炎症状态;同时,其具有检测方便、重复性强、价格低等优势,已成为预测各类疾病发生、发展及预后的良好因子[7-8, 14]。本研究选取SIRI作为简便、可靠的炎症反应标志物,分析其与SCVS发生的相关性及预测价值,结果显示SCVS组患者入院时SIRI水平显著高于非SCVS组,且Logistic回归分析发现SIRI是SCVS发生的独立危险因素。SIRI是基于外周血中性粒细胞、单核细胞和淋巴细胞绝对值的综合指标,代表了体内不同的炎症免疫途径。高SIRI状态反映了强烈的单核细胞和中性粒细胞介导的促炎症反应及微弱或受抑制的淋巴细胞介导的抗炎症反应,这加重了aSAH后脑血管的病理程度,诱导了SCVS的发生[15]。
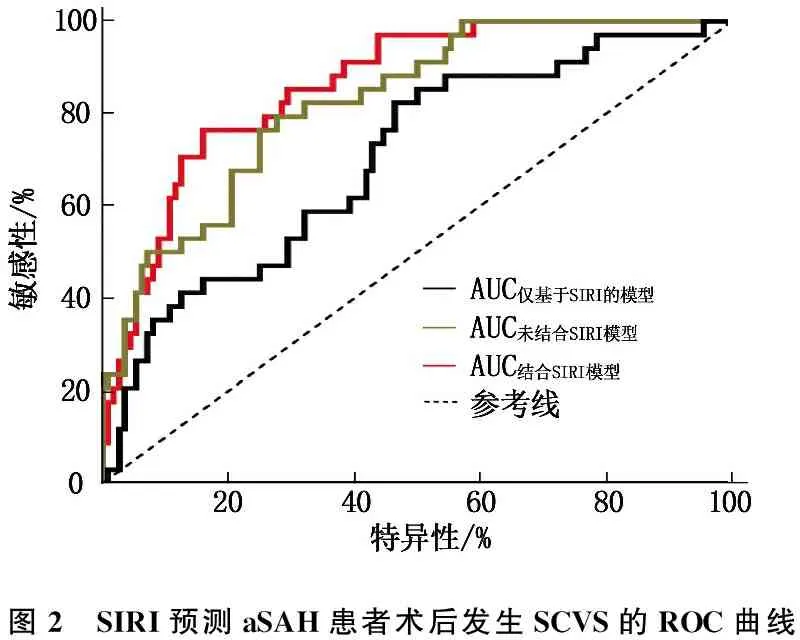
图2 SIRI预测aSAH患者术后发生SCVS的ROC曲线
本研究还通过ROC曲线分析了SIRI对SCVS的预测价值。结果显示, SIRI=3.63×109/L是诊断SCVS发生的最佳截断值。当SIRI>3.63×109/L时,可认为患者存在高炎症状态,有并发SCVS的风险。同时,为了进一步挖掘和可视化SIRI的预测效能,本研究基于SIRI炎症水平及其他相关危险因素共建了SCVS发生的Nomogram预测模型。经验证该模型C-index、ROC曲线下面积均良好,具有可靠的预测效能和一致性,适用于临床。例如,某患者既往有高血压病史、入院时Hunt-Hess分级Ⅳ~Ⅴ级、改良Fisher分级Ⅳ~Ⅴ级、合并脑室积血、TG=1.46 mmol/L、SIRI=4.85×109/L,通过Nomogram模型评分线,该患者总评分积分为365分(94+73+98+87+0+39), 对应的风险预测值为0.754, 即该患者有75.4%的可能性并发SCVS。Nomogram列线图能快速、直观地预判患者SCVS发生概率,实现个体化预测。
在联合或不联合SIRI炎症水平的模型分析中,作者同样发现结合SIRI的危险因素预测模型AUC最大,对SCVS发生具有最佳的预测价值,有助于早期识别和筛查出SCVS高危患者。总之,SIRI作为一种经济、便捷、可重复性强的新型炎症生物标志物,与aSAH术后并发SCVS显著相关; 同时,联合SIRI将优化Nomogram模型预测效能,提高对SCVS发生的早期识别和筛查能力。

