高中化学电解硫酸钠溶液的探讨
◇ 湖北 张 平 胡天娇
高中阶段电解原理部分通常从电极反应、电解质溶液、电子转移、离子迁移、溶液pH 变化、电解后溶液的复原及电解计算等角度进行考查,电解硫酸钠是高中化学的高频考点,常考考点如下.
1 电极材料的影响
1)阴极和阳极都用惰性电极.例如使用石墨电极,则电解硫酸钠的本质是电解水.
阴极反应:2H2O+2e-=H2↑+2OH-.
阳极反应:2H2O-4e-=4H++O2↑.
2)阳极用活性电极.例如使用Cu电极,则电极反应为
阴极反应:2H2O+2e-=H2↑+2OH-.
阳极反应:Cu-2e-=Cu2+.
电解过程中阳极生成的Cu2+向阴极迁移,阴极生成的OH-向阳极迁移,二者相遇,发生反应:

2 电解后溶液浓度的变化
1)所用硫酸钠溶液是不饱和的,两个电极都用惰性电极,则随着电解的进行,不断消耗水,所以溶液浓度增大.
2)所用硫酸钠溶液是不饱和的,阳极用活性电极,例如用Cu作电极,则随着电解的进行,不断消耗水,所以溶液浓度增大.
3)所用硫酸钠溶液是饱和的,两个电极都用惰性电极,则随着电解的进行,不断消耗水,但是温度不变,则溶液浓度不变.
4)所用硫酸钠溶液是饱和的,阳极用活性电极,例如Cu,则随着电解的进行,不断消耗水,但是温度不变,则溶液浓度不变.
3 电解过程中溶液pH 的变化
1)若两极都用惰性电极,则随着电解的进行,阴极附近溶液的pH 升高,阳极附近溶液的pH 降低,整个溶液的pH 不变.
2)若阳极用活性电极,例如使用Cu电极,则随着电解的进行,阴极附近溶液的pH 升高,阳极附近溶液的pH 几乎不变,整个溶液的pH 几乎不变.
4 电解过程中电子的移动方向及离子的迁移方向
1)电子移动方向:从电源负极出发,流向阴极,从阳极回到电源正极.
2)离子迁移方向:阳离子向阴极迁移,阴离子向阳极迁移.
遵循“电子不下水、离子不上岸”原则.
5 电解过程的计算
解答此类问题的关键是搞清楚电极反应,结合氧化还原反应相关知识进行计算.
1)根据电子守恒法计算.阴阳两极产物、正负两极产物等类型的计算,依据是转移的电子数相等.
2)根据总反应式计算.先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算.
3)根据关系式计算.根据得失电子守恒建立已知量与待测量之间的桥梁,列出计算所需的关系式.
4)膜两侧溶液质量变化的计算.注意气体的排出或吸收、沉淀的析出或溶解以及离子的转移.
6 利用离子交换膜获取化工产品
研究发现,利用氯碱工业中的离子交换膜原理电解硫酸钠可以提高经济效益.在高中化学的习题中,也出现了利用离子交换膜电解硫酸钠.
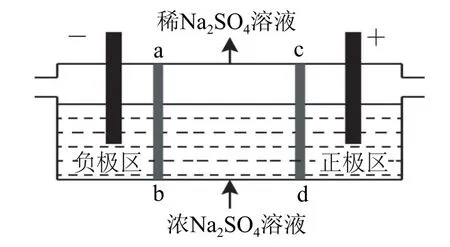
图1
B.该法在处理含Na2SO4废水时可以得到NaOH 和H2SO4产品
C.负极反应为2H2O-4e-=O2↑+4H+,负极区溶液pH 降低
D.当电路中通过1 mol电子的电量时,会有0.5mol的O2生成

由电解原理可知,阴极反应:2H2O+2e-=H2↑+2OH-,阳极反应:2H2O-4e-=4H++O2↑,通过阴离子交换膜移向正极区与H+结合生成H2SO4,故正极区pH 减小,选项A 错误;Na+通过阳离子交换膜移向负极区,与OH-结合生成NaOH,选项B 正确;负极水得电子,选项C 错误;根据关系式1O2~4e-,当电路中通过1mol电子的电量时,会有0.25molO2生成,选项D 错误.答案为B.
A.电解Na2SO4溶液时,电子从电源负极出发经过电解质溶液流向电源正极
B.在25℃时,将两个铜电极插入一定量的硫酸钠饱和溶液中,进行电解,通电一段时间后,阴极逸出a mol气体,同时有W gNa2SO4·10H2O 晶体析出,若温度不变,剩余溶液的质量分数是
C.在电解水时,为了增强导电性,加入的电解质可以选用Na2SO4
D.用惰性电极电解Na2SO4溶液,当阴极产生1mol气体时,可加18g水使溶液恢复

根据“电子不下水,离子不上岸”的原则判断,选项A 说法错误.电解发生的电极反应为Cu-2e-=Cu2+(阳极),2H2O+2e-=H2↑+2OH-(阴极).电解的总化学方程式为Cu+2H2O=Cu(OH)2↓+H2↑.阴极逸出a molH2,水被电解了2a mol,即析出的W g Na2SO4·10H2O 溶解在2a mol水中恰好是25℃的饱和溶液,该溶液中溶质的质量分数与剩余溶液中溶质的质量分数相等.晶体中硫酸钠质量为142W/322=71W/161,阴极逸出的a mol气体为氢气,故电解了的水质量为18ag.显然,25℃时,将W gNa2SO4·10H2O 溶入18ag水中,则恰好为饱和溶液,其溶质质量分数为(晶体中硫酸钠质量)/(晶体质量+电解反应了的水的质量),选项B说法正确.加入Na2SO4,增大溶液浓度,导电性增强,且不影响H2和O2的生成,选项C 说法正确.用惰性电极电解Na2SO4溶液,由于溶液中阴离子的放电顺序为OH->,放电的为OH-,阳离子放电顺序为H+>Na+,放电的为H+,故实质为电解水,当阴极产生1molH2时,有2mol电子转移,可加入18g水恢复,选项D 说法正确.答案为A.
A.电极a连接电源的正极
B.B为阳离子交换膜
C.电解质溶液采用Na2SO4溶液可避免有害气体的产生
D.Ⅱ排出的是淡水

图2

根据题干信息确定该装置为电解池,阴离子向阳极移动,阳离子向阴极移动,所以电极a为阳极,连接电源的正极,选项A 说法正确.水在双极膜A 解离后,氢离子吸引阴离子透过B膜到左侧形成酸,B为阴离子交换膜,选项B 说法错误.电解质溶液采用Na2SO4溶液,电解时生成H2和O2,可避免有害气体的产生,选项C 说法正确.海水中的阴、阳离子透过两侧交换膜向两侧移动,淡水从Ⅱ口排出,选项D 说法正确.答案为B.
本文归纳总结了高中化学习题中有关电解硫酸钠的常考考点,对比分析,帮助学生更好地解决问题,加深对电解原理的理解.


