增强CT 联合血小板和淋巴细胞比值及CA199对胆管内乳头状黏液性肿瘤与肝内胆管结石合并胆管炎的鉴别诊断价值
董 芸,吴健伟,袁峥玺,姚 原
(上海交通大学医学院附属第九人民医院 放疗科,上海201999)
胆管内乳头状黏液性肿瘤(BT-IPMN)是一类罕见的胆管囊性肿瘤,与胰管内乳头状黏液性肿瘤类似,该肿瘤起源于胆管的上皮细胞,可以分泌大量黏液,并可以沿着肝内外胆管爬行生长[1]。由于BT-IPMN的这种特征,常常导致肝内外胆管的反复梗阻及广泛扩张,继而引起腹痛、发热、黄疸等症状,其临床症状及影像学表现与肝内胆管结石合并胆管炎难以鉴别。作为一种交界性肿瘤,BT-IPMN具有进展至侵袭性癌的能力,长期反复发作的胆管炎症刺激在其中可能扮演了重要角色[2]。本研究回顾性分析了16例经术后病理证实的BT-IPMN患者以及23例肝内胆管结石合并胆管炎患者的临床及影像学资料,探讨其增强CT表现与血小板与淋巴细胞比值(PLR)、肿瘤标志物(CA199,CA242以及CEA)对该两种疾病鉴别诊断的临床价值,为临床诊疗提供新的依据。
1 资料与方法
1.1 一般资料
回顾性收集本院收入的16例BT-IPMN患者的临床资料,其中男性8例,女性8例,年龄47-86岁,中位年龄64岁。所有患者均经术后病理证实为BT-IPMN,病灶均为胆管来源,排除胰腺导管及十二指肠壶腹部周围来源。同时收集了23例经术后病理证实为复发性化脓性胆管炎的患者作为对照组,其中男性9例,女性14例,年龄23-69岁,中位年龄63岁。排除6周内使用糖皮质激素类药物、白介素、集落刺激因子等影响血常规检查药物的患者,同时排除合并其他肿瘤、感染以及血液病等可能影响检查结果的疾病患者。
1.2 增强CT检查及图像分析
使用CT检查设备为GE Light speed 64排螺旋CT,所有患者均呈仰卧位行平扫及上腹部增强扫描,扫描范围为膈顶部至双肾下极水平,扫描参数为管电压120 kV,管电流200 mAs,层厚5 mm。平扫之后进行增强扫描,扫描前使用高压注射器经肘静脉注射优维显(碘普罗胺)注射液(1.5 ml/kg),扫描采集时间为:肝动脉期延迟25 s,门静脉期延迟65 s。
CT图像判读由2名有经验的影像学医师在未知病理结果的条件下共同进行,主要观察(1)病变的数量、位置、形态、密度及强化方式;(2)胆管扩张的范围及程度;(3)肿瘤对于邻近器官、组织的侵犯情况,以及远处转移及淋巴结转移情况;(4)出现合并胆管结石的情况。
1.3 血常规及血清CA199,CA242、CEA的检测
患者手术前空腹状态下分别采集静脉血1.8 ml置入EDTA-K2抗凝管及3 ml置入真空采集管中,前者进行血常规检测,后者分离血清进行CA199,CA242、CEA的检测。
血常规检测使用美国Beckman Coulter公司的GEN-S血液分析仪,血清CA199,CA242、CEA检测使用美国Roche公司Cobas E601全自动电化学发光免疫分析仪。检测试剂及质量控制均使用仪器配套试剂。
1.4 统计学分析
采用SPSS 19.0软件进行分析,等级资料使用秩和检验进行比较,计数资料使用卡方检验以及确切概率法进行比较,各种检查及检测手段的比较使用受试者工作曲线(ROC)的曲线下面积(AUC)进行比较。P<0.05则认为差异具有统计学意义。
2 结果
2.1 临床表现
胆管内乳头状黏液性肿瘤患者16例,平均年龄66.56±12.91岁,首诊时有腹痛或腹部不适症状者12例,有黄疸者4例,有发热者2例,有呕吐症状者2例,常规体检发现而无明显不适症状者2例。
对照组肝内胆管结石合并胆管炎患者23例,平均年龄54.91±14.45岁,首诊时绝大多数患者有腹痛或腹部不适症状者(22例),有黄疸者4例,有发热者5例,有呕吐症状者2例。
胆管内乳头状黏液性肿瘤患者的年龄较大(P=0.015),病程较长(P=0.002)。两种疾病最常见的症状均为腹痛或腹部不适,少数患者会出现Charcot三联征(腹痛、高热、黄疸),但几种常见的临床表现相比较均无明显的统计学差异(表1)。

表1 BT-IPMN及肝内胆管结石合并胆管炎一般特征及临床症状对比
2.2 影像学表现
胆管内乳头状黏液性肿瘤的典型CT表现为不同程度扩张的胆管内软组织结节或肿块,而肝内胆管结石合并胆管炎的主要影像学表现为肝内胆管单发或多发结石伴胆管不同程度的扩张。本研究中有一半的BT-IPMN患者可见胆管内结节或肿块(8例),形态多变,可表现为类圆形、条状或是不规则的珊瑚状,增强后可见不同程度的强化。BT-IPMN胆管狭窄的位置多位于肝门处胆管,但与肝内胆管结石合并胆管炎比较未见明显的差异(P=0.752)。所有患者均可见不同程度的胆管扩张,但BT-IPMN胆管扩张的范围较为广泛,多数可以引起肝内胆管的广泛扩张,而肝内胆管结石合并胆管炎造成肝内胆管的扩张程度常常较为局限,仅累及肝脏的某一叶或段(P=0.019)。并且BT-IPMN胆管扩张的位置不仅仅局限于肿瘤的上游胆管,其下游胆管亦常常受累,对照组肝内胆管结石合并胆管炎扩张胆管的位置常常位于狭窄位置的上游,其下游胆管较少受累(P<0.001)。BT-IPMN及肝内胆管结石合并胆管炎均可出现局部胆管壁增厚及强化的征象(P=0.200及P=0.516),见表2。
继发征象中,肝内胆管结石合并胆管炎较常见到胆管内结石的出现,可为多发或单发,但BT-IPMN亦可见到结石(P=0.307);部分BT-IPMN及肝内胆管结石合并胆管炎患者可见梗阻区域的肝实质出现轻度强化(P=0.711)。局部肝实质的萎缩及肝包膜的回缩在BT-IPMN患者中相对较为常见(P=0.008及P=0.002)。本研究中少数BT-IPMN及肝内胆管结石合并胆管炎患者可见区域淋巴结的肿大,但术后病理证实均为慢性炎症所致,所有BT-IPMN患者均无远处转移征象,见表2。
2.3 实验室检查
BT-IPMN患者的血小板计数及PLR值高于肝内胆管结石合并胆管炎患者(P=0.026及P=0.026),但淋巴细胞计数的差异没有统计学意义。BT-IPMN患者的血清CA199,CA242及CEA均高于肝内胆管结石合并胆管炎患者,但仅有CA199的差异具有统计学意义(P<0.001),见表3。
2.4 ROC曲线分析
影像学表现、PLR及CA199鉴别诊断BT-IPMN及肝内胆管结石合并胆管炎的ROC曲线下面积(AUC)等参数见表4。其AUC分别为0.673,0.690和0.617,敏感度分别为56.25%,75.00%以及43.75%,特异度分别为78.26%,65.22%以及86.96%。PLR的截断值为111.54,CA199的截断值为62.31 U/L。影像学表现联合PLR以及CA199的AUC分别为0.736和0.712,联合三种指标进行鉴别诊断的AUC为0.764。影像学表现联合PLR进行鉴别诊断两种疾病的敏感度为89.06%,特异度为51.04%;影像学表现联合CA199进行鉴别诊断两种疾病的敏感度为75.39%,特异度为68.05%;三种诊断方法联合使用时,敏感度为93.84%,特异度为44.38%。

表2 BT-IPMN及肝内胆管结石合并胆管炎的增强CT检查对比

表3 BT-IPMN及肝内胆管结石合并胆管炎患者部分血常规指标及血清肿瘤指标的对比

表4 增强CT,PLR及CA199鉴别诊断BT-IPMN及肝内胆管结石合并胆管炎的ROC曲线分析
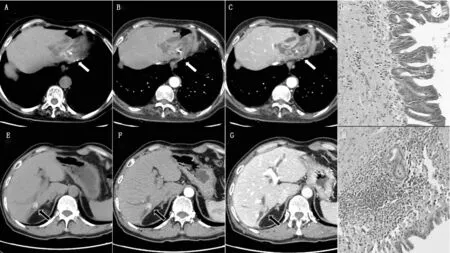
图1 BT-IPMN及肝内胆管结石合并胆管炎的CT图像及病理(200倍)
(A-D)为BT-IPMN患者,女,83岁,可见肝左叶胆管明显扩张,部分胆管内可见不规则稍高密度影,增强后强化不明显,另可见致密小结节,肝左叶肝实质萎缩(A:CT平扫,B:CT增强动脉期,C:CT增强门脉期)。术后病理证实为肝内胆管乳头状黏液瘤,邻近胆管壁纤维组织增生及慢性炎症(D)。(E-H)为肝内胆管结石合并胆管炎患者,男,64岁,可见肝右叶胆管内不均匀高密度结节伴胆管扩张,增强后未见明显强化(E:CT平扫,F:CT增强动脉期,G:CT增强门脉期)。术后病理证实为肝内胆管结石伴胆管壁及邻近肝实质炎性细胞浸润(H)。
3 讨论
与临床上常见的肝内胆管结石合并胆管炎相比,BT-IPMN的临床症状及影像学表现常常缺乏特异性,在术前误诊率较高。肿瘤分泌大量黏液并造成胆管扩张是BT-IPMN引起临床症状的原因,而肝内胆管结石合并胆管炎亦可以表现为反复的胆管梗阻及其引起的胆管扩张,因此两种疾病均可表现为上腹部疼痛、黄疸、发热等症状[3]。虽然BT-IPMN是一类较为罕见的胆管肿瘤,目前也没有形成共识的标准治疗流程,但由于其存在恶性风险,临床上仍以外科手术切除为首选治疗方式[4]。因此在术前正确鉴别诊断BT-IPMN并早期进行手术干预具有重要意义。
既往研究认为,BT-IPMN好发于55-65岁的老年人,发病率与性别无关,这与本研究一致,而肝内胆管结石合并胆管炎患者年龄较小。多数BT-IPMN患者与肝内胆管结石合并胆管炎患者的临床症状均以腹痛或腹部不适为主,部分患者会出现黄疸、发热等急性胆管炎的症状,少数BT-IPMN可以没有任何临床症状,体检时偶然发现肿瘤。从发病时间来看,BT-IPMN的病程较长,这可能与它的发病机制有关,有研究认为BT-IPMN的病因是结石、寄生虫等长期刺激因素引起胆管慢性炎症所致的继发性胆管上皮异型增生甚至癌变[5]。总体来讲,单纯从临床症状无法鉴别这两种疾病。
BT-IPMN具有一些特征性的影像学表现,直接征象为扩张的肝内胆管中见到附壁结节或肿块[6]。但是在临床工作中,体积较小的结节常常与胆管内结石难以鉴别,尤其是强化不明显的结节。另外,BT-IPMN的肿瘤形态多变,部分患者可表现为扁平状甚至绒毛状,目前术前常规CT很难发现[7,8]。本组患者中,有一半的患者(8例)无法发现胆管内结节/肿块。胆管扩张的范围亦可作为鉴别诊断的依据,有学者将BT-IPMN按照胆管扩张情况分为4型:(1)局部肝叶或段胆管扩张型;(2)胆管动脉瘤样扩张型;(3)胆管弥漫扩张伴占位型;(4)胆管弥漫扩张不伴占位型[9,10]。本研究可见BT-IPMN的胆管扩张范围较胆管结石所致的大(P=0.019),多数为弥漫性扩张(13例),患者胆管扩张的程度也较高,这是由于BT-IPMN分泌的大量黏液阻塞胆管所致,可导致胆管扩张的范围和程度均高于胆管结石。BT-IPMN与结石所致的胆管扩张的另一个差异之处在于结石一般仅能够导致其上游胆管扩张,而BT-IPMN可引起肿瘤上下游胆管均扩张,这也是肿瘤分泌的大量黏液栓子所致[11]。肝内结石合并胆管炎与BT-IPMN在增强CT图像上均可见到局部胆管壁的增厚及强化,前者则是处于活动期的胆管炎症所致的病理表现,后者可能由于肿瘤累及,也可能是局部胆管炎症所致[12,13],就本组病例而言,没有在CT图像中发现明显差异。
此外,BT-IPMN患者由于长期的胆管闭塞,胆汁流动不畅,常常出现继发性的胆管结石,这也增加了鉴别诊断的难度。BT-IPMN的肿瘤区域邻近肝实质常常由于炎症可出现轻度强化,这与肝内胆管结石合并胆管炎的表现也十分相似。本组病例中,多数BT-IPMN患者出现了局部肝实质萎缩(n=14)以及肝包膜的回缩(n=15),多位于肿瘤所在区域,考虑这是由于肿瘤或者肿瘤分泌的黏液长期压迫导致邻近肝组织血液回流不畅所致。由于BT-IPMN的恶性程度较低,淋巴结及远处转移较为少见,本组患者中3例出现区域淋巴结的肿大,但术后病理均证实为炎性病变,未见有远处转移的患者。
总体来讲,单凭术前常规增强CT检查鉴别诊断BT-IPMN与肝内胆管结石合并胆管炎这两种疾病的应用价值有限,敏感度不足,ROC曲线分析显示其AUC为0.673,敏感度为56.25%,特异度为78.26%。因此,寻找一种有效的补充诊断指标具有重要的意义。正如前所述,炎症在BT-IPMN的发生、发展中起到了重要作用。近年来,有研究发现PLR作为一种炎性反应指标,与多种肿瘤的病理特征、分级、分期以及预后有着密切的关系[14,15]。肿瘤患者常常出现血小板的增高,促进了肿瘤细胞的转移[16],而淋巴细胞的减少则导致了机体免疫能力的下降,有助于肿瘤细胞的增殖与转移[17]。因此,PLR的升高体现了肿瘤的发展过程。本研究中,BT-IPMN患者的PLR高于肝内胆管结石合并胆管炎患者,前者的血小板水平明显高于后者,但两者的淋巴细胞计数未见明显差异,这也从侧面表现了炎性因子在BT-IPMN的发生发展中具有一定的作用。2组患者的肿瘤标志物CA242及CEA水平无明显的统计学差异,但BT-IPMN患者的CA199水平明显高于肝内胆管结石合并胆管炎患者。既往研究认为,约有60%的BT-IPMN患者CA199水平高于正常参考值,仅有少数患者CA242和CEA水平增高[4,18],这与本研究的结果一致,考虑BT-IPMN患者CA199的水平升高与胆管炎症及梗阻相关。
虽然PLR与CA199均具有一定的鉴别诊断BT-IPMN与肝内胆管结石合并胆管炎价值,但单独应用价值有限,ROC曲线分析前者的AUC为0.690,后者为0.617。而增强CT的影像学表现及PLR或CA199联合鉴别诊断的ROC曲线AUC有所增高,分别为0.736和0.712,综合三种诊断方法的ROC曲线AUC最高,为0.764。影像学诊断联合PLR及CA199的鉴别诊断的敏感度均较单一指标有所增高,联合三种方法进行诊断可以明显提升敏感度,达93.84%。所以影像学检查联合PLR及CA199检测对两种疾病的鉴别诊断具有一定的价值。
本研究存在一定的局限性,由于BT-IPMN较为罕见,病例数较少,可能对研究结果造成一定的偏差,也无法对恶性BT-IPMN的鉴别诊断进行进一步的分析,这需要在今后的研究工作中增加样本量进一步研究。
总之,BT-IPMN与肝内胆管结石合并胆管炎在临床症状及影像学表现上存在一定的相似性,利用术前增强CT检查发现弥漫扩张的胆管以及胆管内结节或肿块等BT-IPMN的特征性征象可以进行鉴别诊断。而在临床工作中,利用PLR及CA199与增强CT进行联合诊断可以提高鉴别诊断能力。

