类风湿关节炎患者 TNF-α 表达水平及其基因 rs1800629 位点多态性分析
郭燕 刘小君 许海涛
类风湿关节炎 ( rheumatoid arthritis,RA ) 是以炎性滑膜炎为主的一种慢性风湿免疫性疾病,是中青年人群常见的一种自身免疫性疾病,全球人群发病率约为 1%~3%,且呈逐年上升趋势。RA 是一种致残性关节病,具有较高的致残率,如不积极进行有效治疗,约 50% 的 RA 患者在确诊后 10 年内将会丧失劳动能力[1-2],严重影响患者生活质量[3-7],给家庭与社会带来沉重负担。因此,对 RA 进行早期诊断、治疗及预防对提高治疗效果、降低致残率及预防 RA 的发生具有重要的意义。
RA 病因十分复杂,有研究表明 RA 发病与自身免疫、感染及遗传等诸多因素有关,且与多种细胞因子及蛋白的表达水平异常有关[7-11],其中遗传基因突变在 RA 发生和发展中起了重要的作用。肿瘤坏死因子 ( tumor necrosis factor,TNF ) 是由巨噬细胞对免疫源反应所产生的一种趋炎症细胞因子,其水平高低与炎性反应有密切相关,且 TNF 基因多个位点突变均可能影响 TNF 蛋白的表达。有研究表明,TNF 表达及其基因位点突变在 RA 发病中发挥了重要的作用[12-14]。因此,本研究通过对 RA 患者和健康人群血清中 TNF 表达及其基因 rs1800629 位点的多态性进行了调查分析,旨在探索其与 RA 发病之间的关系,现报道如下。
资料与方法
一、研究对象
收集 2017 年 6 月至 2019 年 7 月来医院诊断并确诊为 RA 患者 152 例,其中男 59 例,女 93 例,年龄 31~65 岁,平均 ( 49.26±15.74 ) 岁。RA 诊断标准参照 2010 美国风湿病协会和欧洲抗风湿病联盟 ( ACR / EULAR ) 分类诊断标准[2],排除合并其它风湿病 ( 如系统性红斑狼疮、干燥综合征及严重的膝骨关节炎 )、心脑血管、肝肾、血液系统等严重疾病者及妊娠、哺乳期妇女和有精神异常者。同时选择同期本区健康人群 107 例,其中男 31 例,女 76 例,年龄 29~66 岁,平均 ( 47.98±17.65 ) 岁,均无 RA 家族史、无 RA 早期及其它关节炎临床表现,类风湿因子 ( rheumatoid factor,RF ) 和抗环瓜氨酸肽 ( cyclic citmllinated peptide,CCP ) 抗体均阴性。确保两组研究对象的年龄、性别等一般性资料比较具有可比性,差异无统计学意义 ( P>0.05 )。本研究经医院伦理委员会同意批准,同时经同患者及家属知情,并签订知情同意书。
二、仪器与试剂
ABI7500 PCR 基因扩增仪 ( 美国 ABI 公司提 供 );DNA 提取试剂 ( 深圳亚能生物技术有限公司提供 );TNF-α 试剂盒 ( 深圳市科润达生物工程有限公司提供 );AE275 全自动免疫分析仪 ( 深圳爱康科技有限公司提供 )。
三、方法
1. 标本采集:均于清晨采用一次性采血针采集研究对象空腹静脉血 4~5 ml,其中 2 ml 加入 EDTA-K2 抗凝管内混匀用于全血 DNA 提取,剩余的加入一次性无抗凝剂的干燥管内,室温静置 30 min,然后于离心机内离心分离血清,用于 TNF-α 水平测定。
2. TNF-α 水平检测:采用酶联免疫吸附法 ( enzyme-linked immuno sorbent assay,ELISA ) 检测 TNF-α 水平,检测前对相应的仪器进行保养、校准,并同时设置于质控、空白及阴阳孔,待这些孔的光密度 ( optical density,OD ) 值均在有效值内才对实验结果进行判断,否则要重复检测。所有操作均严格按照试剂盒和仪器说明书及科室的标准操作程序 ( standard operating procedure,SOP ) 操作规程进行。同时所有标本检测在相同条件下进行,确保检测结果的可比性。
3. 全血 DNA 提取:全血 DNA 提取采用深圳亚能生物技术有限公司提供的试剂盒,所有操作均严格按照试剂盒及仪器说明书进行,提取后 DNA 的浓度和纯度采用紫外分光光度仪进行检测,确保合格后置于 -20 ℃ 保存用于 TNF-α 基因多态性分析。
4. 多态性分析:( 1 ) 引物设计:TNF-α 基因 rs1800629 位点正向引物序列为 5'-TGT CAT TCA GTT CCC TCC TC-3',反向引物序列为 5'-GAG CGT CTG CTG GCT GGG TG-3';( 2 ) PCR 反应体系:总反应体系为 25 µl,其中 DNA 模板 5 µl,Go Tag 混合酶 12.5 µl ( 包括 Taq DNA 聚合酶,dNTP,10×PCR缓冲液 ),正、反向引物各 0.25 µl,加入无菌去离子水至 25 µl 后混匀;( 3 ) PCR 扩增条件:94 ℃ 预变性 5 min,然后以 94 ℃ 45 s → 60 ℃ 30 s → 72 ℃ 45 s,共反复循环 35 次,最后 72 ℃ 延伸 10 min; ( 4 ) 限制性酶切:取 25 µl PCR 扩增的产物,加入 25 µl 限制性内切酶 Nco I,1 µl 的 10×NEB 缓冲液,0.1 µl 的 100×牛血清白蛋白,用无菌去离子水加至 100 µl,混匀,于 65 ℃ 水浴 2 h;( 5 ) 电泳:取 10 µl 酶切产物经 2% 琼脂糖凝胶电泳后判读酶切结果。
5. 判读标准:于 87 bp 和 20 bp 处出现 2 条电泳带为 GG 的基因型,于 107 bp、87 bp 和 20 bp 处出现 3 条电泳带为 GA 的基因型,仅于 107 bp 处出现 1 条电泳带为 AA 的基因型。
6. 基因测序:随机抽取部分 TNF-α 基因 rs1800629 位点 PCR 扩增产物送至深圳华大基因科技有限公司进行基因测序。
四、统计学处理
采用 GraphPad Prism 5 软件对所测数据进行统计学分析,计量资料采用表示,组间比较采用t检验;计数资料采用率 ( % ) 表示,组间比较采用χ2检验。P<0.05 为差异有统计学意义。
结 果
一、两组血清中 TNF-α 水平比较
RA 患者血清中 TNF-α 水平为 ( 39.16±11.05 ) pg / ml,明显高于健康对照组的 ( 18.72±5.94 ) pg / ml,差异有统计学意义 (t=3.9524,P<0.05 )。
二、两组 TNF-α 基因 rs1800629 位点基因型及等位基因检出率比较
RA 患者血清中 TNF-α 基因 rs1800629 位点的 GG 基因型和 G 等位基因检出率分别为 71.72% 和 81.91%,明显高于健康对照组的 24.30% 和 33.18%,差异有统计学意义 (χ2=3.9547~5.0521,P<0.05 ) ( 表1 )。
三、电泳结果
取 PCR 扩增产物的酶切产物于 2% 琼脂糖凝胶电泳后 TNF-α 基因 rs1800629 位点可出现 3 种电泳结果:GG 基因型的 PCR 产物因含 Nco I 酶切位点,完全酶切,于 87 bp 和 20 bp 处出现 2 条电泳带,GA 基因的 PCR 产物不完全酶切,于 107 bp、87 bp 和 20 bp 处出现 3 条电泳带,而 AA 基因型的 PCR 产物不产生酶切,仅于 107 bp 处出现 1 条电泳带,结果见图1。
四、PCR 扩增产物酶切电泳结果
对 TNF-α 基因 rs1800629 位点 PCR 扩增产物进行抽样部分基因测序,结果见图2、3。
五、不同基因型 RA 患者血清中 TNF-α 水平 比较
携带 GG 基因型 RA 患者血清中 TNF-α 水平为 ( 48.19±15.03 ) pg / ml,明显高于 GA 和 AA 基因型的 ( 34.25±9.85 ) pg / ml 和 ( 26.57±7.02 ) pg / ml,差异有统计学意义 (t=2.8472~3.5165,P<0.05 )。
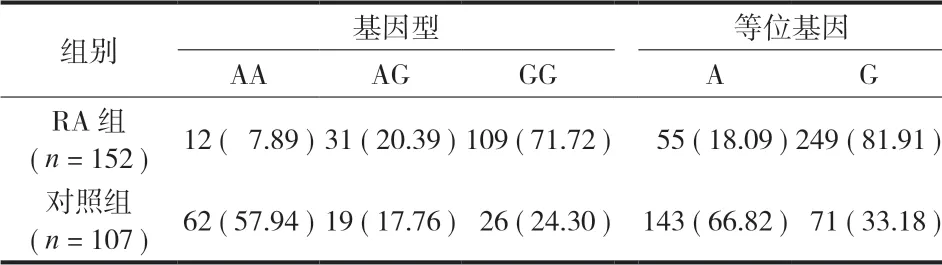
表1 RA 组和对照组 TNF-α 基因 rs1800629 位点基因型及等位基因检出率比较 [ n ( % ) ]Tab.1 Comparison of genotypes and allele detection rates of TNF- gene rs1800629 in RA group and control group [ n ( % ) ]
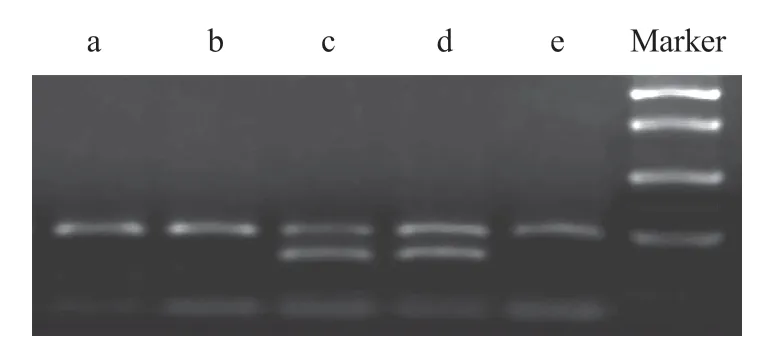
图1 TNF-α 基因 rs1800629 位点 PCR 扩增产物电泳图 ( a:AA 基因型;b、e:GG 基因型;c、d:GA 基因型;Marker:标记物 )Fig.1 Electrophoresis of the PCR product from TNF-gene rs1800629 ( a: AA genotype; b, e: GG genotype; c, d: GA genotype; Marker: the marker )
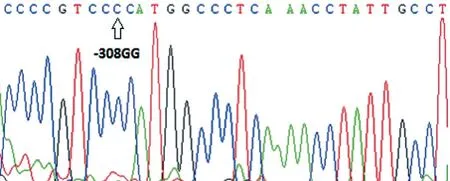
图2 TNF-α 基因 rs1800629 位点 GG 基因型反向测序图Fig.2 Reverse sequencing of GG genotype of TNF- gene rs1800629

图3 TNF-α 基因 rs1800629 位点 GA 基因型反向测序图Fig.3 Reverse sequencing of GA genotype of TNF- gene rs1800629
讨 论
TNF-α 是由巨噬细胞对细菌感染或其它免疫源反应自然产生的一种促炎细胞因子,也可由 T 细胞和 NK 细胞在某些刺激因子如丙二醇甲醚醋酸酯 ( propylene glycol methyl ether acetate,PMA ) 诱导下而产生。TNF-α 主要功能是杀伤和抑制肿瘤细胞,促进中性粒细胞吞噬,促进髓样白血病细胞向巨噬细胞分化,促进细胞增殖和分化,并参与某些自身免疫病的发生和发展。研究表明,TNF-α 能通过激活 NF-KB 和 JNK 信号通路,诱导黏附分子表达、吸引和激活机体内中性粒细胞,形成吞噬免疫复体,引发炎症,导致滑膜细胞增生,并诱导滑膜细胞分泌胶原酶和前列腺素 E-2,形成类风湿性血管翳而参与 RA 发病,其水平在 RA 患者血清中明显升 高[15-16]。本研究结果显示,深圳地区 RA 患者血清中 TNF-α 水平明显高于健康人群,差异有统计学意义 ( P<0.05 ),与施利青等[17]和梁朝洋[18]报道的基本一致,这可能与 RA 患者受累的关节滑膜内存在大量炎症细胞浸润,这些细胞分泌多种细胞因子有关。
RA 发病机制十分复杂,目前尚未完全阐明,随着分子技术的不断发展及对该疾病不断深入的研究发现,人体内多种基因位点多态性突变均可能增加 RA 发病的易感性,与 RA 疾病的发生、发展及预后判断具有显著相关性[19-20]。TNF-α 位于人体 6 号染色体短臂上的 TNF 基因编码,TNF 基因位于 HLA-III 区域,在 HLA-I 和 HLA-II 区域之间,由 157 个氨基酸残基组成,分子量为 17 kDa。有研究表明,TNF-α 基因启动子区域上多个位点突变与 RA 发病有关,且 TNF-α 基因位点突变存在区域性和种族性,如 Song 等[21]研究发现拉丁美洲人群中 TNF-α 基因 rs1800629 位点基因突变与 RA 发病有显著相关性,而在亚洲、欧洲及阿拉伯人群中没发现相关性,但李芬等[12]报道 TNF-α 基因 rs1800629 位点突变与湖南地区 RA 发病有关,而 Aranda 等[22]报道与 RA 无相关。本研究结果显示,深圳地区 RA 患者血清中 TNF-α 基因 rs1800629 位点 GG 基因型和 G 等位基因检出率明显高于对健康人群,差异有统计学意义 ( P<0.05 ),这表明 TNF-α 基因 rs1800629 位点突变可能与本地区 RA 发病有密切相关,且携带 GG 基因型的 RA 患者血清中 TNF-α 水平明显高于其它基因型,差异有统计学意义 ( P<0.05 ),这可能与 TNF-α 基因 rs1800629 位点突变导致炎症细胞分泌 TNF-α 能力增强有关。
综上所述,RA 患者血清中 TNF-α 水平明显升高,TNF-α 基因 rs1800629 位点 GG 基因型和 G 等位基因检出率明显高于对健康人群,且携带 GG 基因型的 RA 患者血清中 TNF-α 水平明显高于其它基因型,表明 TNF-α 基因 rs1800629 位点突变可能与深圳地区 RA 发病有一定的相关。

