不同空气暴露条件下四川泡菜的品质变化及产植物细胞壁降解酶微生物分析
钱 杨,吴李川,许童桐,沈秋霞,袁 洋,饶 瑜
(1.四川工商职业技术学院,四川成都 611830; 2.西华大学食品与生物工程学院,四川成都 610039)
四川泡菜历史悠久,以味道咸酸、口感脆生、色泽鲜亮、香味扑鼻而著称,被称为“川菜之骨”[1]。四川泡菜的制作是以各种新鲜蔬菜为原料,在一定盐浓度溶液中经以乳酸菌为主的复杂微生物体系(由蔬菜和辅料等带入)在相对封闭的池或坛中自然发酵得到[2]。而在实际生产过程中,常存在空气渗入发酵环境的可能,空气中的氧气是发酵蔬菜中腐败微生物生长的重要条件之一[3]。四川泡菜的发酵由乳酸菌主导完成,在无氧的条件下乳酸菌进行乳酸发酵,产生乳酸降低四川泡菜的pH,形成独特的泡菜鲜香味。空气的渗入不但对乳酸发酵无益,反而会促进某些好氧微生物的生长,造成四川泡菜中微生物菌群失衡,影响四川泡菜品质。
四川泡菜品质改变主要表现为盐卤pH上升、产生恶臭味和腐败膜醭以及蔬菜软腐等[4],其中蔬菜软腐是由于腐败微生物能够分泌植物细胞壁降解酶(Plant cell wall degradation enzymes,PCWDEs),如聚半乳糖醛酸酶、纤维素酶、果胶酶、蛋白酶、木聚糖酶、淀粉酶等[5],PCWDEs能够软化植物组织,破坏四川泡菜质构影响四川泡菜品质[6]。蔬菜软腐一般是产PCWDEs微生物群体共同作用的结果[7],空气暴露情况不同,四川泡菜中的微生物群体组成种类存在差异[8],导致产PCWDEs微生物种类不同,但目前尚无不同空气暴露条件下四川泡菜中产PCWDEs微生物的相关研究。
鉴于此,本文采用发酵坛口暴露、间歇暴露和封闭三种空气暴露程度分别模拟四川泡菜发酵过程中空气暴露情况,以探究不同空气暴露条件对四川泡菜发酵过程中品质的影响,并分析比较不同空气暴露条件下产PCWDEs微生物种类的差异,以期为四川泡菜生产过程中的品质控制提供参考。
1 材料与方法
1.1 材料与仪器
新鲜红皮萝卜(约重150 g/个) 成都某菜市场;泡菜发酵菌株:植物乳杆菌E11(LactobacillusplantarumE11) 本实验室前期分离并保藏,用于四川泡菜发酵[9],使用前由MRS培养基活化培养;盐酸(分析纯)、乙酸钠、磷酸钠、可溶性淀粉、CaCl2成都科龙化工试剂厂;羧甲基纤维素 西亚化工股份有限公司;木聚糖 北京索莱宝科技有限公司;多聚半乳糖醛酸 上海源叶生物科技有限公司;酵母提取物、MRS琼脂培养基、虎红琼脂培养基、胰蛋白胨大豆琼脂培养基(Tryptone soy,TSA)、胰蛋白胨大豆肉汤培养基(Tryptone soy broth,TSB) 北京奥博星生物技术有限责任公司;Tri-HCl Amresco公司;EDTA 天津市致远化学试剂有限公司。
TA-XT Plus质构分析仪 英国Stable Micro System有限公司;Multifuge XIR台式冷冻离心机 赛默飞世尔科技(中国)有限公司;Mastercycler ep grad PCR仪 美国Bio.Rad公司;Gel Doc EQ凝胶成像系统 美国Bio.Rad公司;DYY-2电泳仪 北京六一仪器厂;G154DWS全自动高压灭菌锅 致微(厦门)仪器有限公司;pHS-3C酸度计 成都世纪方舟科技有限公司。
1.2 实验方法
1.2.1 培养基的配制 蛋白酶(Protease)鉴别培养基:以TSA培养基为基础,添加质量分数为1%的脱脂牛奶;淀粉酶(Amylase)鉴别培养基:以TSA培养基为基础,添加质量分数为1%的可溶性淀粉;纤维素酶(Cellulase)鉴别培养基:以TSA培养基为基础,添加质量分数为0.1%的羧甲基纤维素,25 mmol/L磷酸钠,pH7.0;木聚糖酶(Xylanase)鉴别培养基:以TSA培养基为基础,添加质量分数为1%的木聚糖,25 mmol/L磷酸钠,pH7.0;果胶酶(Pectate lyase)鉴别培养基:以TSA培养基为基础,添加质量分数为1%的多聚半乳糖醛酸(Polygalaconic acid,PGA),质量分数为1%的酵母提取物,0.38 μmol/L CaCl2,100 mmol/L Tri-HCl,pH8.5;聚半乳糖醛酸酶(Polygalacturonase)鉴别培养基:以TSA培养基为基础,添加质量分数为1%的PGA,质量分数为1%的酵母提取物,2.2 mmol/L EDTA,110 mmol/L乙酸钠,pH5.5。
1.2.2 四川泡菜制备 将新鲜红皮萝卜去除叶丛和须根并用清水洗净,晾干多余水分。取约3 kg洗净晾干的红皮萝卜于5 L泡菜坛中,加入3 L含盐质量浓度为60 g/L的凉开水,凉开水中含已活化L.plantarumE11(终浓度为106CFU/mL)。随后,分别采用发酵坛口暴露、间歇暴露和封闭三种不同空气暴露程度进行四川泡菜发酵,以模拟不同的空气暴露情况。具体方法如表1所示,其中每种发酵方式泡制3坛,共9坛,在50%RH空气湿度下常温发酵。分别在发酵的第0、8、16、32、48和64 d进行取样用于后续分析。

表1 不同空气暴露条件下制备四川泡菜Table 1 Preparation of Sichuan pickle under different air exposure conditions
1.2.3 pH测定 使用pHS-3C酸度计测定泡菜盐卤的pH。
1.2.4 微生物计数 微生物分离和计数参照GB 4789.2-2016《食品安全国家标准 食品微生物学检验 菌落总数测定》制备样品稀释液,选取适当的稀释梯度涂布于培养基。TSA培养基用于细菌总数的分离和计数,MRS琼脂培养基用于乳酸菌的分离和计数,虎红琼脂培养基用于霉菌和酵母菌的分离和计数。样品涂布后平板于30 ℃恒温培养箱培养24~48 h。
1.2.5 感官评价 不同空气暴露条件下四川泡菜的感官评价采用综合评分法,总分为100分,泡菜的色泽、香气、盐卤状态、膜醭状态四个评价指标各占25分。30名参评人员均为接受过食品感官评价培训的专业人员,男女比例为1∶1,统一采用盲评打分法进行评价,评分细则详见表2。
表2 不同空气暴露条件下四川泡菜感官评价评分细则Table 2 Sensory evaluation and scoring rules of Sichuan pickle under different air exposure conditions
1.2.6 质构特性测定 样品前处理:取一整个红皮萝卜,将其按图1所示均匀切分为四块后取1~4位点为测试点,分别将各位点切分为长宽3 cm,厚2 cm的长方体使用TA-XT Plus质构分析仪P/5探头进行质构测定。测试程序:测试前30 mm/min,测试中20 mm/min,测试后30 mm/min,压缩量50%,圧缩力5 g。
图1 样品切分及测试点示意图Fig.1 Sample segmentation and test point schematic注;1:前段,2:中心,3:后段,4:表皮。
1.2.7 产植物细胞壁降解酶微生物的分离 分别从TSA、MRS和虎红琼脂平板上挑取单克隆若干点种于6种产酶特性鉴别培养基上,聚半乳糖醛酸酶和果胶酶鉴别培养基于28 ℃培养24 h后观察产PCWDEs情况,其余鉴别培养基均于30 ℃恒温培养箱培养24 h后观察产PCWDEs情况。其中,聚半乳糖醛酸酶和果胶酶鉴别培养基需用4 mol/L盐酸加在菌落周围,观察透明区域;淀粉酶鉴别培养基需用碘液染色,观察透明区域;纤维素酶和木聚糖鉴别培养基需用1 g/L刚果红溶液染色15~30 min,再用1 mol/L NaCl冲洗数次,观察透明区域;蛋白酶鉴别培养基可直接观察透明区域[10]。
1.2.8 产植物细胞壁降解酶微生物的鉴定 分别将产植物细胞壁降解酶微生物接种于TSB培养基中,30 ℃摇床培养过夜并获得菌悬液。使用快速提取法提取菌液中总基因组DNA[11],并进行1%琼脂糖凝胶电泳检测。以总基因组为模板,分别利用细菌16S rDNA扩增引物1490R:5′-GGTTACCTTGTTAC GACTT-3′,Eu27F:5′-AGAGTTTGATCCTGGCTCAG-3′和真菌ITS扩增引物ITS4:5′-TCCTCCG CTTATTGATATGC-3′,ITS5:5′-GGAAGTAAAA GTCGTAACAAGG-3′进行目的DNA的PCR扩增。前者扩增程序为:95 ℃ 5 min;95 ℃ 1 min,50 ℃ 1 min,72 ℃ 2 min,35个循环;72 ℃ 10 min;后者扩增程序为:94 ℃ 3 min;94 ℃ 30 s,40 ℃ 1 min,72 ℃ 1 min,30个循环,72 ℃ 10 min。将符合测序条件的扩增产物送往成都擎科梓熙生物技术有限公司测序,测序结果在NCBI GenBank Database中进行BLAST比对,序列同源性≥97%时可认为是同一个属,同源性≥98%时可认为是同一个种[12]。
1.3 数据处理
通过Origin 2018、MEGA 6.0、Clustal X、IBM SPSS Statistics 20、Excel 2007 等软件对三个平行实验得到的数据进行处理。
2 结果与分析
2.1 不同空气暴露条件下四川泡菜发酵过程中的pH变化分析
不同空气暴露条件下四川泡菜发酵过程中的pH变化如表3所示,在发酵的前16 d,不同空气暴露条件下四川泡菜盐卤的pH都表现出相同的下降趋势,并均在发酵第16 d降至3.0,这是由于在四川泡菜发酵前期,乳酸菌能够消耗蔬菜中的糖类产生乳酸[13],从而导致盐卤中的pH下降。空气的渗入对四川泡菜的前期发酵未造成明显影响,但随着发酵时间的继续增加,暴露式发酵四川泡菜的pH开始出现明显上升,在发酵64 d时已上升至6.5,间歇暴露式发酵四川泡菜的pH也上升至3.5,但封闭式发酵四川泡菜的pH仍维持在3.0。盐卤pH回升是泡菜腐败的重要标志之一[14],暴露条件下空气的大量渗入促进了某些真菌的生长,真菌是引起泡菜腐败的主要微生物[15]。
表3 不同空气暴露条件下四川泡菜发酵过程中的pH变化Table 3 pH changes during the fermentation of Sichuan pickle in different air exposure conditions
2.2 不同空气暴露条件下四川泡菜发酵过程中的微生物变化分析
分析图2可知,发酵前16 d不同空气暴露条件下四川泡菜中的微生物数量变化趋势基本一致。从发酵起始至第8 d,以乳酸菌为主的总菌数量增加1~2个数量级,乳酸菌数量的增加导致了泡菜盐卤pH的下降。第8~16 d,pH进一步降至3.0,以乳酸菌为主的总菌数量开始回落,这主要是由于低pH抑制了细菌的生长,该结果与Xiong等[16]的研究一致。从第16 d起,不同空气暴露条件下四川泡菜中的微生物的数量开始出现差异。封闭式发酵四川泡菜中的总菌、乳酸菌和真菌的数量未出现明显上升或下降。间歇暴露式发酵四川泡菜中总菌和真菌逐渐上升,64 d时分别达到7.73±0.38和6.69±0.33 lg CFU/mL,而乳酸菌数量与第16 d相比,下降了1个数量级。暴露式发酵四川泡菜中总菌和真菌数量从第16 d开始增加,第48 d时总菌数已高于108CFU/mL,真菌数量于64 d时达到7.60±0.38 lg CFU/mL,而乳酸菌已降至4.03±0.20 lg CFU/mL,此时真菌占暴露式发酵四川泡菜微生物的主导地位,引起暴露式发酵四川泡菜pH上升。
图2 不同空气暴露条件下四川泡菜 发酵过程中的微生物变化Fig.2 Microbial changes during the fermentation of Sichuan pickle in different air exposure conditions
2.3 不同空气暴露条件下四川泡菜发酵过程中的感官评价分析
不同空气暴露条件下四川泡菜的pH从第16 d开始出现差异,发酵48 d后暴露式和间歇暴露式发酵四川泡菜出现了明显腐败,因此对发酵16和48 d的四川泡菜进行感官评价,评价结果见表4。封闭式发酵四川泡菜始终具有最高的评分,在整个发酵过程中,封闭式发酵四川泡菜始终具有泡菜特有的鲜香味和澄清的盐卤;间歇暴露式发酵四川泡菜在48 d时出现腐败膜醭,盐卤出现浑浊并伴随着轻微恶臭味;暴露式发酵四川泡菜始终具有最低的评分,在发酵16 d时虽有一定泡菜香味,但盐卤表面有零星腐败膜醭出现,到发酵48 d时,暴露式发酵四川泡菜已不再具有泡菜香味,取而代之的是严重恶臭味,且蔬菜颜色发生改变,盐卤浑浊,膜醭厚重。
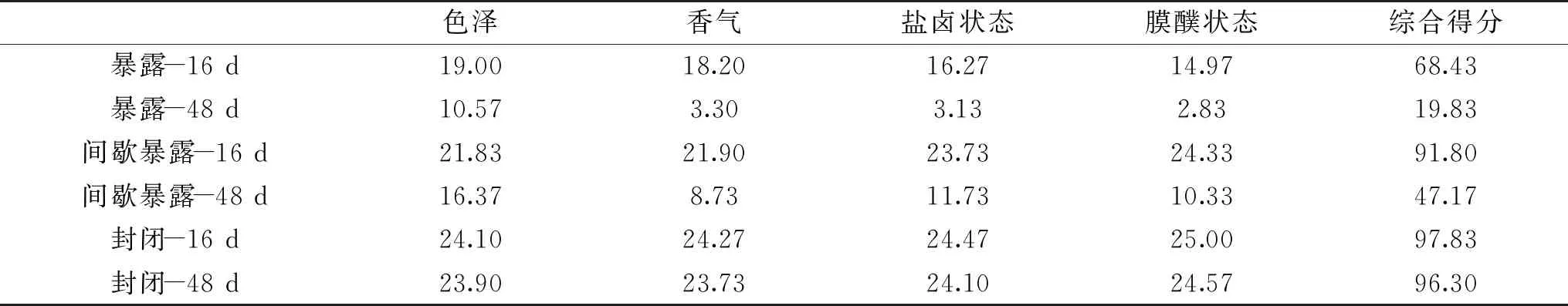
表4 不同空气暴露条件下四川泡菜的感官评价Table 4 Sensory evaluation of Sichuan pickles under different air exposure conditions
2.4 不同空气暴露条件下四川泡菜发酵过程中的质构变化分析
质构是评价四川泡菜品质的重要指标之一[17]。质构的测试方法一般采用人工感官评价和质构仪检测。质构仪可通过监测试样的硬度、弹性、粘聚性、胶着性、咀嚼度、回复性等来反映样品的质构变化。本研究从硬度、脆度、弹性和咀嚼性[18-19]四个方面考察不同空气暴露程度下四川泡菜发酵过程中的质构变化。由图3A~3D可看出,不同空气暴露条件下四川泡菜在发酵第8 d都具有最佳的质构特性。随着发酵时间的增加,三种空气暴露条件下四川泡菜的质构都发生了不同程度的改变,发酵64 d后,和发酵8 d相比,暴露式发酵四川泡菜的硬度下降了93.3%,脆度下降了100%,弹性下降了4.7%,咀嚼性下降了95.8%;间歇暴露式发酵四川泡菜的硬度下降了39.1%,脆度下降了35.6%,弹性下降了4.9%,咀嚼性下降了46.9%;封闭式发酵四川泡菜的硬度下降了52.5%,脆度下降了24.4%,弹性下降了5.3%,咀嚼性下降了57.7%。到四川泡菜发酵后期,由于盐卤的长期浸泡和某些耐酸微生物开始生长繁殖,导致封闭式发酵四川泡菜的质构变差,此外,暴露式和间歇暴露式发酵四川泡菜由于空气渗入,导致盐卤pH升高,泡菜中产PCWDEs的微生物数量增加,也进一步导致了泡菜质构变差。
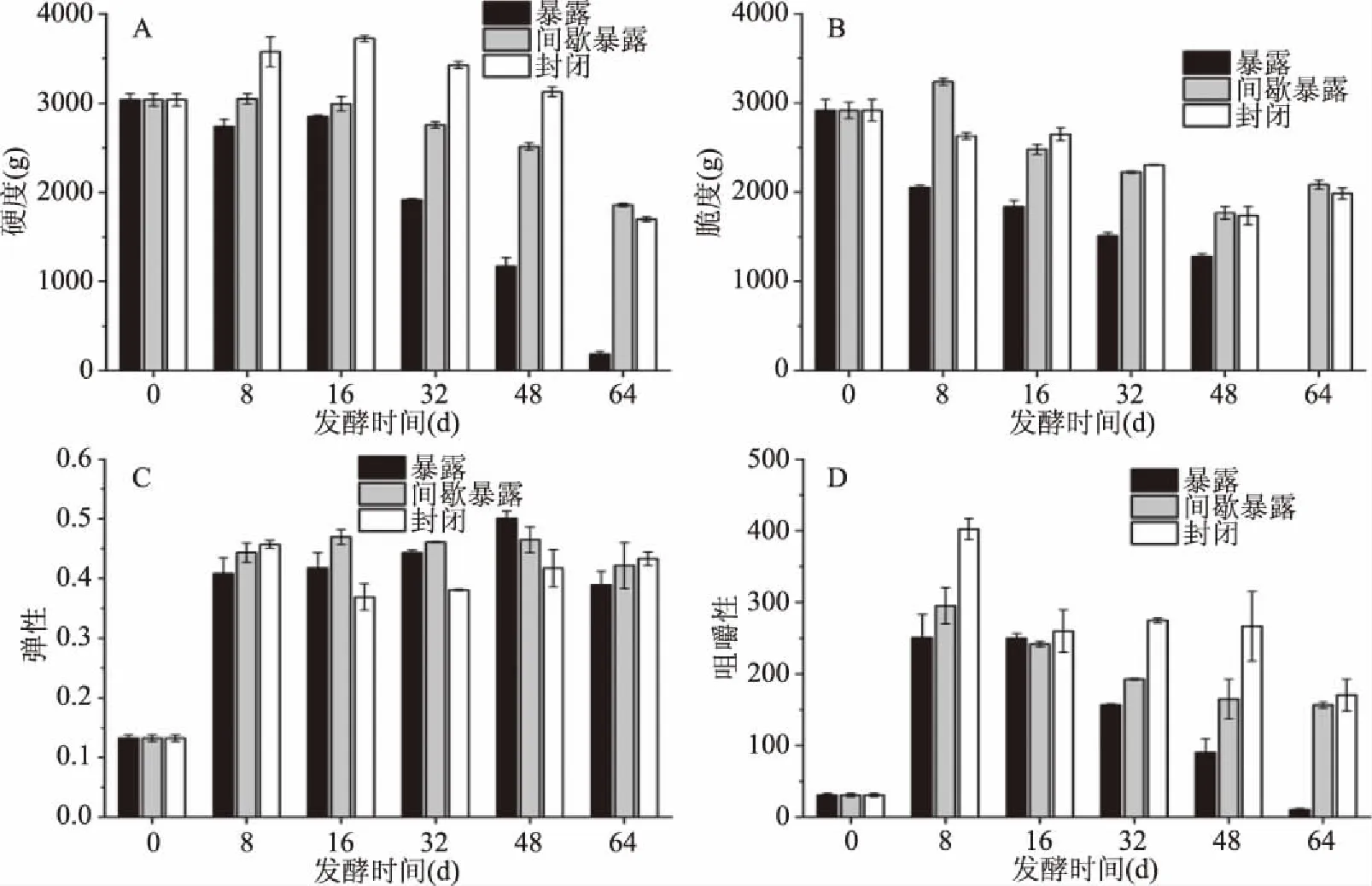
图3 不同空气暴露条件下四川泡菜发酵过程中的质构分析Fig.3 Texture test of Sichuan pickle during the fermentations under different air exposure conditions
2.5 产植物细胞壁降解酶微生物的筛选与鉴定结果分析
微生物产植物细胞壁降解酶是造成泡菜质构发生变化的重要原因之一[4]。从涂布有不同空气暴露程度下泡菜盐卤样品的TSA培养基(发酵第48和64 d)上随机挑取菌落各50株进行产PCWDEs分析,菌株产PCWDEs情况及鉴定结果如表5所示。不同空气暴露条件下四川泡菜发酵过程中产PCWDEs微生物种类不同,发酵48 d时,仅在暴露式发酵四川泡菜中所挑取的50株微生物中分离得到3种共12株产PCWDEs微生物,这些微生物主要产纤维素酶。间歇暴露和封闭式发酵四川泡菜中未分得产PCWDEs微生物。
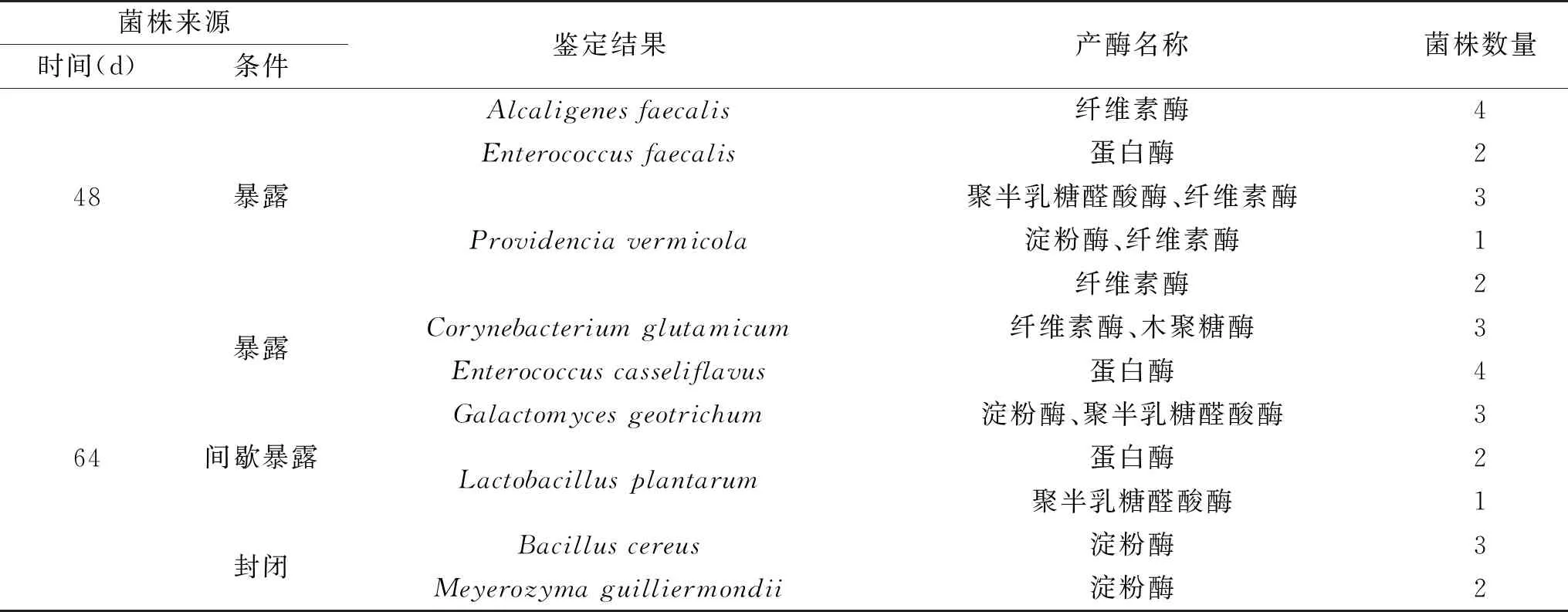
表5 不同空气暴露条件下显著产酶微生物的种类及产酶特性Table 5 Microbial species and their enzymatic properties from different air exposure conditions
发酵64 d后三种空气暴露条件下的四川泡菜中均分离得到了一定数量的产PCWDEs微生物。其中暴露式发酵四川泡菜中分离得到2种共7株产PCWDEs微生物,这些微生物主要产纤维素酶、木聚糖酶和蛋白酶;间歇暴露式发酵四川泡菜中分离得到2种共6株产PCWDEs微生物,这些微生物以产聚半乳糖醛酸酶为主;封闭式发酵四川泡菜中分离得到2种共5株产PCWDEs微生物,这些微生物主要产淀粉酶。本研究分离得到产酶微生物的产酶种类与Kuge等[20-25]的研究结果一致。
对所分离得到的产PCWDEs微生物进一步分析可知,暴露条件分离得到的5种微生物中普罗威登斯菌(Providenciavermicola)、铅黄肠球菌(Enterococcuscasseliflavus)和粪肠球菌(Enterococcusfaecalis)为兼性好氧型微生物,产碱杆菌(Alcaligenesfaecalis)和谷氨酸棒杆菌(Corynebacteriumglutamicum)为专性好氧型微生物;间歇暴露条件下分离得到的土霉菌(Galactomycesgeotrichum)为好氧微生物,植物乳杆菌(Lactobacillusplantarum)为兼性好氧型微生物;封闭条件下分离得到的蜡状芽孢杆菌(Bacilluscereus)和季也蒙毕赤酵母菌(Meyerozymaguilliermondii)为兼性厌氧型微生物。空气的渗入影响了四川泡菜中微生物的生长,尤其促进了暴露式发酵四川泡菜中产PCWDEs的好氧微生物生长,因此,在四川泡菜发酵过程应严格控制空气的渗入。
3 结论
不同空气暴露条件对四川泡菜的品质和产PCWDEs微生物的种类和数量均有影响。暴露式发酵四川泡菜在发酵的前16 d能够正常完成泡菜的发酵,在发酵第8 d具有最佳质构;但随着发酵时间增加,持续的空气暴露导致泡菜盐卤pH升高,泡菜发生软腐,发酵48 d后在随机挑取的50株微生物中就已分得12株以产纤维素酶为主的好氧型和兼性好氧型微生物;发酵64 d后暴露式发酵四川泡菜的pH上升至6.5,真菌数量上升至7.6 lg CFU/mL,和发酵8 d相比泡菜硬度和脆度分别下降了93.2%和100%,并且新分离得到7株产纤维素酶和蛋白酶为主的产PCWDEs微生物。间歇暴露式发酵四川泡菜虽能基本维持四川泡菜的特性,但在发酵64 d后仍出现腐败,主要表现为pH上升至3.5,和发酵8 d的最佳质构相比泡菜硬度和脆度分别下降了39.1%和35.6%,产生恶臭味和腐败膜醭,在该条件下分离得到的6株产PCWDEs微生物多为好氧型微生物。封闭式发酵四川泡菜在整个发酵过程中都能较好的维持四川泡菜的特性,发酵64 d后盐卤pH仍维持在3.0,乳酸菌数量虽下降至5.34 lg CFU/mL,但仍是四川泡菜中的主导微生物,在该条件下分离得到的5株产淀粉酶的微生物多为兼性厌氧型微生物。因此,在四川泡菜的家庭制作和工业生产中都应当最大可能保证四川泡菜的封闭发酵,避免空气渗入影响四川泡菜品质。

