基于X射线相衬显微断层成像的真皮纤维架构表征
元明霞 陈晓伟 宋 波 张祥志 李宏义
1(上海理工大学光电信息与计算机工程学院太赫兹技术创新研究院 上海 200093)
2(北京医院国家老年医学中心中国医学科学院老年医学研究院 北京 100730)
3(中国科学院上海高等研究院上海光源 上海 201204)
维结缔组织在我们体内起着支撑、连接和分隔不同组织和器官的作用,其中的液体被称作组织液[1]。2012年,李宏义教授团队在皮下注射多类示踪剂,通过磁共振成像、荧光素照相法发现了下肢PLCTs的液体传输功能与组织中的纤维骨架有关[2]。2014年,该团队将顺磁示踪剂注入皮下,通过成像技术(磁共振成像、X射线、电子计算机断层扫描(Computed Tomography,CT)、数字荧光照相机)成功研究了成像示踪剂在纤维骨架上的行为[3]。2019年,该团队将荧光示踪剂注入皮下,通过Micro-CT方法表征了存在于结缔组织中定向的纤维骨架[4]。这些研究发现,纤维结缔组织中的组织液能够沿着纤维骨架流动[2-5]。
人体解剖学研究发现,皮肤组织中的两种结构介导了组织液的流动:一种真皮中的纤维组织;另一种皮下组织中纵向分布的脂肪小叶间膈。但是,皮肤组织中的三维纤维骨架结构及有序性尚不清楚。组织学中关于皮肤组织纤维骨架的描述,大多是建立在二维的组织切片数据的基础上,并无真皮层及皮下组织中的三维纤维骨架数据。
传统的X射线吸收成像无法对软组织成清晰像,上海同步辐射光源成像线站利用同步辐射的高相干性可实现相衬成像,无需造影剂、示踪剂也可对生物软组织成清晰像[6]。我们利用上海同步辐射光源BL13W1线站的X射线相衬显微断层成像技术得到了皮肤的三维结构,然后结合计算机图形处理技术,成功表征了人真皮层中纤维骨架的三维结构。同步辐射中的这种原位、无损、高分辨率成像技术在一定程度上很好地达到了实验目的。
上海同步辐射光源具有波长范围宽、高强度、高亮度、高准直性、高偏振与准相干性、可准确计算、高稳定性等一系列比其他人工光源更优异的特性,同步辐射依托其在时间、空间分辨率上的优势,极大地推动了生物医学、材料科学、古生物学、植物学的研究进展[6]。
X射线成像及生物医学应用光束线站[7](BL13W1)光子能量范围8~72.5 keV,线站可提供基于多种衬度机制(吸收、相位、荧光等)的无损、高分辨、动态、定量、三维的X射线成像方法。其中静态显微CT成像的空间分辨率达到0.32 μm/像素,有效提高了样品三维结构的重建质量。上海交通大学Med-X学院徐学敏研究组利用上海光源成像线站对裸鼠Lewis肺癌血管造影成像,清晰地分辨出了肿瘤新生血管与正常血管[8]。我们表征真皮层中的纤维骨架时,空间分辨率达到了0.65 μm/像素。
1 实验部分
1.1 样品处理
为了实现高分辨率表征三维结构的目的,我们在上海光源BL13W1线站开展了实验,BL13W1线站的X射线相衬显微断层成像技术[9]对于样品的三维大小、是否脱水处理有着严格的要求。
本研究的样品取自人体标本手部的皮肤组织(伦理号:2016BJYYEC-066-02)。处理方法:组织样品做脱细胞处理,用1 mol·L-1NaCl溶液处理,振荡器振荡24 h。将样品用正己烷浸泡、摇动24 h,然后用磷酸缓冲盐溶液(Phosphate Buffer Saline,PBS)洗涤样品,浸泡在1%十二烷基磺酸钠溶液(Sodium Dodecyl Sulfate,SDS)中,摇动 24 h。PBS 洗涤样品,浸泡在0.5%胰蛋白酶溶液中,摇动2.5 h。将样品冷冻干燥24 h,并浸入质量分数为10%的硝酸银溶液中0.5 h。将质量分数为3%的氢氧化钠溶液与硝酸银溶液以体积比1:1混合。0.5 h后,用去离子水轻轻洗涤样品,再次冷冻干燥处理[4]。
1.2 实验站包埋样品
将巴士吸管头部剪下,剪下部分用来放置被组织包埋液包埋的样品。用镊子夹住巴士吸管头部,将其固定在冷冻切片机中,切片机温度设定为-20℃,等待样品冷冻成块状。
1.3 冷冻切片机切片
为了达到500 μm的实验样品要求,我们进行了冷冻切片处理。
使用上海同步辐射光源BL08U1-B线站的Leica切片机将冷冻后的实验样品块切成厚度在500 μm的切片。在切片过程中,先粗调后细调切片厚度,逼近组织块前切换为500 μm。将处理后的切片放于清水中解冻,用铜网打捞飘在水面上的切片。把切片放在载玻片上自然风干,用手术刀将切片手动切割为三个维度尺寸均在500 μm附近的待成像样品。
1.4 BL13W1线站样品安装和图像采集
将样品放置于10 μL移液枪头中,用胶水密封移液枪头来固定样品块,防止样品在转动过程中发生位置偏移。然后,将内置样品的移液枪头用胶带固定于旋转台上,进行X射线相衬显微断层成像。
实验在上海光源BL13W1线站进行,采用类同轴相位成像方法,如图1所示。光子能量18 keV,能量分辨率ΔE/E=5×10-3,样品点处光斑尺寸45 mm(H)×5mm(V),光子通量 1× 109s-1⋅mm-2,体素为0.65μm,样品与电荷耦合器件(Charge Coupled Device,CCD)之间距离为 10cm,成像视野为1331μm × 1331μm,从 180°范围内等步长采集 1 200幅投影,每幅投影图像曝光时间为2s,每隔120张投影采集2张背景图片,总共采集22张背景图像。完成后,关闭光源采集5张暗电流图像,整个采集过程约为3000s[9-12]。采集完成后,将样品取下放于聚乙烯离心管中进行保存标记。
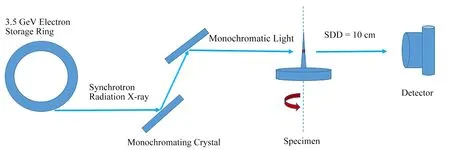
图1 类同轴相位成像光路示意图Fig.1 Schematic diagram of coaxial phase-like imaging optical path
1.5 CT三维重构及投影图像
一系列二维切片图像在软件Amira中进行三维可视化重构,重构结果如图2。

图2 目标样品的三维轮廓Fig.2 3D contour of the target sample
从采集的1 200张投影图像中抽取不同轮廓的投影图像进行表征,如图3所示。
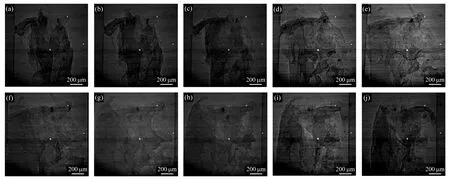
图3 不同轮廓的投影图像采集角度(a)0°~18°,(b)19°~36°,(c)37°~54°,(d)55°~72°,(e)73°~90°,(f)91°~108°,(g)109°~126°,(h)127°~144°,(i)145°~162°,(j)163°~180°Fig.3 Projection image acquisition angles with different contours(a)0°~18°,(b)19°~36°,(c)37°~54°,(d)55°~72°,(e)73°~90°,(f)91°~108°,(g)109°~126°,(h)127°~144°,(i)145°~162°,(j)163°~180°
2 实验数据分析
2.1 基于BL13W1线站的图像分析
得到的CT投影图像需借助切片重构软件PITRE进行图像前期处理,处理流程:图片重命名—相位恢复—断层重构—图片剪切、转换。
需要注意的是,相位恢复过程中,参数delta/beta的调整。该参数初始默认值为1 000,采用二分法快速选定最为合适的数值10进行相位恢复操作。一般而言,该参数越低,对比越强,边缘增强,细节更加清楚。相位恢复算法[13]见公式:

式中:F和F-1表示傅里叶变换和傅里叶逆变换;I(x,y)和I0(x,y)表示样品投影和背景光强;物像距离SDD为Z;δ和β表示样品的相位和吸收信息。采用滤波反投影算法[14]对相位恢复后的投影图像进行断层重构,得到32 bit断层图像,后经位数转换得到8 bit断层图像。
鉴于此次研究样品的特殊性,目标样品灰度值与管壁极为接近。在Amira软件中进行自动阈值分割时,无法做到既去除管壁又保留样品的目的。PITRE软件得到的8 bit图片在清除移液枪头管壁影像过程中存在一定的技术难度。改用图像处理软件ImageJ进行图像再加工,尽可能在不缺失目标信息的基础上去除管壁影像。
2.2 基于ImageJ、Amira软件的图像分析
为了获得样品可靠准确的三维结构信息,通过ImageJ软件[15-17]对8 bit图片进行再加工。首先使用软件的批处理功能将样品四周的管壁清除,如图4(b),然后将处理后的图像栈整合。实验所用的移液枪头由于上下管径不一致,增加了后期清除管壁影像过程中的繁琐程度。

图4 清除8 bit图片中的管壁影像(a)清除前,(b)清除后Fig.4 Clearing the wall image of the 8-bit data picture(a)Before cleaning,(b)After clearing
为了降低后期图像处理的难度,实验前尽量使用上下管径一致的透明管来放置待成像样品。为了得到较为清晰的纤维骨架,对8 bit图片进行二值化处理[18],处理流程为:导入图片、创建副本、阈值分割、二值化处理,流程图如图5所示。
在完成二值化处理之后,分别进行灰度值反转或轮廓提取,如图6。在Amira软件中进行三维重构,得到纤维骨架在真皮层纤维结缔组织中的分布。

图5 二值化图像的灰度化处理流程Fig.5 Grayscale processing flow of binarized image
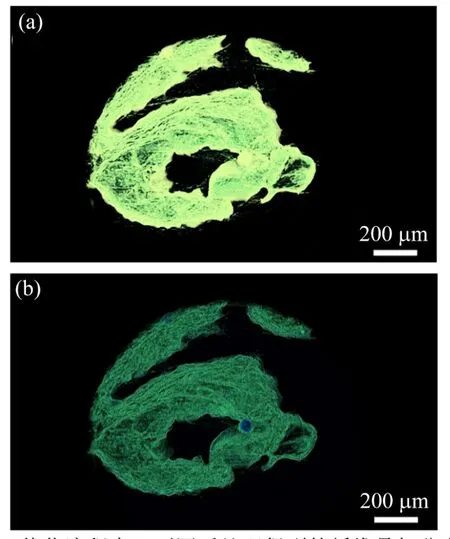
图6 二值化流程中,不同后处理得到的纤维骨架分布(a)灰度值反转得到纤维骨架分布,(b)轮廓提取得到纤维骨架分布Fig.6 Fiber skeleton distribution obtained by different postprocessing during the binarization process(a)Gray value reversal to obtain fiber skeleton distribution,(b)Contour processing to obtain fiber skeleton distribution
从2 048张8 bit图片中选取纤维分布最为密集的100 slice进行纤维骨架表征。依据真皮层深度与纤维分布之间的关系[19]可知,该区域取自真皮中间层。
2.3 纤维骨架在真皮中间层中的分布
从得到的图片数据,同样可以发现:纤维分布与真皮层深度具有一定的关系。在真皮浅层(靠近表皮处)以及真皮深层(靠近皮下处)的纤维分布要比真皮中间层稀疏。图7(a)、(b)取自真皮中间层同一区域,唯一区别为图7(a)100 slice切片图像三维正投影,图7(b)10 slice切片图像三维正投影。
通过分析图7中的三维数据,我们发现:纤维丝在真皮中间层分布具有一定的趋向性。在真皮中间层中,纤维束较细,排列紧密,不互相交织,纤维丝几乎平行于外边缘定向延伸。这一分布特点间接地表明了组织液在纤维丝表面传输的长程有序性、趋向性。
在共聚焦显微镜观察下,无论是沿血管长轴分布的纤维丝还是皮下沿通路长轴分布的纤维丝都被荧光素染色[1]。因此,真皮中间层中纵向延伸的纤维骨架也可能是组织液传输的途径。
在组织学中,结缔组织的定向纤维骨架被确定为长距离皮肤通路。比较图7(a)、(b),也容易看出纤维丝骨架在真皮中间层中的大致走向。纤维骨架延伸取向并不只是局限在平行于皮肤表面的维度,也可能以贯穿真皮中间层的形式存在。这进一步说明了真皮层纤维结缔组织中组织液传输通路纤维骨架结构的复杂性。结构决定功能,可见存在于纤维丝表面的生物界面流体传输通路在组织液长程流动过程中的重要意义。
2.4 纤维骨架在真皮浅层、深层中的分布
纤维丝除了在真皮中间层分布以外,在浅层、深层也会有少量分布[19-20]。在真皮层中,靠近表皮和靠近皮下的区域细胞间隙增大,纤维丝含量明显减少,分布较为稀疏。在真皮深层处,纤维较粗,排列疏松,交织成网状,纤维会以分枝的方式延伸生长,如图8(b),与皮肤表面平行者居多。这个深度区域中较少的纤维成分有可能降低全层皮肤的生物力学梯度差异。

图8 真皮浅层、深层的纤维分布(a)真皮层浅层,(b)真皮层深层Fig.8 Fiber distribution in superficial and deep dermis(a)Superficial dermis,(b)Deep dermis
实验数据也证实了定向纤维结缔组织的结构框架由多层、纵向组装和交织的微米级纤维组成。在沿着长距离,定向且有序组装的纤维进行拓扑连接的界面传输区域的网络上,组织液可以在纤维结缔组织的网状结构中传输,将之称为“纤维组织界面传输”[4]。
对海南人脸部皮肤的相关研究表明:皮肤内胶原纤维随年龄增大,密度变大,纤维变粗,含量从25岁起未见减少现象,出现持平,甚至含量有所增加。在35~45岁区间,胶原纤维含量迅速减少。弹性纤维与胶原纤维相互交织分布,随年龄增大,形态断裂、增粗,片段化,局部成块状分布[21]。这充分揭示,纤维丝表面的组织液传输在人类皮肤研究中有可能存在的生物学意义。
2.5 真皮层中纤维骨架的三维表征
从PITRE中得到的8 bit图片在ImageJ中进行再处理后,导入Amira中进行三维结构表征。表征结构如图9所示。
通过对比图9(a)、(b),很容易发现:真皮中间层纤维分布较为密集,真皮深层纤维分布较为稀疏。8 bit图片在Amira中的三维结构可视化表征进一步佐证了纤维丝在真皮层不同深度的分布特点。
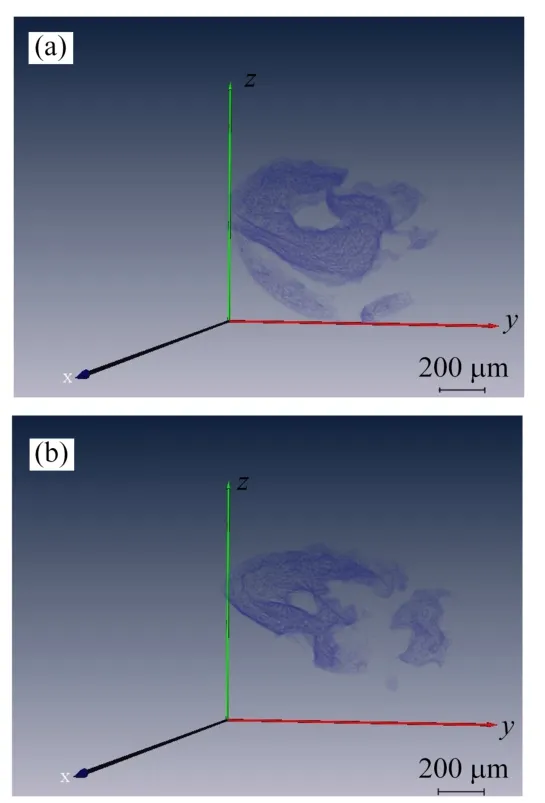
图9 真皮中间层、深层的三维可视化表征(a)真皮中间层,(b)真皮深层Fig.9 Three-dimensional visualization of the middle and deep layers of the dermis(a)Middle layer of the dermis,(b)Deep layer of the dermis
3 结语
纤维结缔组织中的纤维骨架结构研究,一直缺少三维结构信息。目前,我们通过上海光源X射线相衬显微断层成像技术获得原始CT投影数据,经过一系列图像处理软件ImageJ、Amira重构得到真皮层纤维骨架高分辨率的三维结构信息,为理解存在于纤维轨道中的组织液流动给出了高分辨的研究方法。本次实验中用到的是静态显微CT成像技术,在分辨率层面较先前的成像技术有了很大的提高,分辨率达到了0.65 μm/像素。基于BL13W1线站上动态显微CT成像技术的成熟,我们未来可以结合原位冷冻成像技术来研究荧光示踪之后的组织液在纤维骨架表面动态传输的机制。
合肥同步辐射光源已经实现了以软X射线研究活体生物样品的二维或三维高分辨显微成像的目的。软X射线波段存在2.34(氧的K吸收边)~4.38 nm(碳的K吸收边)范围的“水窗”,对此范围能量的X射线,水的吸收很弱,而有机分子的吸收强烈,特别适合于有水的活体生物样品。对于进一步研究组织液在纤维丝表面的研究可起到技术支持,成功解决了上海光源脱水处理法对研究目的的局限性[22]。
三维纤维骨架的高分辨率可视化表征将有助于推动组织液长程流动的研究,将为生物医学与图像处理之间建立更为密切的联系。
致谢 感谢上海光源提供的技术支持与帮助,感谢北京医院提供的试验样品。

